酮基布洛芬单室渗透泵片的稳定性考察
王汝兴,郭玉成,于海龙
(河北省中药研究与开发重点实验室/承德医学院中药研究所,河北 承德 067000)
酮基布洛芬单室渗透泵片的稳定性考察
王汝兴,郭玉成,于海龙
(河北省中药研究与开发重点实验室/承德医学院中药研究所,河北承德067000)
酮基布洛芬;单室渗透泵片;稳定性
酮基布洛芬(ketoprofen)是一种非甾体类消炎、镇痛、解热药,特点是高效低毒,疗效优于同类药-布洛芬。酮基布洛芬口服吸收迅速,消除较快,普通片剂一般每天给药需3-4次[1-3]。因此,把酮基布洛芬制成控释制剂对于减小血药浓度的波动以及提高药物的生物利用度具有重要意义[4-5]。
渗透泵制剂是控释制剂的典型代表,具有零级释药,释药速度恒定,以及受释药环境影响较小的特点,能避免普通口服制剂造成的血药浓度波动较大的现象,可以极大提高药物安全性和有效性。评价一种控释制剂的成功与否,零级释放是关键,但制剂的稳定性同样非常重要。为此,本研究着重探讨了酮基布洛芬单室型渗透泵片的稳定性。
1 材料与仪器
ZRS-4智能溶出仪(天津大学精密仪器厂);Aiset YLE-2000光照仪(重庆市永生实验仪器厂);紫外可见分光光度仪HP-8453(美国惠普公司);高效液相色谱仪(日本分光公司);色谱柱Sino Chrom C18柱(4.6mm×250 mm,5☒m)。酮基布洛芬原料药(西南合成制药厂,纯度99.99%,批号40203072);酮基布洛芬单室型控释片(自制,50mg/片,批号20121029);其余试剂均为分析纯。
2 方法和结果
2.1考察项目和方法
2.1.1酮基布洛芬的含量测定[6]:⑴吸收波长的确定:取7.0mg酮基布洛芬于100ml容量瓶中,以纯化水定容,取3ml于50ml容量瓶中,以纯化水定容,在200-400nm范围内以紫外扫描仪扫描,确定酮基布洛芬在260nm处有最大吸收,辅料无干扰。⑵标准曲线的制备:精密取7.3mg酮基布洛芬于100ml容量瓶中,纯化水定容,超声30min,分别取2.5、4.0、5.0、6.0、7.0、7.5ml于50ml容量瓶中,以纯化水定容,以纯化水为空白,在260nm处测定吸收度(A),以吸收度对浓度作图。测得回归方程为:A=0.06272C+0.00781 ,r=0.9998,线性范围为3.65-10.95μg/ml。
2.1.2累积释放度测定:取自制渗透泵片1片,按照溶出度测定法(中国药典2010年版,二部附录XD第一法),以水500ml为释放递质,转速为100 r/min,水浴温度为(37 ± 0.5)℃,依法操作,分别于1、2、4、6、8、10、12h,取溶液10ml,以0.45μm滤膜滤过,弃去初滤液,取续滤液5.0ml,为供试溶液,按照“含量测定”项下测定累积释放度。
2.1.3有关物质色谱条件:⑴色谱柱Sino Chrom C18柱(4.6 mm×250mm,5μm);流动相为甲醇-水(含0.03%磷酸)(65:35),流速1.0ml/min;检测波长260nm;柱温30℃;进样量10μl,理论板数按酮基布洛芬峰计算应不低于2500。酮基布洛芬峰与其相邻杂质峰之间的分离度应符合要求,计算杂质含量,见表1。⑵取酮基布洛芬适量,精密称定,加流动相超声20min,待溶解后定量稀释成200μg/ml的酮基布洛芬溶液,摇匀,滤过,取续滤液作为供试品溶液。取供试品溶液适量,以流动相稀释成含酮基布洛芬10μg/ml溶液,作为对照溶液。取对照溶液及供试品溶液20μl分别注入液相色谱仪,计算供试品溶液的色谱图中所显杂质峰的总面积,应不得大于对照溶液主成分的峰面积的5.0%。
2.2影响因素实验根据中国药典2010年版附录“药物稳定性试验指导原则”规定,采用处方筛选中较各项指标较优处方的小试样品试验,试验条件分别为高温(60℃)、高湿(90±5%)、强光(4500±500Lx),分别于5、10d取样测定其累计释放度、有关物质、增失重及酮基布洛芬含量,与0天测定结果相比较,结果见表1。实验结果表明,本品于高温情况下,略失重,含量变化不大,但颜色无变化,释放度无变化,有关物质无大变化。在高湿情况下,渗透泵片颜色无变化,含量变化不大,但渗透泵片增重较大而且释放加快,有关物质增加较大,提示本品对水分非常敏感。在光照情况下,渗透泵片颜色变深,释放加快。
2.3加速试验将三批样品(采用铝塑泡罩,模拟市售包装)放入高密度聚乙烯塑料瓶中密封,于温度(40±2)℃、相对湿度(75±5)%的条件下放置6个月,在试验期间的第0、1、2、3、6个月末取样测定其累计释放度、有关物质及酮基布洛芬含量,结果见表2。加速试验6个月,有关物质增加,说明样品在本研究中包装情况下容易发生质变,影响产品质量,提示应改换为防潮包装。
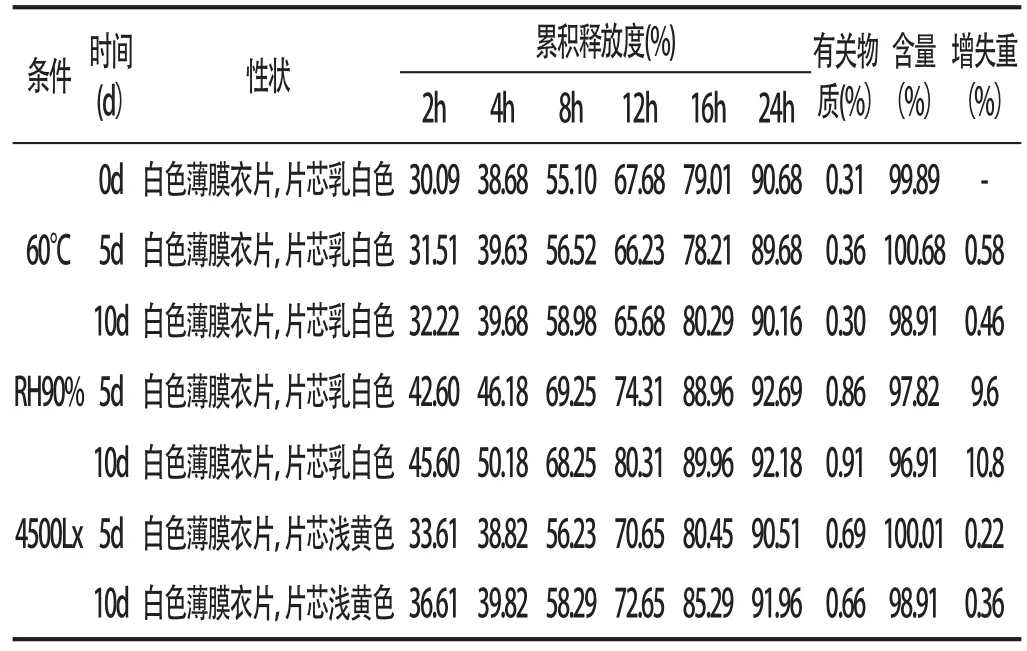
表1 酮基布洛芬渗透泵片影响因素试验结果
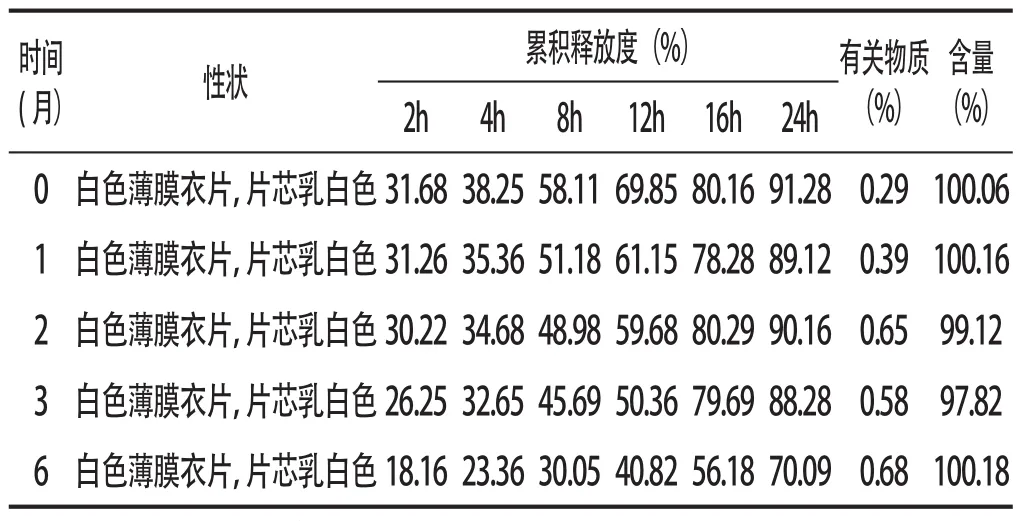
表2 酮基布洛芬渗透泵片加速试验结果
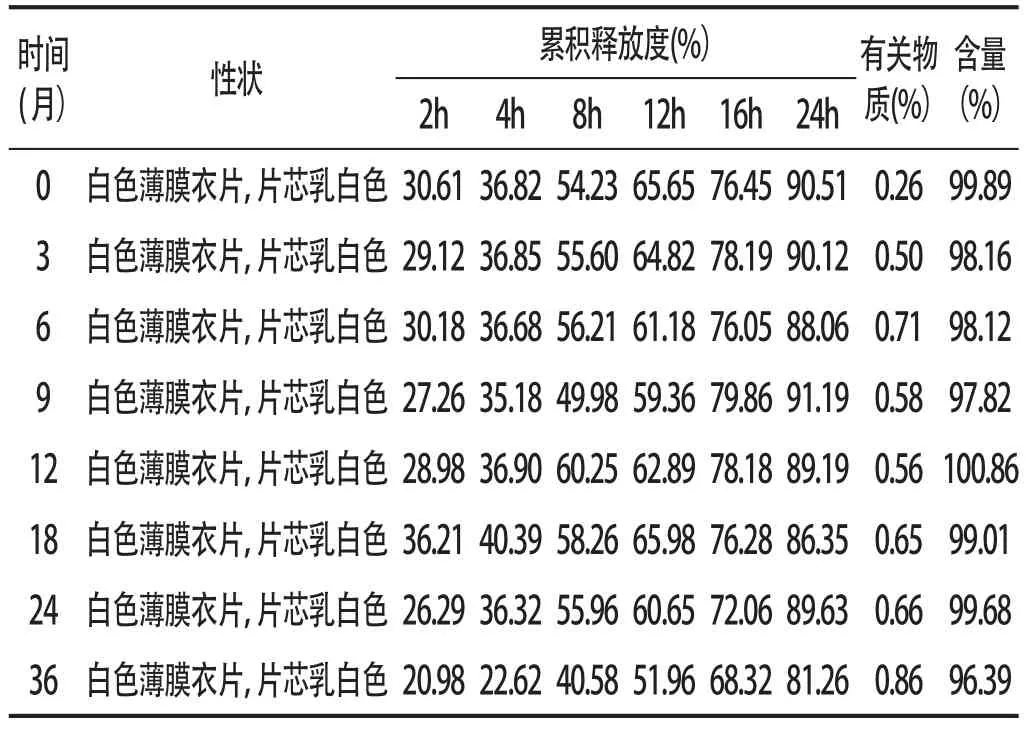
表3 酮基布洛芬渗透泵片长期试验测定结果
2.4长期留样研究取三批样品(采用铝塑泡罩,模拟市售包装),于(25±2)℃、相对湿度(60±10%)条件下放置36个月,每3个月取样1次,分别于0、3、6、9、12、18、24、36个月末取样测定其累计释放度、有关物质及酮基布洛芬含量,结果见表3。长期试验24个月,各项指标如样品外观、释放度、有关物质、含量均符合规定,但在第36个月,第8h以后样品释放明显变慢。
3 讨论
本研究所使用的释放度测定方法、含量测定方法以及有关物质测定方法均符合药典规定。辅料不干扰释放度和含量测定,重复性好,准确度高。有关物质的测定方法专属性强,色谱峰与主峰的分离度大于1.5%。
酮基布洛芬渗透泵片在高温60℃、高湿RH90%及强光照射的条件下放置10d。在高温条件下,外观、释放度、有关物质及含量均无大变化,说明本品对高温稳定。在光照条件下,由于渗透泵片外部的薄膜包衣材料的老化造成颜色加深,说明该渗透泵片对高湿和光照不稳定,所以,本品应在密闭、避光及干燥阴凉环境下保存。本品在高湿情况下,由于渗透泵片的包衣膜材料中所含有的聚乙烯吡咯烷酮具有强吸湿性,故片芯中含有的高渗性物质在高湿环境下就易于吸潮溶解,因此,长时间暴露在潮湿环境下,片芯将吸水膨胀,从而造成片面上的小孔中会有内容物流出。综上所述,酮基布洛芬渗透泵片在生产、包装、运输及贮存过程中应充分考虑到温度、光照以及湿度等问题,应在密闭、干燥、避光的条件下保存。
[1]Modi NB, Linfemulder B, Gupta SK. Single and multiple-dose pharmacokinetics of an oral once-a-day osmotic controlled-release OROS (methylphenidate HCl) formulation [J]. J Clin Pharmacol,2000, 40 (4): 379-382.
[2]Gupta SK, Shah JC, Hwang SS. Pharmacokinetics and pharmacodynamic characterization of OROS and immediaterelease amitriptyline [J]. Br J Clin pharmacol, 1999, 48 (1): 71-73.
[3]Gupta SK, Shah JC, Guinta D, et al. multiple-dose pharmacokinetics and pharmacodynamics of OROS and immediate-release amitriptyline hydrocholoride formulation [J]. J Clin Pharmacol, 1998, 38(1): 60-63.
[4]王汝兴,张宇丽,陈大为.酮基布洛芬单室渗透泵片在家犬体内的药动学和相对生物利用度[J].中国医院药学杂志,2008,28,(2):106-108.
[5]王汝兴,张宇丽,陈大为.酮洛芬渗透泵型控释片的体外释放与犬体内吸收的相关性[J].中国医药工业杂志,2006,37(2):95-98.
[6]王汝兴,许士奇,陈大为.酮基布洛芬单室型渗透泵片制备工艺的探讨[J].中国医院药学杂志,2006,26(3):304-306.
(技术方法栏目编辑:张健)
R944
A
1004-6879(2015)05-0423-02
2015-01-20)

