miR-155在骨髓间充质干细胞成骨分化中的调控作用
杨晓庆 苏 健
北京市医疗器械检验所,北京 100700
miR-155在骨髓间充质干细胞成骨分化中的调控作用
杨晓庆 苏 健▲
北京市医疗器械检验所,北京 100700
目的探讨miR-155对骨髓间充质干细胞(BMSCs)向成骨分化能力的影响。 方法从C57/BL6J小鼠骨髓中分离BMSCs,BMSCs按照2×105个/mL的浓度接种,过夜贴壁后进行转染,通过miR-155模拟剂及miR-155抑制剂改变miR-155在BMSCs中的表达,同时设立miRNA模拟剂的同型对照和miRNA抑制剂的同型对照。采用qRT-PCR检测不同处理后BMSCs中骨标志基因RUNX2、骨钙蛋白(OCN)、骨桥蛋白和Ⅰ型胶原(Col-Ⅰ)的表达;通过碱性磷酸酶(ALP)染色和ALP活性分析观察ALP的表达和酶活性;通过茜素红染色检测细胞外钙盐结节的形成。 结果地塞米松使miR-155在BMSCs中的表达上调(13.56±0.45)倍(P<0.01),miR-155在BMSCs向成骨细胞诱导第4天时表达显著下调 (P<0.01)。转染miR-155模拟剂的BMSCs成骨诱导第12天时RUNX2、OCN和Col-Ⅰ的表达明显低于其同型对照(P<0.01),ALP活性明显低于其同型对照(P<0.01),ALP染色和茜素红染色的阳性细胞数也明显少于其同型对照。转染miR-155抑制剂的BMSCs成骨诱导第12天时RUNX2、OCN和Col-Ⅰ的表达明显高于其同型对照(P<0.05或P<0.01),ALP活性明显高于其同型对照,ALP染色和茜素红染色的阳性细胞数也明显多于其同型对照。结论转染miR-155模拟剂能够明显抑制BMSCs向成骨细胞分化,转染miR-155抑制剂则能够明显促进BMSCs分化为成骨细胞。miR-155作为成骨分化的负性调节分子可能成为骨质疏松症等成骨分化异常相关疾病的有效干预靶点。
地塞米松;骨髓间充质干细胞;成骨分化;miR-155;骨质疏松症
骨质疏松症是一种以骨量减少、骨微结构破坏、骨脆性增加和易骨折为特征的全身代谢性骨病。糖皮质激素性骨质疏松症是继发性骨质疏松症的主要类型[1],其预防和治疗是骨科领域亟待解决的严重问题。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)成骨分化能力下降与骨质疏松症发生密切相关[2-3]。成骨分化是一个高度有序的调控过程,起始于成骨关键转录因子RUNX2的活化,导致碱性磷酸酶(alkaline phosphatase,ALP)的表达和活性增高,最终引起以细胞外基质中出现钙沉积为特征的终末成骨细胞形态的改变。与矿化相关的基因包括骨钙蛋白(osteocalcin,OCN)、骨桥蛋白和Ⅰ型胶原(Col-Ⅰ)等。microRNA(miRNA)是一类长约22个核苷酸的非编码RNA分子,通过与靶基因mRNA的碱基配对结合导致其降解或翻译阻遏。miRNAs在骨质疏松症中表达异常[4-6]。地塞米松能够损害BMSCs的成骨分化[7],高浓度的地塞米松可改变BMSCs中miRNA的表达[8],目前,miRNAs在地塞米松抑制成骨分化中的作用还不清楚。本研究以小鼠BMSCs向成骨细胞分化为模型,研究地塞米松诱导高表达的miR-155对BMSCs成骨分化能力的影响,为临床上糖皮质激素性骨质疏松症的预防和治疗提供理论指导。
1 材料与方法
1.1 仪器与试剂
DMEM培养液、小鼠BMSCs培养液、胎牛血清、胰蛋白酶、青霉素和链霉素购于美国Gibco公司;β-甘油磷酸钠、地塞米松、Vit C和茜素红均购于美国Sigma公司;ALP染色试剂盒购于中国医学科学院血液学研究所;ALP活性测定试剂盒购于南京建成生物制品有限公司;脂质体2000转染试剂及转染用培养液opti-MEM购于Invitrogen公司;miR-155模拟剂及抑制剂由上海吉玛生物制药有限公司合成。
1.2 小鼠骨髓MSCs的分离培养
C57/BL6J小鼠,清洁级,8周龄,雌雄各半,共20只,由北京华阜康生物科技股份有限公司提供,动物合格证号:SCXK(京)2009-0004。C57/BL6J小鼠断颈处死,在无菌条件下分离双侧股骨,剪去干髓端,剔除附着的肌肉和结缔组织,然后用1 mL注射器吸取小鼠BMSCs培养液5 mL冲洗股骨髓腔,收细胞悬液,吹打均匀后调整细胞浓度为5×105个/mL接种于T25培养瓶中,于37℃,5%CO2条件下培养,24 h后去除未贴壁的悬浮物,换新鲜小鼠BMSCs培养液继续培养,待细胞汇合度约达90%时,以0.25%的胰蛋白酶消化,按照1∶3的比例传代培养。
1.3 BMSCs的成骨诱导分化及鉴定
成骨诱导分化体系参照文献[8]进行。成骨分化的鉴定:ALP染色及ALP活性实验鉴定早期成骨分化,茜素红染色鉴定晚期成骨分化形成的细胞外钙盐沉积物;qRT-PCR检测成骨相关基因RUNX2、OCN和Col-Ⅰ的相对表达量。
1.3.1 成骨诱导体系 取第3代BMSCs过夜贴壁后,待细胞长到70%~80%的汇合度时,加入成骨诱导液(DMEM基础培养液中含有50 μg/mL的Vit C、10 mmol/L的β-甘油磷酸钠、1 nmol/L的地塞米松)继续培养,每隔2 d换新鲜诱导液,同时设立未加地塞米松处理的对照BMSCs。
1.3.2 ALP染色 按照ALP染色试剂盒说明书操作。BMSCs成骨诱导12 d时终止诱导,用平衡盐溶液洗细胞2次,用4%多聚甲醛溶液固定细胞10 min,弃固定液,每孔加入数滴新鲜配制的ALP染色液,37℃染色2 h,流水冲洗,光镜下观察并拍照。拍照时放大倍数为200倍。
1.3.3 ALP活性分析 根据ALP活性测定试剂盒,通过ELISA方法,用碱性磷酸酶黄色(pNPP)液体底物系统对ALP活性进行测定。以细胞裂解物的总蛋白量对ALP活性进行标准化。紫外分光光度计测定405 nm波长处的吸光度值,并按照公式计算ALP活性值,ALP活性(U/gprot)=[(测定管吸光度值/标准管吸光度值)×标准管对硝基酚量]/总蛋白克数。
1.3.4 茜素红染色 按照试剂说明书进行操作。BMSCs成骨诱导分化16 d终止诱导,用平衡盐溶液洗细胞2次,用75%乙醇溶液固定10 min,弃固定液,每孔加入500 μL的0.1%茜素红-Tris-HCL染色液(pH=8.2)染色30 min,蒸馏水冲洗后,光学显微镜下观察并拍照。拍照时放大倍数为200倍。
1.4 miR-155模拟剂和抑制剂的瞬时转染
BMSCs按照2×105个/mL的浓度接种,过夜贴壁后进行转染,分别转染miR-155模拟剂及miR-155抑制剂,同时设立miRNA模拟剂的同型对照和miRNA抑制剂的同型对照。具体操作按照脂质体2000试剂盒(Invitrogen)说明书进行,转染后细胞放37℃培养箱培养6 h后,吸除转染液,换新鲜培养液或成骨诱导液继续培养。
1.5 总RNA提取、逆转录及qRT-PCR检测成骨基因的表达
收集细胞,用Trizol(Invitrogen)提取总RNA,按照miScript Reverse Transcription Kit(QIAGEN)操作说明书进行逆转录。按照SYBR GreenⅠ试剂盒(TaKaRa)说明书进行qRT-PCR。在Stepone Plus荧光定量PCR仪(美国ABI公司)上进行qRT-PCR反应。反应条件:95℃预变性30 s;95℃变性10 s,60℃退火40 s,循环35次。mRNA检测以GAPDH为内参照。miRNA检测以U6为内参照。U6的逆转录引物为5'-GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCAC TGGATACGACAAAATA-3',PCR引物上游为5'-TCCGATCGTGAAGCGTTC-3',下游为5'-GTGCAGGGTCCGAGGT-3'。目的基因和miRNA的相对表达量采用2-ΔΔCt法进行分析。每组实验重复3次。
1.6 统计学方法
采用SPSS 22.0统计学软件进行数据分析,计量资料数据用均数±标准差()表示,两组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs向成骨诱导分化及鉴定
流式细胞术检测BMSCs表型为CD29、CD44和CD106阳性,CD31和CD34阴性。成骨诱导第12天,ALP染色显示成骨诱导的细胞被染成蓝色(图1A,封四)。成骨诱导第16天,茜素红染色显示成骨诱导的细胞外基质中形成许多橘色、橘红色钙盐结节 (图1B,封四)。qRT-PCR分析显示,以诱导0天的表达值为对照,成骨分化关键转录因子RUNX2在诱导第4天表达上调达(2.11±0.22)倍(P<0.05),在诱导第8天表达最高,达(11.70±0.12)倍(P<0.01);成骨分化晚期标志基因OCN和Col-Ⅰ于诱导第8天表达上调分别达(1.83±0.06)倍和(3.46±0.41)倍(P<0.01),到第 16天持续显著上调分别达 (9.49±0.91)倍和(15.06±1.46)倍(P<0.01)(图2)。
2.2 miR-155模拟剂对BMSCs成骨分化的影响
2.2.1 地塞米松对miR-155表达的影响及miR-155在成骨分化中的表达 高浓度地塞米松培养BMSCs 2 d后,miRNA特异性qRT-PCR分析显示,与未经地塞米松处理的对照BMSCs比较,高浓度地塞米松培养使BMSCs中miR-155表达上升(13.56±0.45)倍(P<0.01)(图3A),miR-155在BMSCs向成骨细胞诱导的第4天表达下降(0.25±0.02)倍(P<0.01)(图3B)。
2.2.2 miR-155模拟剂对成骨相关基因的影响 以miR-155模拟剂和其同型对照瞬时转染BMSCs,24 h后qRT-PCR显示,与miRNA模拟剂的同型对照比较,miR-155模拟剂转染使BMSCs中miR-155表达上调达(23.88±1.64)倍(P<0.01)(图3C)。miR-155模拟剂转染BMSCs 24 h后进行成骨诱导,诱导第12天时qRT-PCR分析显示,与miRNA模拟剂的同型对照比较,miR-155模拟剂成骨相关基因RUNX2的表达量从(11.72±1.63)下降到(4.06±0.80)(P<0.01),OCN从(6.31±0.56)下降到(2.14±0.27)(P<0.01),Col-Ⅰ从(15.56±1.39)下降到(2.14±0.27)(P<0.01)(图3D)。
2.2.3 miR-155模拟剂对ALP表达及活性的影响
成骨诱导第12天ALP染色显示,miR-155模拟剂ALP染色阳性细胞明显少于其同型对照 (图4A,封四)。ALP活性分析显示miR-155模拟剂的ALP活性明显低于其同型对照(P<0.01)(图4B,封四)。
2.2.4 miR-155模拟剂对细胞外钙化基质形成的影响 成骨诱导第16天茜素红染色显示,miR-155模拟剂形成的橘红色细胞外矿化基质明显少于其同型对照(图4C,封四)。
2.3 miR-155抑制剂对BMSCs成骨分化的影响
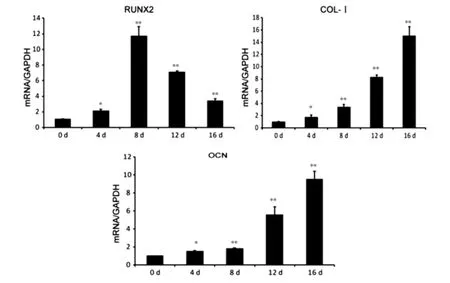
图2 qRT-PCR检测成骨基因表达
2.3.1 miR-155抑制剂转染效率及抑制效率鉴定miR-155的抑制剂和其同型对照瞬时转染BMSCs 24 h后,qRT-PCR测定显示,与miRNA抑制剂的同型对照比较,miR-155的抑制剂转染使BMSCs中miR-155表达下降(0.28±0.03)倍(P<0.01)(图5A)。
2.3.2 miR-155抑制剂对成骨标志基因的影响 miR-155抑制剂转染BMSCs,24 h后进行成骨诱导分化,诱导第12天时qRT-PCR分析显示,与miRNA抑制剂的同型对照比较,转染miRNA抑制剂的成骨细胞中成骨分化关键转录因子RUNX2的相对表达量从(8.97±0.40)上升到(17.35±1.02)(P<0.01),OCN的相对表达量从(5.14±0.12)上升到(9.72±0.99)(P<0.05),Col-Ⅰ的相对表达量从 (9.33±1.09)上升到(18.58± 1.01)(P<0.05)(图5B)。
2.3.3 miR-155抑制剂对ALP染色和活性的影响
成骨诱导第12天,ALP染色显示,miR-155抑制剂的ALP染色阳性的细胞数明显多于其同型对照(图6A,封四)。ALP活性分析显示,转染miR-155抑制剂的成骨细胞中ALP活性明显高于其同型对照 (P<0.01)(图6B,封四)。
2.3.4 miR-155抑制剂对细胞外钙化基质形成的影响 成骨诱导第16天茜素红染色显示,转染miR-155抑制剂后形成的橘红色细胞外矿化基质明显多于其同型对照(图6C,封四)。
3 讨论
激素性骨质疏松症是临床继发性骨质疏松症的最常见类型[7-9]。大量应用糖皮质激素可刺激脂肪分化,抑制成骨分化,降低骨形成速率以及骨密度,导致骨质疏松[10-15]。作为最常见糖皮质激素之一,地塞米松能激活BMSCs表面的糖皮质激素受体,导致BMSCs向脂肪分化,减少其向成骨细胞分化[9-15]。
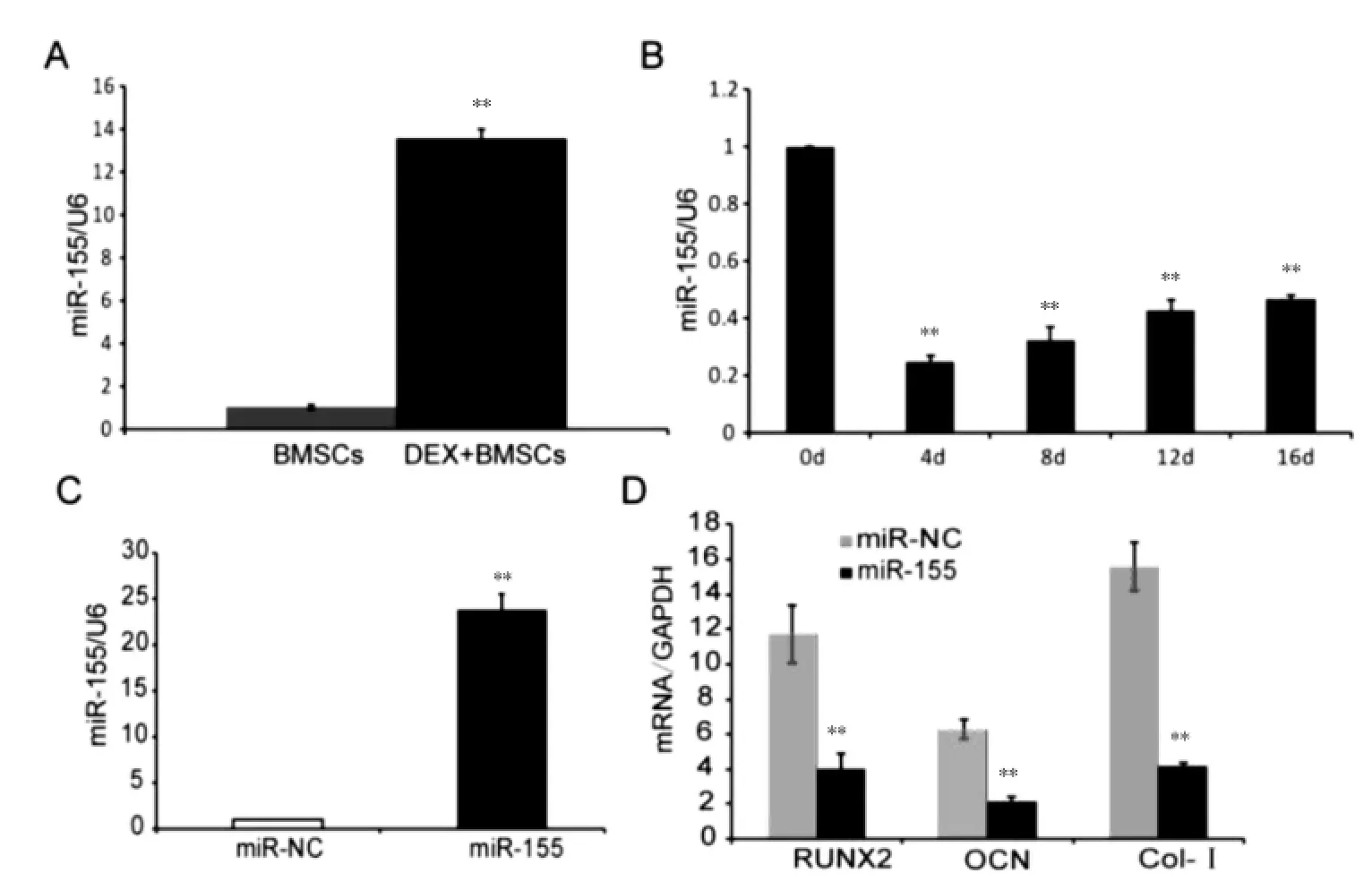
图3 过表达miR-155促进成骨分化
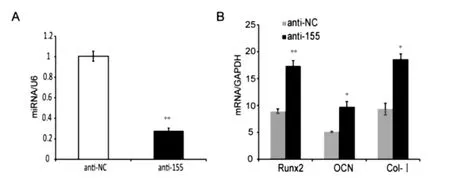
图5 下调miR-155表达促进成骨分化
最近大量的研究发现,miRNAs在调控成骨细胞分化中发挥重要作用[16-18],而地塞米松导致BMSCs中miRNAs的表达明显改变。miRNA芯片分析发现,较高浓度的地塞米松处理后导致BMSCs中包括miR-155在内的9个miRNAs表达明显上调[8]。地塞米松是否通过诱导这些miRNAs表达来发挥其对成骨分化的抑制作用目前还不清楚。与文献报道的结果相一致[8],本研究结果也提示,地塞米松能够明显上调BMSCs中miR-155的表达。进一步研究发现miR-155在调控BMSCs向成骨细胞分化中发挥重要作用,miR-155能够明显抑制BMSCs的成骨分化,表现为成骨相关基因的抑制,ALP染色阳性率和ALP活性的明显下降,细胞外形成的钙化结节数量明显减少。而将BMSCs中内源性miR-155的表达抑制后能够明显促进BMSCs向成骨细胞的分化。提示,地塞米松可能通过上调miR-155及其他一些miRNAs的表达,发挥其抑制成骨分化的作用。
miR-155最早作为癌基因被发现与细胞增殖和炎性反应相关。在EB病毒阳性的B细胞株中,miR-155能够通过靶向一系列BMP信号通路级联分子SMAD1、SMAD5、RUNX2等,抑制BMP2、BMP6和BMP7诱导的ID3表达[18]。在融合性大B细胞淋巴瘤中,miR-155被发现能够直接靶向BMP反应性转录因子Smad5,调控细胞周期阻滞[19]。在MC3T3-E1中抑制miR-155的表达能够部分减轻肿瘤坏死因子-α对BMP-2诱导成骨分化的抑制作用[20]。在BMSCs中miR-155是否通过调控BMP/Smads通路发挥抑制成骨分化的作用还有待进一步研究。
[1]PoppAW,IseneggerJ,LippunerK,etal.Glucocorticosteroidinduced spinalosteoporosis:scientific update on pathophysiology and treatment[J].Eur Spine J,2006,15(7):1035-1049.
[2]RodríguezJP,AstudilloP,PinoAM.Involvementofadipogenic potential of human bone marrow mesenchymal stem cells(MSCs)in osteoporosis[J].Curr Stem Cell Res Ther,2008,3(3):208-218.
[3]Hess R,Pino AM,Ríos S,et al.High affinity leptin receptors arepresentinhumanmesenchymalstemcells(MSCs)derived from control and osteoporotic donors[J].J Cell Biochem,2005,94(1):50-57.
[4]Ivey KN,Srivastava D.MicroRNAs as regulators of differentiation and cell fate decisions[J].Cell Stem Cell,2010,7(1):36-41.
[5]Li Y,Fan L,Hu J,et al.MiR-26aRescues bone regeneration deficiency ofmesenchymalstem cells derived from osteoporotic mice[J].Mol Ther,2015,23(8):1349-1357.
[6]Eskildsen T,Taipaleenmaki H,Kassem M,et al.MicroRNA-138 regulates osteogenic differentiation of human stromal(mesenchymal)stem cells in vivo[J].Proc Natl Acad Sci USA,2011,108(15):6139-6144.
[7]Li J,Zhang N,DaiK,et al.Dexamethasone shifts bone marrow stromal cells from osteoblasts to adipocytes by C/EBPalpha promoter methylation[J].Cell Death Dis,2013,4:e832.
[8]Li T,Li H,Weng X,et al.MicroRNA expression profile of dexamethasone-induced human bone marrow-derived mesenchymal stem cells during osteogenic differentiation[J]. J Cell Biochem,2014,115(10):1683-1691.
[9]Weinstein RS.Glucocorticoid-induced osteoporosis and osteonecrosis[J].Endocrinol Metab Clin North Am,2012,41(3):595-611.
[10]Nuttall ME,Gimble JM.Is there a therapeutic opportunity to either prevent or treat osteopenic disorders by inhibiting marrow adipogenesis[J].Bone,2000,27(2):177-184.
[11]Rodríguez JP,Montecinos L,Martínez J,et al.Mesenchymal stem cells from osteoporotic patients produce a typeⅠcollagen-deficient extracellular matrix favoring adipogenic differentiation[J].J Cell Biochem,2000,79(4):557-565.
[12]Canalis E.Mechanisms of glucocorticoid-induced osteoporosis[J].Curr Opin Rheumatol,2003,15(4):454-457.
[13]Yeh CH,Chang JK,Wang GJ,et al.Ethanol may suppress Wnt/beta-catenin signaling on human bone marrow stroma cells:a preliminary study[J].Clin Orthop Relat Res,2008,466(5):1047-1053.
[14]JiaD,O'BrienCA,WeinsteinRS.Glucocorticoidsactdirectly on osteoclasts to increase their life span and reduce bone density[J].Endocrinology,2006,147(12):5592-5599.
[15]Yamaguchi T,Chattopadhyay N,Brown EM,et al.Extracellular calcium (Ca2+(o)-sensing receptor in a murine bone marrow-derived stromal cell line(ST2):potential mediator of the actions of Ca2+(o)on the function of ST2 cells[J].Endocrinology,1998,139(8):3561-3568.
[16]Li J,Hu C,Han L,Long J,et al.MiR-154-5p regulates osteogenic differentiation of adipose-derived mesenchymal stemcellsundertensilestressthroughtheWnt/PCPpathway by targeting Wnt11[J].Bone,2015,78:130-141.
[17]Qadir AS,Um S,Baek JH,et al.miR-124 negatively regulatesosteogenicdifferentiation and in vivo bone formation of mesenchymal stem cells [J].J Cell Biochem,2015,116(5):730-742.
[18]Yin Q,Wang X,Flemington EK,et al.MicroRNA miR-155 inhibits bone morphogenetic protein(BMP)signaling and BMP-mediated Epstein-Barr virus reactivation[J].J Virol,2010,84(13):6318-6327.
[19]Rai D,Kim SW,Aguiar RC,et al.Targeting of SMAD5 links microRNA-155 to the TGF-beta pathway and lymphomagenesis[J].Proc Natl Acad Sci USA,2010,107(7):3111-3116.
[20]Wu T,Xie M,Huang H,et al.miR-155 modulates TNF-α-inhibited osteogenic differentiation by targeting SOCS1 expression[J].Bone,2012,51(3):498-505.
Regulation effect of miR-155 in the osteogenic differentiation of bone marrow mesenchymal stem cells
YANG Xiaoqing SU Jian▲
Beijing Institute of Medical Device Testing,Beijing 100700,China
Objective To investigate the effect of miR-155 on the osteogenic differentiation of bone marrow mesenchymal stem cells(BMSCs).Methods BMSCs were isolated from C57/BL6J cultured mouse,and were inoculated according to the concentration of 2×105/mL,then BMSCs were transfected by miR-155 mimics and miR-155 inhibitors after the cells sticking wall,at the same time,the same type of contrast were set up.The expression of marker gene in BMSCs, such as RUNX2,OCN and Col-Ⅰwere detected by qRT-PCR after different transfection;the expression of ALP and enzyme activity were determined by ALP staining,and ALP activity assay;extracellular calcium nodule formation was assessed by alizarin red staining.Results miR-155 was up-regulated at(13.56±0.45)folds(P<0.01)in dexamethasone-treated BMSCs,and its expression was significantly elevated at day 4 of osteogenic differentiation in BMSCs(P<0.01).The expression levels of osteogenic-related genes RUNX2,OCN and Col-Ⅰ,ALP activity in miR-155 mimictransfected BMSCs after induction for 12 days were significantly lower than the control of miR-155 mimic(P<0.01),and the number of positive cell after ALP staining and alizarin red staining were significantly less than the control of miR-155 mimic.In contrast,the expression levels of RUNX2,OCN and Col-Ⅰ increased in miR-155 inhibitorstransfected BMSCs after induction for 12 days(P<0.05 or P<0.01);the activity of ALP were significantly higher than the control of miR-155 inhibitors(P<0.01),and the number of positive cell after ALP staining and alizarin red staining were significantly more than the control of miR-155 inhibitors.Conclusion The osteoblastic differentiation of BMSCs can remarkably inhibit by miR-155 mimic transfection and significantly promoted by miR-155 inhibitor transfection.As a novel negative regulator in osteogenic differentiation,miR-155 may be an effective intervention targets for osteoporosis and other osteogenic differentiation disorder-related diseases.
Dexamethasone;Bone marrow mesenchymal stem cells;Osteogenic differentiation;miR-155;Osteoporosis
R68
A
1673-7210(2015)11(c)-0038-05
2015-08-05本文编辑:任 念)
▲通讯作者

