Sulf2促进淋巴管生成的实验研究
朱晨芳 聂 鑫 何 柳 杨 志 顾 岩
Sulf2促进淋巴管生成的实验研究
朱晨芳 聂 鑫 何 柳 杨 志 顾 岩
目的研究硫酸酯酶2(Heparan sulfate 2,Sulf2)在淋巴管生成中的作用。方法根据Sulf2 cDNA序列,设计并构建pCDH-Flag-Sulf2真核表达载体,慢病毒转染293FT细胞,获得合成纯化的rSulf2。通过流式分析、成管试验、裸鼠耳部淋巴管生成模型等实验,研究rSulf2对于淋巴管内皮细胞(Lymphatic endothelial cells,LECs)细胞周期、凋亡、成管能力和淋巴管生成的影响。结果构建的pCDH-Flag-Sulf2真核表达载体,经酶切和测序证明构建完全正确。Western blot检测证明293FT细胞转染pCDH-Flag-Sulf2真核表达载体后,rSulf2表达增高。合成纯化的rSulf2可以减少无血清培养液诱导的LECs细胞的凋亡,增加活细胞的比例,但对细胞周期无显著影响,rSulf2还可以增加淋巴管内皮细胞的体外成管能力及增加裸鼠耳部淋巴管的数量。结论Sulf2可以抑制LECs细胞的凋亡,对淋巴管生成起到促进作用。
硫酸酯酶2淋巴管内皮细胞淋巴管生成
淋巴系统是维持人体内环境稳定,引流身体组织液、体液,发挥免疫功能的主要脉管系统。淋巴管的功能主要依靠LECs细胞的功能来维持。淋巴管生成(L ymphangiogenesis)指在已经存在淋巴管的基础上出现淋巴管的新生。新生淋巴管仅由单层淋巴内皮细胞组成,基底膜不完整、管壁薄、内皮细胞间缺乏紧密连接[1],在炎症及肿瘤过程中,具有重要的组织修复和肿瘤转移作用[2-3]。淋巴管生成是研究淋巴管疾病,如淋巴管畸形、淋巴水肿、淋巴脉管瘤及肿瘤转移的重点。因此,了解调节淋巴管内皮细胞功能的分子机制对研究淋巴管生成具有重要意义。
Sulf2是Sulfs家族成员,Sulfs家族包括Sulf1和Sulf2两个结构类似,功能不完全相同的内源性硫酸酯酶[4]。Sulf2可通过去除细胞外基质中硫酸乙酰肝素蛋白多糖(Heparan sulfate proteoglycan,HSPGs)上N-3-O和6-O上的硫酸氨基葡萄糖硫酸化,来影响HSPGs、配体和受体三元复合物的形成,Sulfs是调节配基-受体后续信号通路活性的关键分子[5-6]。Sulf2可改变具有肝素结合能力的生长因子,如VEGF、b-FGF等的生物学活性[7-8]。Sulf2通过增强其与肝素的结合能力,促进血管内皮细胞的功能。目前研究主要集中在Sulf2与VEGF功能调节和血管生成方面,本研究主要探索Sulf2在淋巴管生成中的作用。
1 材料与方法
1.1 材料
人胚肾细胞293FT为本实验室自存;人真皮淋巴管内皮细胞HDLEC(PromoCell,德国)。HDLEC细胞分组包括①对照组:内皮细胞生长培养基MV2进行细胞培养;②rSulf2组:含有终浓度为50 ng/mL rSulf2的内皮细胞生长培养基MV2进行细胞培养。
胎牛血清(Gibco,美国),高糖DMEM培养基(Hyclone,美国),内皮细胞生长培养基MV2组合(PromoCell,德国),限制性内切酶Nhe I、BamH I和T4连接酶(MBI,美国),脂质体Lipofectamine 2000(Invitrogen,美国),Transwell小室(Corning Costar,美国),matrigel(BD Biosciences,美国),VEGF-D(Pe-Protech,美国),一抗Rabbit-anti-mouse-LYVE-1(Angiobio,美国),二抗Goat-ant-rabbbit-HPR(Abcam,美国),其他试剂为分析纯试剂。
rSulf2合成纯化后,-20℃分装保存。细胞培养时调整其在培养液中的终浓度为50 ng/mL;注射裸鼠时用生理盐水调整rSulf2浓度为1.5 mg/mL。
实验动物为BALB/c-nu裸鼠,雌雄不限,4周龄,体质量14~15 g(中科院上海实验动物中心)。饲养于恒温(25~27℃)、恒湿(45%~50%),符合SPF条件的裸鼠室内。笼具、垫料、饮用水和食料均经灭菌处理,按标准方式给予自由活动与进食。①对照组:3只裸鼠双侧耳根部每天注射0.1 mL生理盐水;②rSulf2组:3只裸鼠双侧耳根部每天注射0.1 mL rSulf2。
pCDH过表达载体(上海肺科医院实验室赠送)是目前最有效的过表达载体之一,通过将外源性基因整合到细胞基因组实现稳定表达(图1)。

图1 pCDH表达载体结构说明Fig.1 pCDH expression vector structure
1.2 方法
1.2.1 Flag-Sulf2融合蛋白真核表达质粒的构建
去除Sulf2基因的信号肽序列,通过三轮PCR反应添加Flag标签和Ig-k链的信号肽序列。Flag-Sulf2上游引物①Flag-Sulf2 F1:5’-GACGATTACAAGGATGACGACGATAAGGGTTCTGGCTTCC;②Flag-Sulf2 F2:5’-TGGGTACTGCTGCTCTGGGTTCCAGGTTCCACTGGT G ACGATTACAAGGATGACGACG-3’;③Flag-Sulf2 F3(Nhe I):5’-CTAGCTAGCATGGAG ACAGACACACTCCTGCTATGGGTACTGCTGCTCTGG -3’。下游引物5’-CGGGATCCTTAACCTTCCCAGCCTTCCC-3’进行PCR反应,获得Flag-Sulf2 CDS区DNA片段;Flag-Sulf2的序列结构:信号肽部分,Flag部分,Flag和Sulf2之间加了GSG三个氨基酸的Linker部分,Sulf2成熟蛋白开始部分,及信号肽的切割位点(表1);PCR产物及pCDH载体用NheI和BamHI进行酶切,电泳后行胶回收,连接PCR产物与pCDH载体。载体连接后转染感受态细菌、挑克隆、扩增、酶切鉴定构建好的质粒命名为pCDH-Flag-Sulf2;构建成功后,将酶切证实正确的质粒送至测序公司(上海美吉公司),经自动基因测序仪测序。
Flag cDNA序列:ATGGAGACAG ACACACTCCT GCTATGGGTA CTGCTGCTCT GGGTTCCAGG TTCCACTGGT GACGATTACA AGGATGACGA CGATAAGGGT TCTGGCttcctgtc gcaccaccgc……(Sulf2全长序列,略)。
1.2.2 Flag-Sulf2慢病毒表达载体的包装
慢病毒在293FT细胞中进行包装,将1×106个处于对数生长期的293FT细胞传代至10 cm2的培养皿中培养,24 h后用脂质体Lipofectamine 2000转染293FT细胞,操作步骤按照说明书进行。慢病毒体系:40 μL的Lipofectamine 2000和250 μL的opti-MEM培养基,孵育5 min;将10 μg的pCDH-Flag-Sulf2,7.5 μg的pSPAX2,3 μg的pMD2.G和250 μL的optiMEM培养液混合培养,再加入Lipofectamine 2000,孵育20 min后,加到293FT细胞中。

表1 Flag-Sulf2的序列结构Table 1 Sequence of Flag-Sulf2
1.2.3 Western blot检测293FT细胞中Sulf2的表达
293FT细胞蛋白质的抽提和定量按照说明书操作步骤进行。每孔配制含50 μg总蛋白样的样品液,煮沸3 min。80 V电泳至染料刚出胶底部。Bio-Rad蛋白转移仪在200 mA恒流条件下,4℃转膜2 h。膜在5%BSA溶液中室温孵育1 h,以封闭膜上的非特异结合,在封闭过的膜上加入一抗,4℃过夜,TBST洗膜3次。加入HRP标记的二抗,室温孵育1 h,TBST洗3次。膜置于化学发光试剂反应液中室温孵育3 min,X光胶片曝光,Bio-Rad凝胶成像仪拍照。
1.2.4 Flag-Sulf2(rSulf2)的收集及纯化
慢病毒载体感染293FT细胞48 h后加入含有1 μg/m L嘌呤霉素和10%FBS的DMEM培养液进行筛选,筛选得稳定表达Flag-Sulf2的293FT细胞(293FT-Flag-Sulf2)。收集含有Flag-Sulf2的细胞培养上清,加入anti-Flag/M2 agarose beads 4℃摇床孵育过夜,加入0.1 mg/mL Flag肽(DYKDDDDK)洗脱,洗脱液用超滤管超滤置换成50 mM HEPES(pH 8.0)溶解。BCA蛋白定量试剂盒测定Flag-Sulf2(rSulf2)的浓度。
1.2.5 细胞周期实验
各组细胞70%融合时,用不含EDTA的0.25%胰酶消化收集,制成单细胞悬液并计数;将每组2×106个单细胞悬液,加入预冷的70%乙醇,-20℃固定过夜;加入20 μg/mL RNase A 500 μL,PBS中37℃孵育30 min;加入500 μL PI染液,混匀后室温避光孵育30 min;再次混匀后过300 μm筛网,用流式细胞仪检测细胞周期状况。分析比较各细胞周期的比例,计算细胞增殖指数(Proliferation index,PI),PI=(S期细胞+G2期细胞)/(G1期细胞+S期细胞+G2期细胞)×100%。
1.2.6 细胞凋亡实验
提前2 d将细胞铺至6孔板,当70%融合时,用无血清培养液处理各组细胞24 h,用不含EDTA的0.25%胰酶消化收集,制成单细胞悬液;1 500 r/min离心5 min,收集1~5×105细胞,加入100 μL 1× Annexin V结合缓冲液重悬,加1 μL Annexin V室温避光染色15 min,加入1 μL PI,1 min后流式细胞仪检测。
1.2.7 成管实验
Matrigel 4℃融化,用培养基1∶1稀释。24孔板每孔中加入100 μL Matrigel,放入培养箱中30 min使胶凝固。在胶凝固的过程中,开始准备淋巴管内皮细胞悬液,细胞消化后调整浓度到5×105cells/mL,每孔加入1 mL细胞悬液,24 h后100倍光镜下拍照。
1.2.8 裸鼠耳部淋巴管生成模型的建立
每天上午10点于裸鼠耳根部背侧皮下分别注射生理盐水或rSulf2,注射后的裸鼠继续饲养,连续注射6周后处死裸鼠,切取双侧耳朵,4%多聚甲醛固定24 h后,常规石蜡包埋。
1.2.9 免疫组化
石蜡切片行脱蜡,抗原修复。加入标记淋巴管内皮细胞的一抗LYVE-1(1∶100),二抗HPR(1∶5 000)。DAB显色及复染细胞核,脱水封片。
1.3 统计方法
采用SPSS16.0软件进行统计分析,结果以x±s表示,均数比较采用非配对t检验或者方差分析。当P<0.05为差异具有统计学意义。
2 结果
2.1 重组质粒酶切鉴定结果
将构建成功的pCDH-Flag-Sulf2重组质粒进行酶切后电泳检测,发现原来环状质粒被切开,可切出一条为7 Kb的DNA大片段和2.6 Kb的DNA小片段。结果与设计序列完全相符,所含目的基因序列准确无误,重组质粒构建成功(图2)。
2.2 Sulf2重组质粒的测序鉴定结果
重组质粒经测序公司(上海美吉公司)自动基因测序仪测序,证实重组质粒编码序列插入位置正确,无基因突变,与设计完全一致。
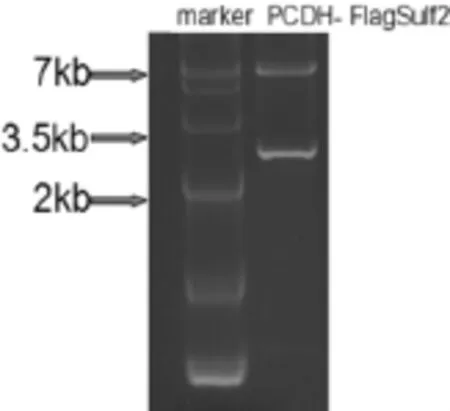
图2 重组质粒酶切后电泳图Fig.2 Electrophoresis chart after the recombinant plasm id was digested

图3 Western blot检测293FT细胞中Sulf2的含量Fig.3 Sulf2 protein expression in 293 cells detected by W estern blot
2.3 Western blot检测293FT细胞中rSulf2的表达
pCDH-Flag-Sulf2真核表达载体转染293FT细胞后,通过Western blot检测细胞中Sulf2的表达量。与对照组相比,293FT细胞中Sulf2蛋白表达显著上升,条带浓聚,其灰度值显著上升(125.61±0.55 vs 24.18±0.21,P<0.01)。提示pCDH-Flag-Sulf2真核表达载体可显著提高Sulf2的表达(图3)。
2.4 细胞周期实验
与对照组相比,rSulf2组G1期细胞减少(73.15±1.20 vs 77.6±0.57,P>0.05),G2/M期细胞增多(17.65±1.76 vs 15.09±0.72,P>0.05),PI增加(27.15±0.53 vs 22.49±0.49,P>0.05),但是差异并无统计学意义,提示rSulf2虽然对淋巴管内皮细胞的细胞周期有促进作用,但是作用效果不明显(图4)。
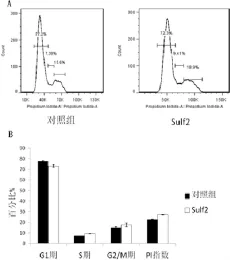
图4 流式细胞仪检测淋巴管内皮细胞的细胞周期Fig.4 The cell cycle of lym phatic endothelial cells detected by flow cytometry
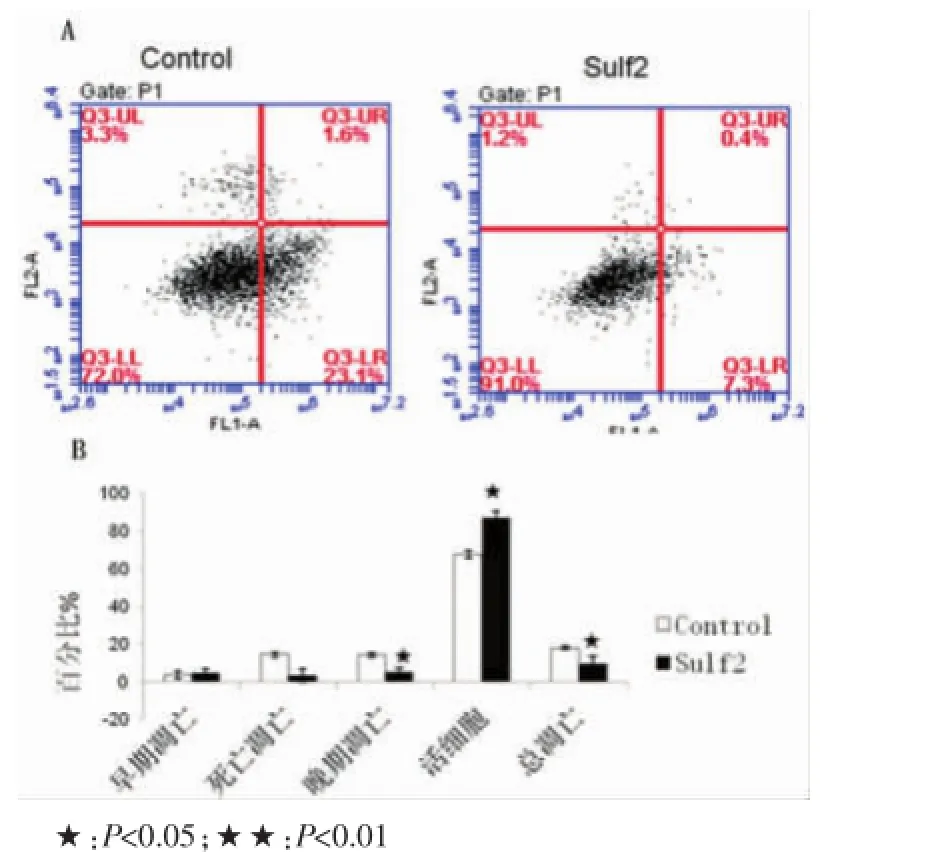
图5 流式细胞仪检测淋巴管内皮细胞的凋亡情况Fig.5 Apoptosis of lymphatic endothelial cells detected by flow cytometry
2.5 细胞凋亡实验
无血清培养液处理细胞24 h,淋巴管内皮细胞中漂浮细胞显著增加。rSulf2组与对照组相比较,早期凋亡无差异(4.80±1.83 vs 3.65±2.05,P>0.05),死亡细胞虽然减少,但无统计学差异(3.27±3.49 vs 14.5±1.27,P>0.05),晚期凋亡细胞显著减少(4.95±2.19 vs 14.3± 1.27,P<0.05),总凋亡率显著降低(9.75±4.03 vs 17.95± 0.78,P<0.05),活细胞数量增多(86.98±3.84 vs 67.60±2.12,P<0.05)。提示rSulf2可以抑制铂类药物引起的淋巴管内皮细胞的凋亡,活细胞增加,rSulf2抑制凋亡主要以抑制晚期凋亡为主(图5)。
2.6 成管试验
rSulf2组与对照组相比,HDLEC细胞的成管数量显著增加,rSulf2组的成管数目与对照组相比,两组淋巴管成管的数量差距比较大(32.41±0.62 vs 23.58±0.58,P<0.05),提示Sulf2可显著促进HDLEC细胞的成管能力(图6)。

图6 LECs成管实验情况Fig.6 M icroscope analysis for the tube-like structure in m atrigel assay

图7 免疫组化染色检测裸鼠耳部淋巴管情况Fig.7 L lym phatic situation in nude m ice ear by imm unohistochem ical staining
2.7 免疫组化染色检测裸鼠耳朵淋巴管
用LVYE-1标记裸鼠耳朵淋巴管内皮细胞行免疫组化染色检测。rSulf2组与对照组相比,裸鼠耳部淋巴管数量显著增加(10±1.00 vs 1.6±0.89,P<0.05),差异具有统计学意义,提示合成纯化的rSulf2对裸鼠耳部淋巴管生成具有显著的促进作用,据此我们认为Sulf2对淋巴管生成起促进作用(图7)。
3 讨论
淋巴管因感染、肿瘤、外伤或手术等原因被破坏后,可导致淋巴回流障碍,从而引起各种不同程度和不同部位的淋巴水肿。淋巴水肿和淋巴管的再生障碍密切相关,是造成淋巴液滞留的主要原因。LECs是构成淋巴管系统最主要的基本组成单位,因此要研究淋巴管新生的机制,就需要研究影响LECs生长和生物学行为的分子生物学机制。这些机制研究对于研究淋巴系统循环障碍,重塑淋巴管系统具有重要的意义。早期研究发现,一些促血管生成因子对淋巴管生成具有促进作用,这些因子包括VEGF[9-10]和b-FGF[11-12]等。研究显示,Sulf2可以改变具有肝素结合能力的生长因子,如VEGF和b-FGF2等的生物学活性,促进它们与肝素的结合能力,推动它们促进血管内皮细胞的功能[8]。但是,目前对于Sulfs的研究主要集中在肿瘤和血管生成方面[13-16]。
Sulfs具有不同的启动子,Sulf2 mRNA的3’UTR序列与Sulf1启动子不同,而且Sulf1和Sulf2在组织的分布不同,可能是其功能不同的主要因素。Sulf1可通过抑制VEGF信号通路来抑制血管生成,但Sulf2对血管生成却起到促进作用。Sulfs具有64%的同源结构区,这些结构主要位于N端,所以Sulfs与生长因子的结合区域是高度统一的[17-18]。“储存假设学说”认为,生长因子配基的储存区主要位于细胞外基质,Sulf2可通过HSPGs与VEGF相结合[6],导致细胞外基质中的生长因子的释放,增加其生物学活性。
本研究通过流式细胞仪检测发现,rSulf2可以促进LECs中G1期细胞减少,G2/M期细胞增多,PI增加,但是经过统计,细胞周期与对照组相比并无显著差异。研究显示,Sulf2虽然对LECs的细胞周期有促进作用,但是作用效果并不显著,可能和其不是直接作用于细胞周期相关基因有关。用无血清培养液处理淋巴管内皮细胞后,死亡漂浮细胞增多,细胞形态皱缩。加入rSulf2后观察发现死亡细胞减少,细胞形态舒展。进一步流式细胞仪检测证实LECs晚期凋亡的细胞数量显著减少,总凋亡率显著降低,活细胞数量增多。这些结果提示,Sulf2可以抑制LECs的凋亡,以抑制晚期凋亡为主。另外,体外成管实验和裸鼠耳部淋巴管生成模型也进一步显示,根据Sulf2 cDNA序列合成的rSulf2能够增加体外淋巴管数量及裸鼠耳部的淋巴管数量,两者均提示合成的Sulf2对淋巴管生成具有显著的促进作用。综上所述,Sulf2对于淋巴管生成起到促进作用,其相关的作用机制及信号通路研究,将在今后的研究中进行。
[1]Acs G,Paragh G,Rakosy Z,et al.The extent of retraction clefts correlates with lymphatic vessel density and VEGF-C expression and predicts nodal metastasis and poor prognosis in early-stage breast carcinoma[J].Mod Pathol,2011,21(10):1-15.
[2]Reis-Filho JS,Schmitt FC.Lymphangiogenesis in tumors:what do we know[J]?Microsc Res Tech,2003,60(2):171-180.
[3]Tammela T,Petrova TV,Alitalo K.Molecular lymphangiogenesis: new p layers[J].Trends Cell Biol,2005,15(8):434-441.
[4]Khurana A,Beleford D,He X,et al.Role of heparan sulfatases in ovarian and breast cancer[J].Am J Cancer Res,2013,3(1):34-45.
[5]Lum DH,Tan J,Rosen SD,et al.Gene trap disruption of the mouse heparan sulfate 6-O-endosulfatase gene,Sulf2[J].Mol Cell Biol,2007,27(2):678-688.
[6]Ratzka A,Kalus I,Moser M,et al.Redundant function of the heparan sulfate 6-O-endosulfatases Sulf1 and Sulf2 during skeletal development[J].Dev Dyn,2008,237(2):339-353.
[7]Morimoto-Tomita M,Uchimura K,Bistrup A,et al.Sulf-2,a proangiogenic heparan sulfate endosulfatase,is upregulated in breast cancer[J].Neoplasia,2005,7(11):1001-1010.
[8]Uchimura K,Morimoto-Tomita M,Bistrup A,et al.HSulf-2,an extracellular endoglucosamine-6-sulfatase,selectively mobilizes heparin-bound growth factors and chemokines:effects on VEGF, FGF-1,and SDF-1[J].BMC Biochem,2006,7:2.
[9]Arai F,Mizuno R,Ohhashi T.Effects of VEGF on Ca2+-transientin cultured lymphatic endothelial cells and mechanical activity of isolated lymph vessels[J].Jpn J Physiol,2000,50(3):343-355.
[10]Karkkainen MJ,Petrova TV.Vascular endothelial growth factor receptors in the regulation of angiogenesis and lymphangiogenesis [J].Oncogene,2000,19(49):5598-5605.
[11]Liu NF,He QL.The regulatory effects of cytokines on lymphatic angiogenesis[J].Lymphology,1997,30(1):3-12.
[12]Tan Y.Basic fibroblast growth factor-mediated lymphangiogenesis of lymphatic endothelial cells isolated from dog thoracic ducts: effects of heparin[J].Jpn J Physiol,1998,48(2):133-141.
[13]Otsuki S,Hanson SR,Miyaki S,et al.Extracellular sulfatases support cartilage homeostasis by regulating BMP and FGF signaling pathways[J].Proc Natl Acad Sci U S A,2010,107(22):10202-10207.
[14]Sharpe R,Pearson A,Herrera-Abreu MT,et al.FGFR signaling promotes the growth of triple-negative and basal-like breast cancer cell lines both in vitro and in vivo[J].Clin Cancer Res,2011,17 (16):5275-5286.
[15]Gill RM,Michael A,Westley L,et al.SULF1/SULF2 splice variants differentially regulate pancreatic tumour growth progression[J]. Exp Cell Res,2014,324(2):157-171.
[16]Lai JP,Sandhu DS,Yu C,et al.Sulfatase 2 up-regulates glypican 3,promotes fibroblast growth factor signaling,and decreases survival in hepatocellular carcinoma[J].Hepatology,2008,47(4): 1211-1222.
[17]Khurana A,Beleford D,He X,et al.Role of heparan sulfatases in ovarian and breast cancer[J].Am J Cancer Res,2013,3(1):34-45.
[18]Hammond E,Khurana A,Shridhar V,et al.The role of heparanase and sulfatases in the modification of heparan sulfate proteoglycans within the tumor microenvironment and opportunities for novel cancer therapeutics[J].Front Oncol,2014,4:195.(收稿日期:2015年4月20日;修回日期:2015年5月30日)
Role of Sulf2 in Promoting Lym phangiogenesis
ZHU Chenfang,NIE Xin,HE Liu,YANG Zhi,GU Yan.Department of
General Surgery,Shanghai Ninth People's Hospital,Shanghai Jiaotong University School of Medicine,Shanghai 200011, China.Corresponding author:GU Yan(E-mail:guyan_8@hotmail.com).
Objective To explore the role of Sulfatase2(Sulf2)in promoting lymphangiogenesis.Methods According to Sulf2 cDNA sequence,pCDH-Flag-Sulf2 eukaryotic expression vector was designed and constructed,then transfected into 293FT cell line to obtain and purify rSulf2.The functions of LECs were examined and compared with control group by flow cytometry,matrigel assay and mice ear lymphangiogenesis model to figure out the effects of rSulf2 on cell cycles,apoptosis, tube formation ability and lymphangiogenesis in LECs.Results The construction of pCDH-Flag-Sulf2 vector was proved correctly by restriction enzyme digestion and sequencing test.Sulf2 expression increased in 293FT cells showed by Western blot.Purified Sulf2 reduced no serum medium induced apoptosis and increased the number of living cells,but it had no effect on cell cycles in LECs.Sulf2 also promoted the tube formation ability in vitro and the number of lymphatic vessels in nude mice ear.Conclusion Sulf2 can inhibit LECs apoptosis and promote lymphangiogenesis.
Heparan sulfate 2;Lymphatic endothelial cells;Lymphangiogenesis
R551.2
A
1673-0364(2015)03-0128-05
10.3969/j.issn.1673-0364.2015.03.003
200011上海市上海交通大学医学院附属第九人民医院普外科。
顾岩(E-mail:guyan_8@hotmail.com)。

