逍遥散对抑郁模型大鼠海马中枢神经递质含量及BDNF和TrkB表达的影响
韩海洋,彭淑芹,徐向东*
(1.山东省中医院,济南250011;2.山东中医药大学药学院,济南250355)
逍遥散对抑郁模型大鼠海马中枢神经递质含量及BDNF和TrkB表达的影响
韩海洋1,彭淑芹2,徐向东1*
(1.山东省中医院,济南250011;2.山东中医药大学药学院,济南250355)
目的 探讨逍遥散对抑郁模型大鼠海马中神经递质(5-HT、NE、DA)的含量及海马脑源性神经营养因子(BDNF)和其受体型酪氨酸蛋白激酶B(TrkB)表达的影响,揭示逍遥散抗抑郁的机制。方法 将SD雄性大鼠50只随机分为正常组,模型组,盐酸氟西汀组(3 mg/kg),逍遥散高、低剂量组(14、7 g/kg)。除正常组外,对其余各组大鼠进行56 d的孤养加慢性应激刺激,第29天起灌胃给药,连续给药28 d,给药结束后解剖大鼠取海马。采用放免法测定大鼠海马中神经递质5-HT、DA、NE的含量变化;采用免疫组化法检测海马中BDNF和TrkB阳性神经元面密度值的变化。结果 与正常组相比,模型组大鼠海马中5-HT、DA、NE的含量显著下降,BDNF和TrkB阳性神经元面密度值显著减小(P<0.01),与模型组相比,逍遥散高、低剂量可以显著增加海马中5-HT、DA、NE的含量,明显提高BDNF和TrkB阳性神经元面密度值(P<0.05或 P<0.01)。结论 逍遥散可明显改善抑郁模型大鼠的抑郁状态,其机制与其可增加相关神经递质的含量,增强BDNF和TrkB表达有关。
逍遥散;神经递质;海马;脑源性神经营养因子;酪氨酸蛋白激酶B
抑郁症是一种情感障碍性精神疾病,主要表现为情感低落、思维迟缓,以及言语动作减少、迟缓等,危害性极大。抑郁症发病率高居各类精神疾病的首位,全世界平均每年有11.3%的成年人患上抑郁症。据WHO和美国哈佛大学公共卫生学院预测:到2020年,抑郁症将成为导致人类死亡和残疾的第二大疾病[1]。抑郁症属中医“郁证”范畴。中医认为抑郁症与机体情志不畅,气机紊乱,肝、心、脾3个脏器的功能失调等有关[2]。逍遥散具有疏肝解郁的功效,是中医临床上调治情志活动的经典名方。本实验利用孤养加慢性应激的方法制造大鼠肝郁气滞型抑郁模型,通过检测海马和下丘脑中神经递质(5-HT、NE和DA)的含量变化、海马脑源性神经元(BDNF)和受体型酪氨酸蛋白激酶(TrKB)的表达来探讨逍遥散治疗抑郁症的主要作用机制。
1 材料
1.1 动物 SPF级成年Wistar雄性大鼠,共90只,体质量(180±20)g,购于山东鲁抗动物实验中心,合格证号:SCXK鲁20130001。购买后在实验室动物房适应性饲养7 d,室温(24±1)℃。除特别说明外,所有大鼠均为自由饮水和摄食,人工明/暗为12 h/12 h昼夜节律(光照时间为9:00—21:00)。
1.2 仪器 0507008型电子称,TC-512型切片机,
DT5-3型低速自动平衡离心机,DY89-Ⅱ型电动玻璃匀浆机,101-E型电热鼓风干燥箱,SHA-B水浴恒温振荡器,CM1850型冰冻切片机,RF-540荧光分光光度计。
1.3 药物与试剂
1.3.1 逍遥散 逍遥散由柴胡15 g,当归15 g,白芍15 g,白术15 g,茯苓15 g,生姜15 g,薄荷6 g,炙甘草6 g,烧生姜1块组成。以上药材购于山东省中医院,经孙萍主任药师鉴定,均符合《中华人民共和国药典》(2010版一部)该药材项下相关规定。取逍遥散510 g,加8倍量的水侵泡1 h后煎煮,沸腾后文火煎30 min,过滤;第2次加5倍量的水煎煮,水沸后用文火煎30 min,过滤,合并2次滤液,常压浓缩至浓度为1.0 g/mL。盐酸氟西汀胶囊由礼来苏州制药有限公司生产,生产批号2061A,分包装批号2061AA,进口药品注册证号H20070375,国药准字J20080016。
1.3.2 试剂 MK1250型ChAT原位杂交试剂盒(武汉博士德生物有限公司),BA0881型BDNF抗体(武汉博士德生物有限公司),BA1454型TrkB抗体(SANTA CRVZ biotechnology),BA1054型生物素化羊抗兔G(武汉博士德生物有限公司,Sigma分装),SABC试剂盒(美国VECTOR公司,批号SA0011),KT011型DAB显色剂(武汉博士德生物有限公司),BSA(Sigma公司,批号80034)。
2 方法
2.1 分组 对50只大鼠称重,编号,通过随机数字表采用随机区组方法分组,确保实验前各组大鼠体质量均衡。将50只大鼠共分为5组:正常组,模型组,盐酸氟西汀组,逍遥散低、高剂量组,各10只,孤养。2.2 造模 在造模的56 d里,除正常组外,其他各组分别接受7种不同的刺激,分别是24 h禁食,24 h禁水,4℃冷水游泳,50℃热刺激5 min,夹尾2 min,高速水平震荡40 min,电击足底。第29天起各组灌胃给药,连续给药28 d。
2.3 取材 实验第56天对各组大鼠进行处理,用3%戊巴比妥钠溶液将大鼠完全麻醉后固定在手术板上开胸暴露心脏,用眼科剪剪开右心耳,将透皮针头经心眼插入左心室,快速用生理盐水灌流冲洗,再用含4%多聚甲醛的磷酸盐缓冲固定液(PB,pH 7.4)灌流固定,取出下丘脑和海马后放入EP管中,再将其放入-80℃冰箱中冷冻保存。
2.4 指标检测
2.4.1 神经递质的检测 将-80℃冰冻的海马组织研碎,匀浆液经漩涡振荡5 min后,在3 000 r/min离心5 min(-4℃),取出上清液2.0 mL分别加正庚烷4.0 mL,0.1 mol/L HCl 2.0 mL,漩涡振荡5 min后,在3 000 r/min下离心5 min。水相部分留作测定5-HT、NE、DA。用荧光分光光度法测定海马组织中5-HT、NE、DA的含量[3-5],测定下丘脑神经递质5-HT、DA和NE含量的方法同上。
2.4.2 BDNF及TrKB阳性神经元面密度值的检测将海马置于4%多聚甲醛中固定48 h,之后转移到20%蔗糖溶液中4℃沉底后再转移到30%蔗糖溶液中,沉底后用恒温冷冻切片机连续冠状切片,片厚约25 μm。采用免疫组织化学法检测。每只大鼠组织随机选取5张切片,严格按照武汉博士德生物工程有限公司提供的试剂盒说明书进行操作。在10×40倍光学显微镜下观察所有标本,在10×10方格参照体积内计数阳性染色细胞截面与方格横线的交点数,各切片海马CA3区和DG区随机计数5个视野,取其平均值,然后依据截点/总线长法,计算各切片海马CA3区和DG区阳性染色神经元面密度值[6]。
3 结果
3.1 大鼠海马中5-HT、NE、DA的含量变化 见表1。
表1 各组大鼠海马神经递质5-HT、NE、DA含量变化(±s,n=10) ng/g
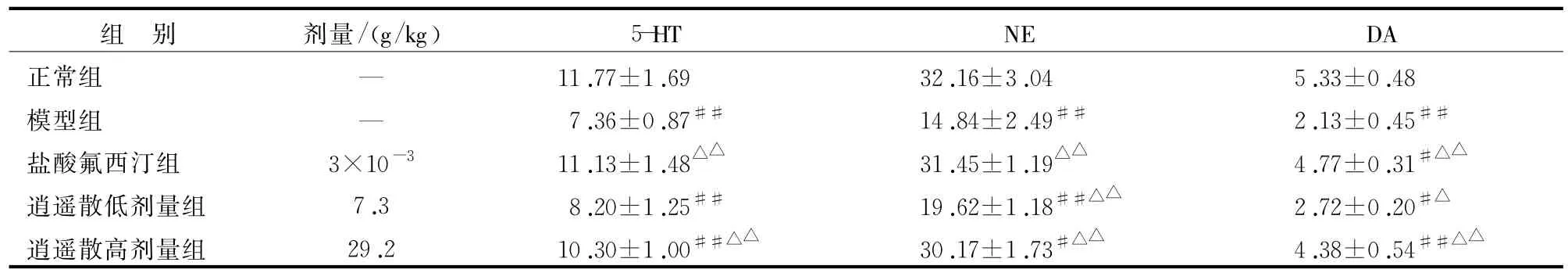
表1 各组大鼠海马神经递质5-HT、NE、DA含量变化(±s,n=10) ng/g
注:与正常组比较 ,#P<0.05,##P<0.01;与模型组比较 ,△P<0.05,△△P<0.01
DA正常组 — 11.77±1.69 32.16±3.04 5.33±0.48模型组 — 7.36±0.87## 14.84±2.49## 2.13±0.45##盐酸氟西汀组 3×10-3 11.13±1.48△△ 31.45±1.19△△ 4.77±0.31#△△逍遥散低剂量组 7.3 8.20±1.25## 19.62±1.18##△△ 2.72±0.20#△逍遥散高剂量组 29.2 10.30±1.00##△△ 30.17±1.73#△△ 4.38±0.54组 别 剂量/(g/kg) 5-HT NE##△△
3.2 大鼠下丘脑中5-HT、NE、DA的含量变化 见表2。
表2 各组大鼠下丘脑神经递质5-HT、NE、DA含量变化(±s,n=10) ng/g

表2 各组大鼠下丘脑神经递质5-HT、NE、DA含量变化(±s,n=10) ng/g
注:与正常组比较 ,#P<0.05,##P<0.01;与模型组比较 ,△P<0.05,△△P<0.01
DA正常组 — 38.19±1.40 52.53±3.01 7.72±0.35模型组 — 15.94±1.26## 29.00±3.01## 4.95±0.65##盐酸氟西汀组 3×10-3 34.32±3.07##△△ 50.48±5.60△△ 7.09±0.57#△△逍遥散低剂量组 7.3 19.21±2.61##△△ 33.18±2.73##△ 5.57±0.69##△逍遥散高剂量组 29.2 33.06±1.61##△△ 47.13±3.04##△△ 6.71±0.73组 别 剂量/(g/kg) 5-HT NE##△△
3.3 大鼠海马BDNF、TrkB阳性神经元面密度值的变化 见表3。
表3 各组大鼠海马BDNF、TrkB阳性神经元面密度值的变化(±s,n=10)

表3 各组大鼠海马BDNF、TrkB阳性神经元面密度值的变化(±s,n=10)
注:与正常组比较 ,#P<0.05,##P<0.01;与模型组比较 ,△P<0.05,△△P<0.01
组 别 剂量/(g/kg)BDNF 神经元面密度值CA3区 DG区神经元面密度值CA3区 DG区TrkB正常组 — 0.61±0.08 0.46±0.04 0.57±0.05 0.49±0.09模型组 — 0.19±0.05## 0.21±0.06## 0.20±0.09## 0.19±0.03##盐酸氟西汀组 3×10-3 0.54±0.12△△ 0.41±0.08△△ 0.55±0.07△△ 0.44±0.07#△△逍遥散低剂量组 7.3 0.30±0.11##△ 0.20±0.07## 0.34±0.04##△△ 0.29±0.06##△△逍遥散高剂量组 29.2 0.57±0.13△△ 0.38±0.05#△△ 0.54±0.09△△ 0.43±0.06#△△
4 讨论
BDNF属于神经营养素家族中重要的一员,对发育过程中神经元的存活、分化、生长以及成年神经细胞的存活和功能起到重要作用。近年来研究[7-11]表明,神经营养因子尤其是BDNF在抑郁症发病和治疗中起了重要作用,其作用主要体现在对各种神经元尤其是5-HT和DA能神经元的发育分化与生长再生具有维持和促进作用,如果神经营养不足可引起脑区功能受损,因此抗抑郁治疗可以上调BDNF并翻转这种损害。有研究[12-13]表明:BDNF的下调可增加海马神经元对伤害性应激的敏感性,间接引起神经毒性,从而导致海马神经元萎缩甚至死亡。动物实验[14]证实,外源性BDNF对5-HT能等神经元具有营养再生作用 ,而且具有抗抑郁的作用。另有研究[15]显示:神经营养因子可能与DA、胆碱脂能、5-羟色胺能、肾上腺素能神经元的可塑性有密切关系,并可能参与多种神经递质的传递。研究[16]发现,酪氨酸蛋白激酶B(TrKB)是BDNF高亲和力受体,TrKB在神经元的生存、分化和生长、维持神经元功能和再生修复等多方面发挥重要作用。只有当BDNF与TrKB结合后才可以启动细胞内信号转导途径,从而产生相应的分子保护神经元并促进再生作用[17]。BDNF可通过靶源性,自分泌和旁分泌方式与神经细胞上高亲和力的酪氨酸蛋白激酶B(TrKB)受体结合,激发各种信号传导通路而发挥其特殊的生物作用[18]。实验结果表明,模型组大鼠海马中TrKB表达明显较少,盐酸氟西汀组和逍遥散高剂量组可见大量阳性神经元颗粒,逍遥散低剂量组中阳性神经元颗粒较少。由此说明,逍遥散能通过提高大鼠海马BDNF及TrKB的表达而达到改善大鼠抑郁症状;同盐酸氟西汀一样具有明显的抗抑郁作用。
逍遥散由柴胡、芍药、白术、当归、茯苓、甘草、烧生姜和薄荷组成。现代研究证明,柴胡的主要成分是柴胡皂苷,具有镇静、抗惊厥、止痛的作用,柴胡醇提物也能提高中枢神经兴奋性;芍药总皂苷具有抗炎、镇痛、镇静的作用,能显著改善不同功能状态下的大鼠睡眠;芍药苷对海马神经元的存活和生长有促进作用;白术对植物神经系统有双向调节作用,白术多糖能提高小鼠学习记忆和抗氧化作用;茯苓和甘草具有镇静作用,生姜精油可以显著抑制小鼠自发活动,具有显著的抗惊厥和镇痛作用,薄荷油也能兴奋中枢神经。这些均能显示逍遥散中各药对中枢神经系统有不同的调节作用,说明逍遥散对中枢神经系统具有多靶点、多环节的双向调节作用。
本实验表明逍遥散能够促进神经递质5-HT、NE和DA的分泌,上调海马BDNF、TrKB的表达水平,这可能是其抗抑郁作用的机制。
[1]杨廷燕,李彦章,行燕玲,等.行为激活疗法治疗抑郁症的研究进展[J].中华行为医学与脑科学杂志,2012,21(11):1049-1050.
[2]吴丽丽,徐志伟,严灿,等.逍遥散和丹栀逍遥散抗抑郁作用的实验研究[J].中医研究,2003,16(3):14-15.
[3]何美霞,可君,李志刚.脑组织中单胺类神经递质含量测定[J].河南医科大学学报,1996,31(1):113-114.
[4]邓颖,张春虎,张海男,等.柴胡疏肝散及其拆方对抑郁模型大鼠行为及海马、杏仁核、额叶BDNF及其受体TrkB的影响[J].中国中西医结合杂志,2011,34(10):1373-1378.
[5]吕佩源 ,宋春风,樊敬峰,等.石杉碱甲对血管性痴呆小鼠学习记忆及海马胆碱乙酰转移酶的影响[J].中国行为医学科学 ,2005,14(12):1068-1070.
[6]COWEN P J.Not fade away:the HPA axis and depression[J].Psychological Medicine,2010,40(1):1-4.
[7]WILLNER P.Animal models as simulations of depression[J].Trends in Pharmacological Sciences,1991(12):131-136.
[8]王业民 ,孔令东,黄志起.半夏厚朴汤抗抑郁活性部位的筛选[J].中国中药杂志,2002,27(12):932-936.
[9]CHERNOLOZ O,EL MANSARI M,BLIER P.Electrophysiological studies in the rat brain on the basis for aripiprazole augmentation of antidepressants in major depressive disorder[J].Psychopharmacology,2009,206(2):335-344.
[10]李娜,刘群,李晓娟,等.中药与糖尿病合并抑郁症及BDNF信号通路的关系[J].吉林中医药,2014,34(9):865-868.
[11]MANJI H K,DREVETS W C,CHARNEY D S.The cellular neurobiology of depression[J].Nature Medicine,2001,7(5):541-547.
[12]张艳美,杨权,许崇涛 ,等.慢性应激对大鼠海马锥体细胞形态结构的效应[J].生物化学与生物物理进展,2002,29(5):719-723.
[13]胡随瑜,张春虎,曹美群 ,等 .白松片对大鼠慢性应激抑郁模型的抗抑郁实验研究[J].中南大学学报(医学版),2006,31(5):676-681.
[14]MAMOUNAS L A,BLUE M E,SIUCIAK J A,et al.Brain-derived neurotrophic factor promotes the survival and sprouting of serotonergic axons in rat brain[J].The Journal of Neuroscience:the Official Journal of the Society for Neuroscience,1995,15(12):7929-7939.
[15]SKUP M,DWORNIK A,MACIAS M,et al.Long-term locomotor training up-regulates TrkB(FL)receptor-like proteins,brain-derived neurotrophic factor,and neurotrophin 4 with different topographies of expression in oligodendroglia and neurons in the spinal cord[J].Exp Neurol,2002,176(2):289-292.
[16]YAN Q,ROSENFELD R D,MATHESON C R,et al.Expression of brain-derived neurotrophic factor protein in the adult rat central nervous system[J].Neuroscience,1997,78(2):431-448.
[17]SUGIMOTO T,KURODA H,HORII Y,et al.Signal transduction pathways through TRK-A and TRK-B receptors in human neuroblastoma cells[J].Japanese Journal of Cancer Research:Gann,2001,92(2):152-160.
[18]刘佩,刘喆.脑源性神经营养因子在海马学习记忆中的作用[J].长春中医药大学学报,2009,25(2):195-197.
Xiaoyaosan on content of nurotransmitter of depression model SD rats'hippocampus and on brain-derived neurotrophic factor and expression of receptor TrkB of its Hippocampus
HAN Haiyang1,PENG Shuqin2,XU Xiangdong1*
(1.Shandong Provincial Traditional Chinese Medicine Hospital,Jinan 250011,China;2.Shangdong University of Traditional Chinese Medicine,Jinan 250355,China)
Objective To study the effect of Xiaoyaosan on the cotent of nurotransmitter of depression model SD Rats hippocampus,and on brain-derived neurotrophic factor and the expression of receptor TrkB of its hippocampus,to reveal the mechanism of antidepressant of Xiaoyaosan.Methods We equally assign 50 male rats into a normal,a model,a Fluoxetine(3 mg・kg),and a high or low of Xiaoyaosan group(14.7 g・kg).Except the normal group,we conducted 56-day separation and chronic stress stimulation on the remaining rats.From the twenty-ninth day,we will dose the rats by ig,continuous administration for 28 days.After the end of dosing,anatomize the rats to get their hippocampus.Determinate the changes of 5-HT,DA,NE contenting in neurotransmitter of the rats hippocampus by radioimmune assay.Test the changes of BDNF and TrkB's Positive neurons surface density values by immunohistochemistry.Results Compared with the normal group,the content of 5-HT,DA,NE in hippocampus of model group rats decreased significantly,and so do BDNF and TrkB positive
Xiaoyaosan;neurotransmitter;hippocampi;BDNF;TrkB
R285.5
A
2095-6258(2015)05-0893-04
10.13463/j.cnki.cczyy.2015.05.005
2015-03-11)
山东省2011-2012年度中医药科技发展计划项目(2011-75)。
韩海洋(1971-),男,大学本科,主管药师,主要从事中药新药开发及中药炮制原理的研究。
*通信作者:徐向东,男,硕士,副主任药师,电话-13793188391,电子信箱-zhengsanxiasd@126.com
neurons surface density values(P<0.01).Compared with the model group,high or low dosage of Xiaoyaosan can be significantly increased the content of 5-HT,DA,NE in the hippocampus and BDNF and TrkB positive neurons surface density values(P<0.05 or P<0.01).Conclusion Xiaoyaosan can significantly improve the depressive state of depression model rats.Its mechanism is associated with the increasing content of related neurotransmitters and the enhancing BDNF and TrkB expression.

