云南半细毛羊毛囊干细胞凋亡研究
吕春荣,权国波,吴国权,洪琼花
(云南省畜牧兽医科学院,昆明 650224)
云南半细毛羊毛囊干细胞凋亡研究
吕春荣,权国波,吴国权,洪琼花
(云南省畜牧兽医科学院,昆明 650224)
采用2种不同方法检测云南半细毛羊毛囊干细胞(hair follicle stem cells,HFSCs)凋亡情况,为后续的诱导分化研究奠定基础。利用凯基TUNEL-细胞凋亡原位检测试剂盒和AnnexinV-EGFP/PI标记结合流式细胞仪检测HFSCs凋亡。结果:凯基TUNEL-细胞凋亡原位检测试剂盒检测表明,第2代细胞凋亡率6.0%,第6代细胞凋亡率6.5%;AnnexinV-EGFP/PI标记结合流式细胞仪检测表明,第2代细胞凋亡率0.24%,第6代细胞凋亡率0.80%。说明云南半细毛羊HFSCs细胞生长状态很好。随着传代次数的增加,细胞凋亡率有所上升。
云南半细毛羊;HFSCs;细胞凋亡
细胞凋亡(apoptosis)是指为维持内环境稳定,由基因控制的细胞自主、有序的死亡,即细胞程序性死亡[1]。它与细胞坏死不同,细胞凋亡不是一件被动的过程,而是主动过程,它涉及一系列基因的激活、表达以及调控等的作用,它并不是病理条件下自体损伤的一种现象,而是为更好地适应生存环境而主动争取的一种死亡过程。细胞凋亡和细胞增殖都是生命的基本现象,是维持体内细胞数量动态平衡的基本措施。细胞凋亡贯穿于机体的整个生命周期,完成新旧细胞的生死交替,它对机体的发育存活及维持正常生理功能都有着重要意义。另外,细胞凋亡还参与某些疾病的发生、清除损伤、转化细胞、防止癌变等过程。因此,研究细胞凋亡及其机理具有重要的理论及实践意义。
使用碘化丙啶(PI)染色检测DNA含量是最早出现的凋亡定量检测方法[2]。进入90年代,检测DNA断裂点的TUNEL(terminal deoxylnucleotidyl transferase mediated-dUTP nick end labeling)技术成为凋亡定量检测的主流。1995年Vermes首次使用荧光素标记的膜联蛋白V(FITC-Annexin V)联合PI染色双参数技术定量检测细胞凋亡[3]。
1 材料与方法
1.1 细胞
来自于云南省畜牧兽医科学院草食家畜研究所2012年冷冻保存的云南半细毛羊HFSCs 8支。
1.2 方法
1.2.1 凯基TUNEL-细胞凋亡原位检测试剂盒操作步骤
1.2.1.1 细胞样本的准备 A.自然晾干的细胞样本(细胞涂片或爬片),4%的多聚甲醛室温固定30 min,PBS缓冲液(pH值7.2~7.4)清洗3次,每次5 min。B.在封闭液中室温封闭10 min,PBS缓冲液(pH值7.2~7.4)清洗3次,每次5 min。C.在通透液中,冰上(2~8℃)促渗2 min。
1.2.1.2 阳性对照及阴性对照的准备 A.阳性对照样本的准备:细胞样本在TritonX-100通透液处理、PBS清洗后,再加入100 μL DNaseI反应液,室温37℃处理10~30 min,其余步骤均相同。B.阴性对照样本的准备:在标记反应制备TdT酶反应液时,不添加TdT酶,其余步骤均相同。
1.2.1.3 标记和显色反应 A.预处理好的样本PBS漂洗2次,样本周围用吸水纸吸干。B.每个样本滴加50 mL TdT酶反应液,加盖玻片37℃避光湿润反应60 min,PBS缓冲液(pH值7.2~7.4)清洗3次,每次5 min,样本周围用吸水纸吸干。C.滴加50 mLStreptavidin-HRP工作液,加盖玻片37℃避光湿润反应60 min,PBS缓冲液(pH值7.2~7.4)清洗3次,每次5 min。D.滴加50~100 μLDAB工作液,室温显色反应10 min,PBS缓冲液(pH值7.2~7.4)清洗3次,每次5 min。
1.2.1.4 苏木素复染 苏木素复染后,漂洗脱水、观察。
1.2.2 AnnexinV-EGFP/PI标记结合流式细胞仪检测HFSCs凋亡操作步骤 A.将单细胞悬液加入2 mL圆底离心管中离心,1 500 r/min,5 min,弃上清液。B.加入PBS1 mL离心洗涤2次,弃上清。C.加入500 μL的Binding Buffer悬浮细胞。D.加入5 μL AnnexinV-FITC混匀后,加入5 μLPropidium Iodide,阳性对照组分别加入FITC和PI。E.室温避光孵育5~310 min。F.在1 h内进行流式细胞术定量检测。
2 结果与分析
2.1 凯基TUNEL-细胞凋亡原位检测试剂盒检测结果
在显微镜下,随机观察统计3个视野,每个视野100~200个细胞,计算细胞凋亡率:

细胞凋亡检测结果(如图1所示),图1B中白色箭头所示为凋亡细胞,细胞核呈棕褐色的Tunel阳性细胞;通过与细胞凋亡的阳性对照与阴性对照比较可得出:云南半细毛羊毛囊干细胞凋亡的细胞很少,通过计算,第2代细胞凋亡率6.0%,第6代细胞凋亡率6.5%。
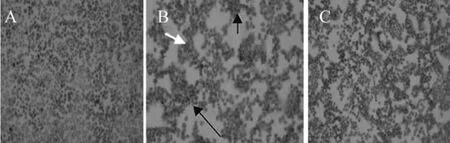
图1 第6代HFSCs凋亡检测(100×)(白色箭头示阳性细胞,黑色箭头示阴性细胞)
2.2 AnnexinV-EGFP/PI标记结合流式细胞仪检测HFSCs凋亡检测结果
分别收集第2代、第6代云南半细毛羊HFSCs,用AnnexinV-EGFP/PI标记结合流式细胞仪检测HFSCs凋亡结果,进行凋亡分析。第2代细胞凋亡率0.24%,第6代细胞凋亡率0.80%,说明随着培养代次的增加,细胞凋亡率有所上升。见图2。结果判定:I象限(EGFP-/PI-)为正常细胞;II象限(EGFP-/PI+)为细胞处理过程中机械性损伤造成坏死的细胞;III象限(EGFP+/PI+)为晚期凋亡细胞及部分坏死细胞;IV象限(EGFP+/PI-)为早期凋亡细胞。

图2 HFSCs流式分析
3 讨论
3.1 细胞培养对细胞凋亡检测的影响
细胞生长汇合至瓶底80%~90%时需进行传代培养。把握传代的时机与再培养的密度对于大多数生命力较为脆弱的体外培养细胞至关重要。传代过早,细胞接种密度低,相互间在形态和机能上的依存关系减弱,使细胞不易培养;传代过晚,由于培养液中营养消耗过尽、代谢产物积累、pH值降低而引起细胞中毒;以及细胞间接触抑制和细胞形态改变等,严重时细胞汇合成片从培养底壁脱落死亡。云南半细毛羊HFSCs在培养箱(37℃,5%CO2,饱和湿度)中培养。当细胞长至80%时,将培养液弃去,PBS清洗3次,加入0.125%胰酶(含0.01%EDTA)在37℃消化5~8 min后,倒置显微镜下观察细胞开始变圆时,加细胞培养液终止消化,反复吹打细胞使其完全脱落,以1∶2的比例进行传代。通过凯基TUNEL-细胞凋亡原位检测试剂盒检测结果表明,云南半细毛羊毛囊干细胞凋亡的细胞很少,通过计算,第2代细胞凋亡率6.0%;第6代细胞凋亡率6.5%。AnnexinV-EGFP/PI标记结合流式细胞仪检测结果表明,第2代细胞凋亡率0.24%,第6代细胞凋亡率0.80%。通过2种不同凋亡检测方法研究发现:随着传代次数的增加,细胞凋亡率均有所上升。
3.2 不同方法对细胞凋亡的影响
目前国内外最为常用的凋亡定量检测方法是检测DNA断裂点的TUNEL法。在TDT作用下将FITC-dUTP掺入DNA裂点的3′-OH端上,根据其掺入量的多少计算凋亡细胞百分比。由于DNA断裂发生在凋亡早期,因此该法可检出早期凋亡细胞,具有较高灵敏性。但该法最大缺点是坏死细胞亦呈现TUNEL反应阳性,使其特异性降低[4]。本研究也证实了这点,凯基TUNEL-细胞凋亡原位检测试剂盒检测云南半细毛羊HFSCs凋亡,通过计算,第2代细胞凋亡率6.0%,第6代细胞凋亡率6.5%。明显高于AnnexinV-EGFP/PI标记结合流式细胞仪检测结果。
凋亡定量检测常需借助流式细胞检查。流式细胞术(flowcytometry)以其方便、快速、灵敏、准确的优点,被广泛应用于细胞凋亡的检测[5]。最早出现且较为常用的流式细胞凋亡定量检测技术是PI染色法。但该法操作麻烦,并存有高漏检率等,现在很少有人使用。1992年Fadok等[6]报道在细胞凋亡早期位于细胞膜内侧的磷酯酰丝氨酸(PS)迁移至细胞外侧。由于坏死细胞PS亦暴露于外表使Annexin V结合阳性,因此必须同时采用PI这一坏死细胞染色阳性的DNA染料将坏死细胞区分出来。1995年Vermes等[3]首次使用荧光素标记的膜联蛋白V(FITC-Annexin V)联合PI染色双参数技术定量检测凋亡。与PI法检测凋亡不同的是该法不需要固定细胞,因此凋亡细胞PI低染。国内学者郑俊年等[7]使用PI染色、Annexin V PI、TUNEL 3种方法凋亡检出率分别为27.19%、32.28%、50.17%,两两之间均有显著差异(P<0.01)。本研究中凯基TUNEL-细胞凋亡原位检测试剂盒检测云南半细毛羊HFSCs凋亡,通过计算,第2代细胞凋亡率6.0%,第6代细胞凋亡率6.5%。明显高于AnnexinV-EGFP/PI标记结合流式细胞仪检测结果(第2代细胞凋亡率0.24%,第6代细胞凋亡率0.80%)。
除以上方法外,还有不常用的方法。4,6-联脒-2苯基吲哚(4,6-diamidino-2-phenyiindole,DAPI)是DNA特异性的荧光染料,与DNA结合是非嵌入式的,主要结合在DNA的A-T碱基区,使用时无需用RNaseA处理细胞,但由于配置紫外激光源的流式细胞仪非常昂贵,大多数实验室都没有配备。因此,以DAPI标记DNA分析细胞周期的方法尚未成为常规检测方法被普遍采纳,也没有简单的标准实验流程可供参考[8]。
近年来有关凋亡信号转导、基因调控等方面的研究已取得重大进展,但作为所有研究基础的凋亡定量检测技术却进展不大。选用何种凋亡检测技术已成为研究的关键。
[1] Majno,Joris G J.Apoptosis,oncosis and necrosis,An overview of cell death[J].AmJ Pathol,1995,146:3-16.
[2] Nicoletti I,Migliorati G,Pagliacci M C.A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry[J].J Immunol Methods,1991,139:271.
[3] Vermes I,Haanen C,Steffens-Nakken H,et al.A novel assay for apoptosis.Flow cytometry detection of phosphatidylserine expression on early apoptosis cells using fluorescein labeled Annexin V[J].J Im munol Methods,1995;184:39.
[4] Gorczyca W,Gong J P,Darzynkiewicz Z.Detection of DNA strand breaks in individual apoptotic cells by the in situ terminal deoxymucleotidyl transferase and nick translation assay[J].Cancer Res,1993,53:19-45.
[5] Lacombe F,Belloc F.Flowcytometrystudyofcell cycle,apoptosis and drugresistance in acute leukemia[J].Hematol Cell Ther,1996,38(6):495.
[6] FadokV A,Voelker D R,Campbell P A,et al.Exposure of phosphatidylserine on the surface of apoptotic lymphocytes triggers specific recognition and removal by macrophage[J].J Immuol,1992,148:2207.
[7] 郑骏年,谢叔良,陈家存,等.流式细胞术定量检测细胞凋亡3种方法的比较研究[J].免疫学技术与方法,1999,10(15):467-469.
[8] 刘锡娟,丁慧荣,张宏.用DAPI和Hoechst33342染色法检测DNA的流式细胞方法探讨[J].北京大学学报:医学版,2010,42(4):480-484.
Study on Apoptosis of Hair Follicle Stem Cells in Yunnan Semi-fine Wool Sheep
LvChunrong,Quan Guobo,HongQionghua,et al
(Yunnan Institute ofAnimal Science and Veterinary,Kunming 650224,China)
The apoptosis ofhair follicle stem cells(HFSCs)in Yunnan semi-fine wool sheep were detected by two different methods in order tocarryout the subsequent research about induction and differentiation ofHFSCs.The TUNEL-Cell Apoptosis in situ Detection Kit was used todetect apoptosis ofHFSCs.The combination of the AnnexinV-EGFP/PI staining and flowcytometry was used toobserve earlyapotosis occurringin HFSCs.The results fromthe TUNEL-Cell Apoptosis in situ Detection Kit indicated that the frequency of the apoptotic cells in the second generation was 6.0%.The frequency of the apoptotic cells in the sixthgeneration was 6.5%.The data from AnnexinV-EGFP/PI staining showed that the apoptotic rate of the HFSCs in the second gerenation was 0.24%;the apoptotic rate of the HFSCs in the sixth generation was 0.80%.It was concluded that the growth state of HFSCs in Yunnan semi-fine wool sheep was excellent.However,the frequency of apoptotic cells in HFSCs showed a steady increase with prolongingofthe passage numbers.
Yunnan semi-fine wool sheep;hair follicle stemcell;apoptosis
S826
A
2095-3887(2015)06-0006-03
10.3969/j.issn.2095-3887.2015.06.002
2015-10-17
国家现代农业产业技术体系建设(CARS-40);云南省应用基础研究青年项目(2012FD083)
吕春荣(1982-),女,助理研究员,硕士。
洪琼花(1968-),女,白族,研究员,硕士,主要从事绵羊、山羊的育种和高效繁殖新技术研究。

