绵羊BMPR1B基因生物信息学分析
潘章源,狄 冉,刘秋月,胡文萍,王翔宇,郭晓飞,储明星
(中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京100193)
遗传育种
绵羊BMPR1B基因生物信息学分析
潘章源,狄 冉,刘秋月,胡文萍,王翔宇,郭晓飞,储明星
(中国农业科学院北京畜牧兽医研究所,农业部畜禽遗传资源与种质创新重点实验室,北京100193)
该研究从生物信息学角度分析BMPR1B基因结构、蛋白结构、理化性质、同源进化和信号通路。结果显示:绵羊BMPR1B DNA全长20 k,包含12个外显子,其中FecB突变位于第8外显子;BMPR1B具有3个保守motif和3个功能结构域,FecB突变位于蛋白激酶功能结构域,该突变改变了蛋白空间结构;绵羊BMPR1B蛋白与山羊的同源性最高,首先相聚,其次为牛、狼、人、猕猴、小鼠、猪、原鸡、斑马鱼;BMPR1B主要在TGFB通路中起信号转导作用,是一个重要的膜受体。
绵羊;BMPR1B基因;生物信息学;FecB突变;蛋白互作
绵羊繁殖力是畜牧生产中最重要的经济性状之一,其受到多个繁殖相关基因的调控,随着对这些基因研究的不断深入,信息量越来越大,对其信息进行总结和分析显得尤为必要。同时随着生物信息技术的发展,一些数据库越来越完善,分析软件越来越精确,生物信息学也日益完善。此时通过生物信息学分析,一方面可以总结验证基因的已知信息,另一方面还能挖掘该基因更为深入的未知信息,从而全面地认识该基因在机体中所起的作用。因此,对一些功能基因进行生物信息学分析具有重要的意义。
骨形态发生蛋白受体1B(bone morphogenetic protein receptor 1B,BMPR1B)是一个受体蛋白,主要参与调控成骨分化、细胞扩散和卵泡发育。绵羊BMPR1B基因位于第6号染色体,mRNA序列全长3 255 bp;BMPR1B基因存在一个FecB(fecundityBooroola)(A746G)突变,导致第249位氨基酸由谷氨酰胺(Q)变成了精氨酸(R)[1-3],该突变对绵羊排卵数具有加性效应,即每增加一个拷贝将额外多排卵1.65枚[4],因此BMPR1B基因成为目前已知的并应用于生产的绵羊高繁殖力标记基因之一。目前研究表明,FecB突变存在于世界各地各种高繁殖力绵羊品种中,主要包括Booroola Merino绵羊(澳大利亚)[1]、Bonpala绵羊(印度)[5]、Kalehkoohi绵羊(伊朗)[6]、小尾寒羊(中国)[7]、湖羊(中国)[8]、多浪羊(中国)[9]、策勒黑羊(中国)[10]和洼地绵羊(中国)[11]。FecB突变分布的广泛性为提高绵羊产羔数提供了广阔的前景,对通过分子标记育种提高绵羊繁殖力极其重要。鉴于BMPR1B基因的重要性,而目前未见有关绵羊BMPR1B基因生物信息学报道,本研究通过网络软件和网络数据库,利用生物信息学对BMPR1B基因结构、蛋白质理化性质、二级结构、空间结构、同源进化以及FecB突变蛋白质结构进行分析,同时对BMPR1B功能、信号通路和蛋白互作网络进行预测,从而获得关于绵羊BMPR1B基因更加全面和深入的认识,为进一步研究BMPR1B基因生物学功能提供理论基础。
1 材料与方法
1.1 序列来源
所有序列均来自NCBI和UCSC数据库。包括绵羊BMPR1B基因DNA序列NC_019463;多个物种BMPR1B mRNA序列:绵羊(NM_001009431)、山羊(NM_001285575)、牛(NM_001105328)、人(NM_001256794)、猕猴(NM_001 266263)、猪(NM_001039745)、狼(NM_001145151)、小鼠(NM_007560)、大鼠(NM_001024259)、原鸡(NM_205132)和斑马鱼(NM_131457);同时获得以上物种的蛋白质序列。
1.2 方法
使用网络比对软件NCBI BLAST对绵羊DNA和mRNA序列进行基因结构分析,利用NCBI在线软件ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)对BMPR1B基因开放阅读框进行分析,同源性分析和进化树分析分别使用 ClustalW 软件(http://www.ebi.ac. uk/Tools/msa/clustalw2/)和MEGA6。BMPR1B蛋白理化性质 使 用 ExPASy-ProtParam tool(http://web.expasy. org/protparam/)进行分析。
二级结构预测使用 HNN(http://npsa-pbil.ibcp. fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html),蛋白质motif分析使用MEME(http://meme.nbcr.net/meme/cgibin/meme.cgi),蛋白功能结构域预测使用HMMER和 SMART(http://hmmer.janelia.org/),蛋白三维结构图使用SWISS-MODEL(http://swissmodel.expasy.org/),构象调整使用SPDBV软件。Pathway分析使用KEGG数据库(http://www.genome.jp/kegg/)。Gene ontology(GO)分析使用uniprot数据库(http://www.uniprot.org/)。蛋白互作网络分析使用网络软件STRING。
2 结果和分析
2.1 绵羊BMPR1B基因结构分析
通过查询NCBI数据库,获得绵羊全长为3 255 bp的BMPR1B mRNA序列(NM_001009431)。将mRNA序列放置UCSC Table Browser程序中比对分析,获得绵羊BMPR1B全长为225 039 bp的DNA序列。NCBI BLAST分析结果显示,绵羊BMPR1B位于第6号染色体,为基因组反向扩增序列。同时对比BMPR1B mRNA和DNA序列,结果显示,BMPR1B基因包含12个外显子,最大的外显子为第12外显子(1 720 bp),最小外显子为5’UTR区域的41 bp小片段,而FecB突变位点位于BMPR1B第8外显子。
2.2 绵羊BMPR1B蛋白理化性质分析
ProtParam预测绵羊BMPR1B蛋白的理化性质,BMPR1B基因编码502个氨基酸,分子量56 907.4 Da,理论等电点pI为7.78。在组成BMPR1B蛋白的20种氨基酸中,亮氨酸所占比例最高,达10.0%。BMPR1B蛋白带负电荷氨基酸残基数61,带正电荷氨基酸残基数63,疏水指数83.29,属于脂溶性蛋白。
2.3 绵羊BMPR1B蛋白质二级结构和三级结构分析
使用Hopfield神经网络(HNN)预测BMPR1B蛋白二级结构,从预测结果(图1A)可知,BMPR1B蛋白二级结构组分中,α-螺旋占23.51%,β-折叠占21.31%,自由卷曲占55.18%。motif结果(图1B)表明,BMPR1B主要存在3个motif,分别位于248-264 aa、354-403 aa和450-499 aa,这些motif是构成功能结构域的基础,图1B表明,各物种间在这些motif上具有高度的保守性。进一步分析绵羊BMPR1B功能结构域,发现BMPR1B具有Activin受体结构域、TGFB1结构域和蛋白激酶功能结构域(图1C)。
FecB是BMPR1B基因极为重要的突变位点,分析表明FecB位于一个α-螺旋区域,属于第一个保守motif,进一步分析表明FecB位于蛋白激酶功能结构域上。FecB突变使谷氨酰胺(Q)变成精氨酸(R),由不带电中性氨基酸变成了带负电的碱性氨基酸,其极可能改变蛋白质的空间结构。如图2所示,FecB突变改变了BMPR1B蛋白的空间结构,突变区域由向外开口,变成了向内偏。

图1 绵羊BMPR1B蛋白二级结构功能结构域分析
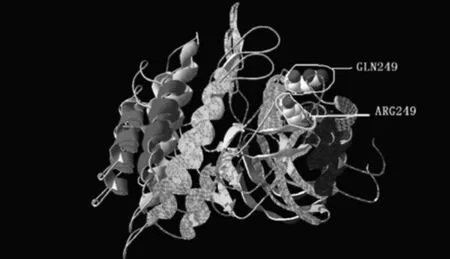
图2 绵羊BMPR1B FecB突变型和野生型蛋白空间结构对比图
2.4 绵羊BMPR1B基因直系同源性分析和进化树分析
使用ClustalW软件对各物种BMPR1B基因编码区(CDS)进行对比分析,结果显示BMPR1B CDS序列在10个物种间具有比较高的保守性,绵羊与山羊、牛、人、猕猴、猪、狼、小鼠、原鸡、斑马鱼CDS序列同源性分别达98.81%、98.21%、93.04%、93.57%、93.24%、92.58%、88.93%、81.31%和73.03%。对比各物种BMPR1B氨基酸序列,绵羊与山羊、牛、人、猕猴、猪、狼、小鼠、原鸡、斑马鱼同源性分别达98.8%、99.8%、98.41%、99.2%、98.61%、99%、98.61%、92.23%和81.87%。应用MEGA5.0软件的邻接法建立10个物种BMPR1B基因的进化树,结果显示(图3),绵羊与山羊亲缘最近,与斑马鱼亲缘最远,3种反刍动物绵羊、山羊和牛聚类在一起,人与猕猴聚类在一起。

图3 BMPR1B同源蛋白序列系统进化树
2.5 BMPR1B信号通路和蛋白互作通路分析
Gene Ontology(GO)分析结果表明,BMPR1B具有多项繁殖重要功能,包括卵丘细胞扩展(GO∶0001550)、排卵循环(GO∶0042698)和细胞分化的正调控(GO∶0045597);同时BMPR1B还具有骨骼系统发育(GO∶0001501)和软骨凝结(GO∶0001502)等与成骨生成密切相关的功能。Pathway分析表明,BMPR1B主要参与4个信号通路,细胞因子受体互作(ko04060)、TGFB信号通路(ko04350)、Hippo信号通路(ko04390)、多功能干细胞的调节通路(ko04550)。绵羊以TGFB信号通路为最重要,该通路中具有多个与繁殖力密切相关的蛋白(BMPs)。蛋白互作网络分析(图4)也表明,BMPR1B与TGFB信号通路中的蛋白都具有紧密的蛋白互作联系,网络中的蛋白彼此之间都有一定的关联性,但是大部分蛋白均以BMPR1B为媒介与其他蛋白进行关联,这表明BMPR1B在这些信号通路中起着重要的作用。
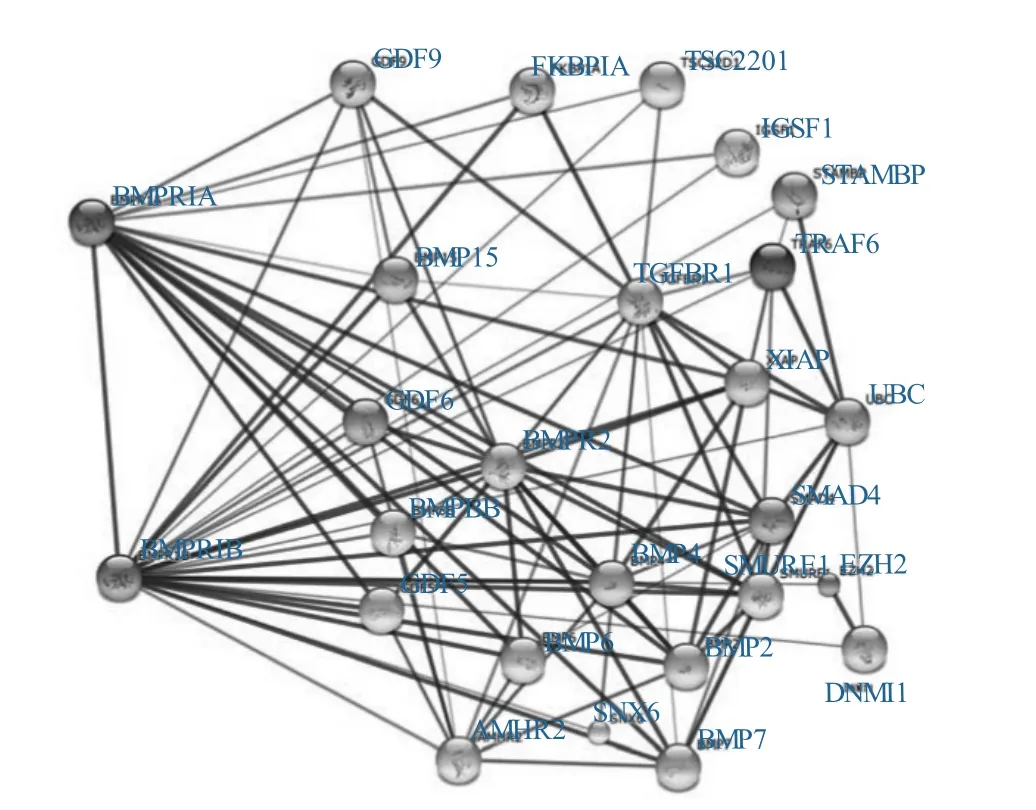
图4 BMPR1B蛋白互作网络
3 讨论
基因是组成生物性状的基本遗传单位,对基因结构的分析,就等同于对生命性状的解析。BMPR1B是绵羊繁殖力重要候选基因,对其深入的分析,将为解析绵羊产羔性状提供重要的基础。分析表明,BMPR1B是一个长片段基因,其DNA全长为20 k,但其编码区为1 509 bp,其它均为内含子。目前一些研究表明,内含子也具有调控基因的作用[12-14],BMPR1B内含子是否在调控上起作用,还有待进一步研究。
蛋白结构直接影响到蛋白的活性,早在2001年,Mulsant等[1]根据人TGF-β受体(TβR-I)和克莫司结合蛋白-12(FKBP-12)复合物模型,构建了BMPR1B蛋白与FKBP-12的空间结构模型,并认为FecB突变使得FKBP-12对BMPR1B活性抑制作用增强,从而细胞对BMPR1B特异性配体的敏感性下降,最终使得绵羊排卵数提高,然而此文对BMPR1B二级结构和功能结构域并无深入的分析。本研究分析表明,绵羊BMPR1B蛋白包含 α-螺旋 23.51%,β-折叠 21.31%和自由卷曲55.18%,这些结构组成了3个高度保守的motif,并进一步构成Activin受体、TGFB1和蛋白激酶3个功能结构域,这些功能结构域从侧面反映了BMPR1B的信号转导功能。对比分析FecB突变,发现该突变处于蛋白激酶活性区域,暗示FecB突变可能改变BMPR1B蛋白激酶活性。蛋白空间结构显示,FecB突变使得一个区域开口向外变成了向内偏,可能正是由于这微小的空间结构改变,使得BMPR1B功能活性发生改变。
本研究结果表明,各物种间BMPR1B编码区和蛋白同源性基本一致,BMPR1B序列保守性强,密码子偏好性不强。在进化分析中,绵羊与山羊的分子距离最近,同源性达98.8%以上,这与动物学分类结果一致。小鼠和猪高繁殖力动物聚类在一起,与其他相对低繁殖力的物种有明显的分支关系,暗示BMPR1B与繁殖力在遗传进化史上具有一定关联性。
最新绵羊基因组测序结果表明,绵羊油脂代谢为多基因互作的结果,并具有明显的信号通路[15],而目前对绵羊繁殖力的研究也开始集中在信号通路上[16-17]。本研究通过信号通路分析,发现BMPR1B蛋白与TGFB信号通路中的蛋白(BMPs、GDF6、SMAD4)具有明确的互作关系,从整体上看BMPR1B在其中起着关键节点的作用,许多基因之间的互作关系都需要通过BMPR1B进行关联。目前研究表明,GDF9、BMP15基因与绵羊高繁殖力密切相关[18-19],而在该蛋白互作图中可以看到,GDF9、BMP15均与BMPR1B密切相关,它们是否存在于同一通路,还有待进一步深入研究。同时蛋白互作网络中其他基因均可能与绵羊繁殖力有关联性。
[1] Mulsant P,Lecerf F,Fabre S,et al.Mutation in bone morphogenetic protein receptor-IB is associated with increased ovulation rate in Booroola Merino ewes[J].Proc Natl Acad Sci USA,2001,98(9):5104-5109.
[2] Wilson T,Wu X Y,Juengel J L,et al.Highly prolific Booroola sheep have a mutation in the intracellular kinase domain ofbone morphogenetic protein IB receptor(ALK-6)that is expressed in both oocytes and granulosa cells[J].Biol Reprod,2001,64(4):1225-1235.
[3] Souza C J H,MacDougall C,Campbell B K,et al.The Booroola(FecB) phenotype is associated with a mutation in the bone morphogenetic receptor type 1 B(BMPR1B)gene[J].J Endocrinol,2001,169(2):R1-R6.
[4] Piper LR,Bindon BM,Davis GH.Single gene inheritance ofthe high litter size of the Booroola Merino[C]//Land R B,Robinson D W. Genetics of Reproduction in Sheep.London:Butterworths,1985:115-125.
[5] RoyJ,PolleyS,De S,et al.Polymorphismof fecunditygenes(FecB,FecX,and FecG)in the Indian Bonpala sheep[J].Anim Biotechnol,2011,22(3):151-162.
[6] Mahdavi M,Nanekarani S,Hosseini S D.Mutation in BMPR-IB gene is associated with litter size in Iranian Kalehkoohi sheep[J].Anim Reprod Sci,2014,147(3-4):93-98.
[7] Chu MX,Liu ZH,JiaoCL,et al.Mutations in BMPR-IB and BMP-15 genes are associated with litter size in Small Tailed Han sheep(Ovis aries)[J].J AnimSci,2007,85(3):598-603.
[8] Guan F,Liu S R,Shi G Q,et al.Polymorphism of FecB gene in nine sheep breeds or strains and its effects on litter size,lamb growth and development[J].AnimReprod Sci,2007,99(1-2):44-52.
[9] 史洪才,高志英,牛志刚,等.新疆多浪羊FecB突变检测及与产羔数的关系[J].农业生物技术学报,2011,19(2):330-334.
[10]史洪才,牛志刚,白杰,等.BMPR1B基因突变对策勒黑羊产羔数的影响及其遗传规律的研究[J].中国畜牧杂志,2012,48(3):14-17.
[11]李达,孙伟,倪荣,等.绵羊FecB基因遗传多样性及其产羔数的关联分析[J].畜牧兽医杂志,2012,31(2):1-5.
[12]Wang X,Zhong J,Gao Y,et al.A SNP in intron 8 of CD46 causes a noveltranscriptassociatedwithmastitisinHolsteins[J].BMCGenomics,2014,15:630.
[13]Sun Y,Whittle C A,Corcoran P,et al.Intron evolution in Neurospora:the role of mutational bias and selection[J].Genome Res,2015,25(1):100-110.
[14]LuoH,ZhangY,GuoH,et al.Transcriptional regulation of the human,porcine and bovine OCTN2 gene by PPARalpha via a conserved PPRE located in intron 1[J].BMCGenet,2014,15(1):90.
[15]JiangY,Xie M,Chen WB,et al.The sheep genome illuminates biology of the rumen and lipid metabolism[J].Science,2014,344(6188):1168-1173.
[16]MiaoX,LuoQ.Genome-wide transcriptome analysis between Small-tail Han sheep and the Surabaya fur sheep using high-throughout RNA sequencing[J].Reproduction,2013,145(6):587-596.
[17]Varnosfaderani SR,Ostadhosseini S,Hajian M,et al.Importance ofthe GDF9 signaling pathway on cumulus cell expansion and oocyte competencyin sheep[J].Theriogenology,2013,80(5):470-478.
[18]Souza CJ,McNeillyAS,Benavides MV,et al.Mutation in the protease cleavage site of GDF9 increases ovulation rate and litter size in heterozygous ewes and causes infertility in homozygous ewes[J].Anim Genet,2014,45(5):732-739.
[19] Demars J,Fabre S,Sarry J,et al.Genome-wide association studies identify two novel BMP15 mutations responsible for an atypical hyperprolificacy phenotype in sheep[J].PLoS Genet,2013,9(4):e1003482.
过刊征订
1.《中国草食动物》杂志1999年(1~6期)21元,2000—2002年(1~6期)27元,2003年(2~6期)33元,2004—2008年(1~6期)39元,2009—2014年(1~6期)48元(均含挂号邮资);
2.有2002、2003、2004、2005、2006和2007年养羊专辑(包括品种、遗传、繁育、营养、市场等内容),价格分别为31、34、26、58、38、28元,含挂号邮资,数量有限,欲购从速;
3.请您汇款时务必写清楚通讯地址、邮政编码等事宜,以便准确投寄。
《中国草食动物科学》杂志社
Bioinformatics Analysis on BMPR1B Gene of Sheep
Pan Zhangyuan,Di Ran,Chu Mingxing,et al
(KeyLaboratoryofFarmAnimal Genetic Resources and GermplasmInnovation of MinistryofAgriculture,Institute of Animal Science,Chinese AcademyofAgricultural Sciences,Beijing100193,China)
In this study,the bioinformatics method was used to analyze the character of BMPR1B gene of sheep,including genetic structure,protein structure,physical and chemical properties,homologous evolution,signal pathways.The results showed that the complete DNA sequence of BMPR1B was 20 k,and it contained 12 exons.The FecB mutation located at the eighth exon.The analysis ofprotein structure showed that BMPR1B had three conservative motifs and three functional domains.The FecB mutation was present at the kinase domain and changed the construction of BMPR1B protein.Homologous evolution analysis showed that sheep had the highest homologyand the closest relationship with goat,followed bycattle,wolf,human,monkeys,mice,pigs,jungle fowl,zebrafish.Signaling pathway and protein interaction analysis showed that BMPR1B played an important role in the signal transduction ofTGFBpathwayas a membrane receptor.This paper has laid a biological foundation for further studyon the function ofBMPR1B gene in ovine reproduction.
sheep;BMPR1B gene;bioinformatics;FecB mutation;protein interaction
S826.2
A
2095-3887(2015)06-0001-05
10.3969/j.issn.2095-3887.2015.06.001
2015-10-10
内蒙古自治区科技重大专项;中国农业科学院科技创新工程(ASTIP-IAS13);国家肉羊产业技术体系专项(CARS-39);新疆维吾尔自治区科技支疆项目(2013911056);国家自然科学基金项目(31472078、31101687和31402041);北京市自然科学基金项目(6144029);中央级公益性科研院所基本科研业务费专项(2011cj-7和2013ywf-zd-1)
潘章源(1986-),男,博士,主要从事动物遗传育种与繁殖研究。
储明星(1968-),男,研究员,博士生导师,主要从事动物遗传育种与繁殖研究。

