MicroRNAs在胶质瘤中生物学功能及基因治疗潜力研究进展
刘 楠,涂艳阳,张永生(第四军医大学:唐都医院实验外科,唐都医院,陕西 西安 70038)
·基础与转化医学·
MicroRNAs在胶质瘤中生物学功能及基因治疗潜力研究进展
刘 楠1,涂艳阳1,张永生2(第四军医大学:1唐都医院实验外科,2唐都医院,陕西 西安 710038)
MicroRNAs(miRNA)是一类非编码 RNA,研究表明,胶质瘤中 miRNA表达水平异常与其发病机制及恶化密切相关,这为研究肿瘤发病机理提供了新的方向,同时为癌症的诊断与治疗提供了新的策略.神经胶质瘤是颅内最频发的恶性肿瘤,根据其恶性程度,世界卫生组织(WHO)将其分为 IIV 4个等级,每个等级又分为许多亚型.通过抑制参与调控胶质瘤细胞增殖和凋亡相关基因的表达,miRNA参与胶质瘤发生发展的调控,影响预后.此外,miRNA还影响着胶质瘤的放、化疗抵抗,它不仅可以作为胶质瘤临床诊断与治疗新的分子靶标,还可以作为胶质瘤基因治疗的靶点.本文综述了目前在神经胶质瘤中发现的表达水平上调或下调的 miRNAs,及其在胶质瘤发生发展中的生物学功能,讨论了 miRNAs在神经胶质瘤临床治疗中的诊断与治疗潜力.
MicroRNAs;神经胶质瘤;基因治疗
0 引言
神经胶质瘤(Glioma)是颅内最频发的恶性肿瘤,占脑内肿瘤的70%.根据其起源可以分为星形细胞瘤、恶性胶质瘤、成神经管细胞瘤、室管膜瘤和少突神经胶质 瘤[1].根据 其 恶 性 程 度,世界 卫 生 组 织(WHO)将其分为I-IV 4个等级,每个等级又分为许多亚型.由于其侵润性生长及丰富的血液供应,传统的癌症治疗手段如手术、放疗等预后较差[2].近年来,随着研究的深入,一系列神经胶质瘤治疗体系在不断完善,但是恶性胶质瘤的死亡率依然居高不下,其平均中位生存期小于 14个月[3].根据其恶性程度,神经胶质瘤可以分为低等级脑胶质瘤(WHO III)和高等级胶质瘤(WHO III-IV),低等级胶质瘤的中位生存期能达到6~10年,而高等级胶质瘤的中位生存期只有12~36个月[4].胶质母细胞瘤(glioblastoma multiforme,GBM)是脑胶质瘤中等级最高的,由于其高度侵袭性,手术难以将其彻底切除,而且其表现为对放疗、化疗不敏感,导致其预后极差,复发率高,难以治愈[5].目前,国际上标准的 GBM治疗方案是手术切除后加替莫唑胺(Temozolomide,TMZ)同步化疗,再予以 TMZ周期化疗,但是由于其高度放、化疗抵抗性,只有30%的患者中位生存期可达到2年,而达到 5年的患者只占9.8%[6].
目前,将 miRNAs应用于神经胶质瘤的治疗已经引起研究者的广泛关注.理论上,miRNA可以发挥其生物学功能,在分子水平上阻断神经胶质瘤的发生,提高患者的生存率.研究表明,敲除miR-21能降低胶质母细胞瘤细胞的生长速度,减小其侵袭性,促进其凋亡[7].暗示 miR-21表达下调可以增加癌细胞的化疗敏感性,这为癌症的临床治疗提供了新的策略,miRNAs将有望被开发成一种新的靶向抗癌剂.
虽然神经胶质瘤相关的 miRNAs研究还处在基础阶段,但是随着神经胶质瘤特异性miRNA表达谱的建立,为人类神经胶质瘤的诊断与治疗提供了新的方向.本文综述了目前在神经胶质瘤中发现的表达水平上调或下调的 miRNAs,及其在胶质瘤发生发展中的生物学功能,讨论了其在神经胶质瘤临床治疗中的诊断与治疗潜力.
1 MicroRNA简介
随着人类基因组计划的深入研究,占人类基因组99%的非编码序列越来越受到研究者们的关注,其中最受关注的是microRNA(miRNA).miRNA是一类内源性的单链小RNA,长约19~25 nt,虽无开放阅读框,不编码蛋白质,但其在机体许多重要的生命活动和疾病发生过程中扮演着重要的角色,miRNA通过不完全配对结合于靶基因的3′-非编码区,在转录后水平调控靶基因的表达[8],参与个体发育、细胞增值及分化和细胞凋亡等重要生命活动,这在癌症等疾病的发生发展中有着重要的意义.研究表明 miRNA在神经胶质瘤的发生发展中扮演着致癌基因或抑癌基因的角色[9],miRNA的发现为胶质瘤发病机理的研究提供了新的思路,同时为胶质瘤的诊断与预后提供了新策略.迄今为止,研究者们已经发现了数百种miRNAs,近年来,miRNA在分子生物学、遗传学和临床医学等研究领域中成为热点,大约有三人之一人类编码基因的转录表达受到miRNA的负调控[10].
1.1 microRNA的生物合成 miRNA由内源性基因编码,由 RNA聚合酶II/III转录而来(如图1所示).首先,在 RNA聚合酶 II/III的作用下产生具有一个或多个茎环结构的初级转录物,称为pri-miRNA.然后,pri-miRNA被Drosha/DGCR8复合体切割成长约60~110 nt的 miRNA前体 pre-miRNA,随后,premiRNA在输出因子 Exportin-5/Ran-GTP的协同作用下转运至细胞质中.在细胞质中,pre-miRNA在 RNA酶 III-Dicer酶与 TRBP协同作用下被切割成长约 19~25 nt的双链 RNA,其中编码链与含Argonautes的RNA沉默复合体(RISC)结合形成 RISC-miRNA沉默复合物.随后,RISC-miRNA与靶基因mRNA的3′-非编码区结合,抑制靶基因的表达,参与众多疾病的病理 进程[11].
1.2 microRNA在肿瘤中的重要研究意义 研究表明 miRNA表达谱在肿瘤组织与正常组织中存在较大的差异,在特定的肿瘤组织中同种 miRNA表达呈现明显上调或下调,在某种肿瘤组织中表达上调的miRNA在其他肿瘤组织则会呈现表达下调.miRNA表达异常对细胞信号通路有着重要的影响,导致细胞增值和分化失去控制[12].
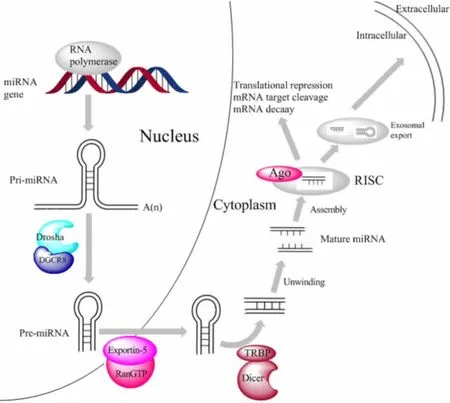
图1 microRNA的生物合成过程
近年来,许多研究表明 miRNA在肿瘤尤其是恶性肿瘤发生发展中具有重要的生物学意义.2002年,Croce等首次发现 miRNA与肿瘤的形成有关.神经胶质瘤的放、化疗抵抗性是目前临床治疗的巨大挑战,也是导致预后差的关键因素[13],这与 miRNA表达水平异常有着密切的关系.除了调控细胞增殖分化等生命活动,miRNA在癌症等众多疾病的病理进程中同样扮演着重要的角色,其表达水平异常成为恶性肿瘤的新特征.因此,一些特定的miRNA有潜力成为恶性肿瘤诊断与预后新的生物标记.事实上,超过50%的 miRNA基因位于染色体的脆性位点上,在肿瘤发生过程中,染色体的这些区域经常发生缺失、插入、异位等基因突变,这与肿瘤的发生发展密切相关[14].miRNA可以在外周血液循环中被检测到,肿瘤病人血浆中 miRNA水平的定量检测对癌症临床诊断有着重要的意义,血液中miRNA的筛查可以预测肿瘤是否转移,miRNA表达谱不仅可以作为癌症临床诊断的生物标志物,同样是预后评估的重要参照物.
研究表明,在 B细胞慢性淋巴瘤、卵巢癌、神经胶质瘤、肺癌、肝癌及结肠癌等肿瘤中,肿瘤组织的miRNA表达谱与正常组织存在明显的差异.证明miRNA表达异常与肿瘤发生发展及预后有着密切关系,研究肿瘤组织中miRNA表达水平异常对揭示肿瘤发生机制和寻求新的基因治疗靶点以及提供疾病临床诊断与预后新指标等方面有着深远的意义.
1.3 microRNA在胶质瘤中的重要研究意义 近年来,诸多研究表明 EGFR基因过表达、PTEN基因缺失突变及 p53基因突变等分子事件与人类肿瘤的发生密切相关,神经胶质瘤的发生与细胞周期失控,信号通路中关键成员水平异常,细胞代谢紊乱等多种基因功能紊乱有关,然而,这些都受到miRNA的负调控.
miRNA表达水平异常对胶质瘤细胞的增殖、凋亡、转移、侵袭性和抗药性有着重要的影响.2005年,Chan等[15]首次研究指出 miR-21在胶质瘤组织中表达显著上调,miR-21过表达抑制细胞凋亡相关基因的表达,诱导肿瘤恶化,该报道拉开了研究 miRNA表达异常与神经胶质瘤发生发展关系的新篇章.Ciafrè等[16]通过基因芯片定量分析了胶质瘤组织中数百种miRNAs的表达情况,结果表明,与正常组织相比,其中有 13种 miRNAs表达水平异常,其中miR-21,miR-9-2,miR-10b,miR-25,miR-123,miR-125b-1,miR-125b-2,miR-221,miR-130a 9种 miRNAs水平则显著上调.
目前,大量miRNA在哺乳动物脑组织被发现,这些 miRNA不仅与脑组织发育、神经元分化和高级神经功能有关,还与神经退行性疾病、精神病和脑肿瘤等疾病密切相关.研究表明[17],在胶质瘤组织中存在一类可以无限增殖与自我更新的细胞,这些细胞具有多向分化潜能,被称为胶质瘤干细胞(glioma stem cells,GSCs).与一般的肿瘤细胞相比,胶质瘤干细胞具有更强的增殖和癌变活力,其生物学特性与神经干细胞相似,与胶质瘤发生发展及复发密切相关.随着miRNA生物学功能研究的深入,研究发现miRNA与其靶基因间存在一个复杂的调控网络,miRNA通过调控 RTK-Akt、Notch、BMPs/TGF-P、Hedgehog-Gli、Wnt-b-catenin、STAT3、GSK3-e等信号通路中的关键分子的表达影响胶质瘤的发生.研究指出,miRNA能在转录后水平上调控信号通路中关键分子的表达,导致信号通路异常,这些细胞中重要的信号通路的异常直接导致细胞周期 G1/S期监控点失活,使细胞周期调节失控,导致细胞异常增殖,进而导致肿瘤发生.RTK-Akt信号通路,即多种癌基因生长因子的受体酪氨酸激酶转录途径,miR-7不仅能通过抑制 ATK信号通路中IRS2的表达阻碍细胞周期进程,还能通过抑制EGFR基因的表达来阻断 ATK信号通路,进而减弱胶质瘤细胞的侵袭性和生存能力.研究发现胶质瘤干细胞较普通的胶质瘤细胞更依赖 Akt途径,阻断 ATK信号通路可以抑制胶质瘤干细胞的生长[17].Notch信号通路在维持干细胞自我更新和抑制其分化上扮演着重要的角色,miR-326能通过抑制 Notch信号通路而诱导胶质瘤细胞和胶质瘤干细胞的凋亡,同样 miR-107通过抑制Notch的表达抑制胶质瘤干细胞的增殖和侵袭.Li等[18]首次发现 pre-miR-34a在胶质瘤细胞中表达下调,miR-34a过表达能同时抑制胶质瘤细胞中 Notch-1、Notch-2、CDK6和c-Met的表达.此外,Notch表达水平异常与胶质瘤干细胞的放疗抗性相关.TGF-β分子是 TGF-β信号通路中的关键信号分子,扮演着癌基因的角色,它不仅能诱导肿瘤组织血管生成,还能提高肿瘤细胞的侵袭性.miR-34a是胶质母细胞瘤 TGF-β信号通路新的调控分子,它通过靶向作用于 Smad4调控TGF-β信号通路,TGF-β信号通路是胶质母细胞瘤(GBM)中的重要致癌因素.最近一项研究表明,miR-146a是胶质母细胞瘤细胞TGF-β信号通路新的调节因子,其过表达可以抑制U87细胞增殖和转移[19].Hedgehog-Gli信号通路同样在神经干细胞的自我更新中扮演着重要的角色,研究表明,Hedgehog-Gli信号通路与肿瘤的发生及胶质瘤干细胞的自我更新密切相关,阻断Hedgehog-Gli信号通路可直接抑制胶质瘤干细胞的生长,诱导其凋亡[20].Gu等[21]通过基因芯片分析发现17种作用于Hedgehog-Gli信号通路的 miRNAs在胶质母细胞瘤中表达水平异常.STAT3信号通路在胶质瘤干细胞的增殖中同样扮演着重要的角色,敲除信号分子STAT3基因可以抑制胶质瘤干细胞的生长,因此,STAT3基因在胶质瘤干细胞中充当致癌基因的角色.研究表明,miR-124可以抑制STAT3基因表达,从而加强神经胶质瘤中T细胞介导的免疫清除作用,miR-124是STAT3信号通路的重要调节因子,STAT3信号通路是介导肿瘤微环境免疫抑制的关键信号通路.在胶质母细胞瘤中,miR-21可以通过抑制STAT3的表达而调节hTERT的表达.
换言之,miRNAs通过以下几个方面在神经胶质瘤的发生发展中扮演着重要的角色,研究胶质瘤中miRNAs的调控作用对于阐明胶质瘤的病理机制和胶质瘤基因治疗有着重要的意义.①miRNA可以调控抑癌基因的表达,如 miR-21可以抑制细胞凋亡相关基因的表达[22],miR-221和 miR-222可以抑制抑癌基因p27的表达[23].②miRNA可以调控胶质瘤发生发展相关的信号通路,如miR-7可以通过阻断 ATK信号通路来抑制胶质瘤的发生[24].③miRNA可以调控胶质瘤干细胞的分化,如过表达 miR-124和 miR-137可以诱导胶质瘤干细胞分化为胶质瘤细胞,值得注意的是 miR-16、miR-107、miR-185、miR-425、miR-451和 miR-486在 CD133-细胞系中表达水平显著上调,却在 CD133+细胞系中表达下调[25].
2 胶质瘤中表达上调的microRNA
诸多文献报道,过表达是 miRNA在胶质瘤中最常见的表达异常方式,本部分将详细综述miR-21、miR-93及 miR-221/222三种在神经胶质瘤中研究最全面最透彻miRNAs的作用靶点及生物学功能,如表1所示.
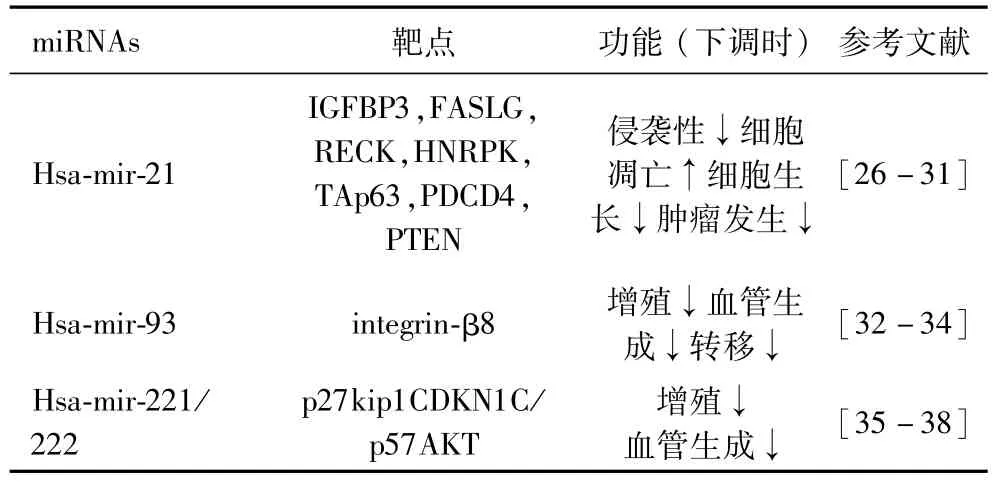
表1 胶质瘤中表达上调的miRNAs及其生物学功能
2.1 miR-21 miR-21是首个在胶质瘤中被研究的miRNA,与正常脑组织相比,其在胶质瘤组织中表达显著上调,文献指出当敲除miR-21时,胶质瘤细胞中的 caspase将被激活,后者与细胞凋亡密切相关,暗示miR-21在胶质瘤中扮演着癌基因的角色.根据 WHO的疾病分类标准,miR-21表达上调在 IV级星形细胞瘤中更为显著,功能研究表明,在 GBM中,敲除 miR-21可诱导细胞凋亡,同时细胞的生长和侵袭性降 低[26].
研究表明,在GBM中,胰岛素生长因子结合蛋白-3(IGFBP3)是miR-21的直接作用靶点,miR-21可以抑 IGFBP3的表达,后者是重要的肿瘤抑制因子,在GBM发生中发挥抑癌基的作用.miR-21参与调控胶质瘤干细胞的增殖与凋亡,Shang等研究发现FASLG是 miR-21新的作用靶点,抑制 miR-21的表达可以直接降低胶质瘤干细胞中的 FASLG表达水平,从而降低细胞增殖速率,引发细胞凋亡.miR-21还可以直接作用于 RECK,参与调控 β-catenin/STAT3信号通路,诱导胶质瘤细胞增殖和侵袭[27].Papagiannakopoulos等报道miR-21通过靶向作用于 HNRPK、TAp63及PDCD4等重要的细胞周期调控因子,参与调控 p53、TGF-β及线粒体凋亡信号通路,从而调控细胞凋亡,此外,敲除miR-21可以抑制PI3K/ATK信号通路,从而增加胶质瘤细胞的放疗敏感性,同时加强辐射引发的细胞自噬作用,这表明在恶性胶质瘤中 miR-21水平与放疗抗性密切相关[28].
近年来,药物抵抗是临床上癌症治疗遇到的多因素的普遍现象,也是导致预后差的直接因素.研究发现,敲除miR-21可以增加U251细胞(PTEN突变型)和 L229细胞(PTEN野生型)对抗癌药物紫杉醇的敏感性,表明PTEN可能是miR-21在胶质瘤中另外一个作用靶点,miR-21还与胶质瘤替莫组胺抵抗相关,miR-21抑制剂与替莫组胺联合给药 LN229细胞可以获得较好的抗肿瘤效果[29].miR-21水平与胶质瘤病人的预后密切相关,诸多研究表明,高等级胶质瘤(III-IV)中的 miR-21水平要远高于低等级胶质瘤(I-II)[28-30],Hermansen等[30]研究发现 miR-21同时存在于肿瘤细胞和外周血液循环中,细胞中高水平的 miR-21与胶质瘤病人预后差密切相关.
研究 miR-21在胶质瘤中的表达上调机制对阐明胶质瘤的发病机理有着重要的意义.DNA脱甲基化被认为是卵巢癌细胞中 miR-21转录激活的重要机制,基因低甲基化是在癌症中的普遍表现,可以激活GBM等癌症的致癌基因[31],但是 miR-21在胶质瘤发生过程中发挥的准确的表观遗传学作用还有待深入研究.
2.2 miR-93 研究表明 miR-93在 GBM中过表达[32],miR-93隶属于 miR-106b~25家族,该家族与miR-17~92家族同源,都发挥着致癌基因的作用.研究表明[33],miR-93通过靶向作用于 integrin-β8可以促进肿瘤血管生成,同时,integrin-β8参与调控 GBM细胞凋亡,当将内皮细胞与感染外源性的 miR-93的U87细胞共培养时,其增殖,迁移与管腔形成显著增强.此外,miR-93过表达可以显著增加 GBM异体移植瘤小鼠的血管生成速率[34],这表明miR-93是一个血管生成诱导因子,这一发现为 GBM临床治疗提供了新策略.
2.3 miR-221/222 miR-221和miR-222位于染色体 Xp11.3,隶属于同一家族,具有相同的作用靶点[35],他们通常在高级星形细胞瘤 (III~ IV)和GBM中表达上调.miR-221/222可以抑制 p27kip1(细胞周期依赖性激酶抑制因子 1B)的表达,后者是一个重要的细胞周期抑制因子,在高级星形细胞瘤中表达显著下调,p27kip1可以与CDK结合使细胞周期停滞在 G1期,研究发现 p27kip1是 miR-221/222的直接作用靶点[36].根据生物信息学分析,CDK4可能是 miR-221的转录激活因子,当其表达被抑制时p27kip1水平显著增加,抑制 miR-221转录可以获得相同的结果[37].通过分析 GBM细胞周期进程中的miRNA表达谱,研究发现miR-221/222在 G1/S期表达水平上调,同时发现CDKN1C/p57是miR-221/222的另一个作用靶点.Zhang等通过生物信息学分析发现16个 miR-221/222作用靶点,这些靶点与ATK信号通路密切相关,表明在胶质瘤中 miR-221/222同时参与调控 ATK信号通路.此外,有研究表明miR-221/222表达水平上调增强了胶质瘤细胞的增殖和侵袭,同时诱导皮下异种移植小鼠模型的胶质瘤生 长[38].
2.4 其他在胶质瘤中表达上调的 microRNA 此外,研究发现越来越多的 miRNA被证实在胶质瘤细胞和组织中表达水平上调,与 miR-21、miR-93和miR-221/222一致,这些 miRNA在胶质瘤中表达下调可以抑制肿瘤细胞生长,降低其增殖、侵袭和迁移,可以作为潜在的胶质瘤诊断与治疗的非侵袭性生物标志物.研究表明 miR-372在胶质瘤中表达水平显著上调,PHLPP2是其作用靶点,降低 miR-372水平可以降低胶质瘤细胞增殖和侵袭,诱导细胞凋亡[39].miR-454-3p水平同样可以作为胶质瘤潜在的预后标,miR-17过表达预示着胶质瘤病人预后较差,体外实验表明,miR-23b和miR-92b在胶质瘤中的作用靶点分别是VHL和 NLK,抑制 miR-23b和 miR-92b的表达可以抑制胶质瘤细胞的生长和侵袭,诱导细胞凋亡,在GBM中降低miR-146水平可以阻断TGF-β信号通路[40].此外,miR-10b、miR-15b、miR-18a、miR-33a、miR-155、miR-182、miR-183、miR-210、miR-335和miR-381等也被证实在胶质瘤中过表达,这些 miRNAs在胶质瘤发生发展过程中扮演着癌基因的角色,可以作为胶质瘤临床治疗的新靶标.
3 胶质瘤中表达下调的microRNA
此外,本文还综述了已证实在胶质瘤中表达下调的 miRNAs,它们是胶质瘤发生发展过程中重要的肿瘤抑制因子,本文重点综述了 miR-128、miR-7、miR-218和miR-1814种近几年来报道最多的 miRNAs,如表2所示.

表2 胶质瘤中表达下调的 miRNAs及其生物学功能
3.1 miR-128 miR-128被认为是脑组织特异性miRNA,分散于机体其它组织,诸多研究表明,miR-128在 GBM中表达下调[41-45],但是在低级胶质瘤中下调不显著[41].Bmi-1是第一个在胶质瘤中被证实的 miR-128作用靶点,它可以促进干细胞自我更新,是一个致癌基因,Bmi-1是第一个被发现的神经干细胞自我更新因子,研究发现 miR-218过表达不仅可以显著降低胶质瘤细胞的增殖速率,还可以抑制小鼠体内移植胶质瘤的生长[42].E2F3a是一个重要的转录因子,也是 miR-128的另一个作用靶点,研究表明,miR-128可以通过抑制 E2F3a的表达而抑制胶质瘤细胞增殖,无论在胶质瘤组织还是在正常脑组织中,E2F3a的水平与 miR-128的水平皆呈现负相关,此外,过表达 miR-128可以降低 T98G细胞的E2F3a水平.
研究表明,miR-128可以抑制 EGFR和 PDGFRα等 RTKs类癌基因的表达,从而加强神经元分化进而抑制胶质瘤初始干细胞(glioma-initiating neural stem cells,giNSC)生长,体内实验表明,miR-128是重要的肿瘤抑制因子[43].Peruzzi等[44]研究发现miR-128可以抑制GBM中癌基因PRC的表达,而且miR-128表达缺失是GBM发生的早期分子事件.EphB1和EphB2是 miR-128在胶质瘤中的新的作用靶点,miR-128可以抑制 EphB1和EphB2的表达从而促进 U87细胞的细胞间粘连作用,进而抑制胶质瘤细胞迁移.在胶质瘤细胞中,WEE1和 Msi1被证实同样是 miR-128的作用靶点.p70S6K1同样是 miR-128在胶质瘤中的作用靶点,miR-128过表达可以抑制胶质瘤细胞中 p70S6K1的水平,进而抑制其下游分子 HIF-1和VEGF的表达,从而抑制胶质瘤组织血管生成速率.最近一项研究表明,SNAI1/miR-128/SP1复合物在胶质瘤发生发展中扮演着重要的角色,SP1是 miR-128另一个作用靶点[45],指出该复合物可以作为胶质瘤临床诊断与治疗的分子靶标.
3.2 miR-7 miR-7在胶质瘤中同样表达下调,参与调控胶质瘤细胞中重要的信号通路,EGFR和 ATK信号通路活化是 GBM中常见的分子事件.Kefas等[24]研究表明,miR-7不仅可以显著抑制 GBM中EGFR的表达,还可以通过抑制 ATK信号通路下游的调控因子ISR1和ISR2的表达而阻断ATK信号通路,且转染 miR-7可以降低 GBM细胞的生存活力和侵袭性,miR-7可以通过抑制位于EGFR下游的转录因子 PI3K和 Raf-1分别抑制 PI3K/ATK和Raf/MEK/ERK信号通路,miR-7过表达可以抑制 GBM细胞增殖和迁移,诱导其凋亡[46].
miR-7的在GBM中的另一个作用靶点是黏着斑激酶(FAK),研究表明,miR-7可以通过抑制FAK的表达而降低GBM细胞的侵袭性,而且miR-7过表达可以降低U87细胞和U251细胞的迁移和侵袭,GBM细胞中内源性的miR-7和FAK水平呈现显著的负相关,此外,作者还指出 miR-7可以抑制GBM中促侵袭因子p-ERK1/2、MMP-2和MMP-9的表达.Babae等研究发现,过表达miR-7可以抑制GBM组织血管生成,转染 miR-7可以降低内皮细胞的生存能力、官腔形成和迁移,达到与抗血管生成药物舒尼替尼类似的效果[47].以上研究表明,miR-7在神经胶质瘤中表达下调,它可以作为肿瘤抑制因子,可以作为胶质瘤分子治疗的潜在靶点.
3.3 miR-218 研究表明 miR-218在肿瘤组织中表达显著下调,诸多证据表明,它可以抑制胶质瘤的恶化[48-50].在胶质瘤细胞中,IKK-β是 NF-kβ的上游调节因子,过表达 miR-218可以直接抑制其的表达,从而抑制NF-kβ/MMP-9信号通路,进而抑制胶质瘤细胞的侵袭性,诱导细胞凋亡,同时,NF-kβ信号通路中调节 NF-kβ信号表达的基因表达皆上调.其中,ECOP是NF-kβ信号的重要调节因子,过表达miR-218不仅可以抑制其表达,还显著抑制 NF-kβ分子下游基因如 BcL-xL,MYC和CCND1NF-kβ的表达,进而诱导胶质瘤细胞凋亡[48].
此外,随着胶质瘤的恶化,其组织中miR-218的水平显著下降,具有癌基因功能的转录因子 LEF1是miR-218另一个重要的作用靶点,研究表明,通过抑制其表达,可以抑制GBM的细胞侵袭,MMP家族是位于Wnt/LEF1信号通路下游的调控因子,过表达mi-218可以抑制 miR-218-LEF1-MMPs复合物的促侵袭作用[49].本研究组之前的研究表明,miR-218可以抑制Bmi1基因的表达而抑制胶质瘤细胞的增殖,侵袭,迁移和胶质瘤干细胞的自我更新[50].胶质母细胞瘤尤其是间叶细胞的胶质母细胞瘤是频繁呈现组织缺氧和坏死的严峻恶性肿瘤,组织缺氧是导致化疗抗性的因素之一,在小鼠窝藏颅内肿瘤组织中转染外源性的 miR-218可以显著提高替莫组胺的药物敏感性,从而提高小鼠的生存率,此外,过表达miR-218可以抑制 RTK信号通路中的众多分子的表达,从而抑制缺氧诱导因子2a(HIF2a)的表达,提高 GBM细胞的生存活力.
3.4 miR-181家族 miR-181家族包括miR-181a、miR-181b和miR-181c,均在胶质瘤中表达下调,指出这些 miRNAs是胶质瘤发生发展中重要的肿瘤抑制剂.研究表明,miR-181a表达水平与胶质瘤等级呈现负相关,但是 miR-181b表达下调只在II-IV胶质瘤中被检测到,然而胶质瘤中的 miR-181c水平却与正常脑组织相似.研究表明,在GBM中过表达miR-181a和miR-181b可以抑制细胞生长和侵袭,使GBM细胞失去锚定非依赖性生长,诱导细胞凋亡[51].
近年来放、化疗抵抗是胶质瘤临床治疗中面临的两个严峻的挑战,也是导致胶质瘤预后差的重要原因,替莫组胺抗药性同样是胶质瘤临床治疗面临的重要问题,miR-181家族表达上调可以抑制 Rap1B介导的细胞骨架重拍,进而加强 GBM细胞对替莫组胺的化疗敏感性,miR-181家族过表达可以显著抑制 GBM细胞的侵袭性生长.Gong等[52]研究指出海兔素可以提高胶质瘤细胞中 miR-181的水平,进而提高胶质瘤细胞对替莫组胺的药物敏感性,诱导细胞周期停滞和细胞凋亡,表现出肿瘤抑制活性.近年来,研究表明,miR-181可以抑制细胞周期蛋白B1的表达,进而抑制胶质瘤细胞的增殖,过表达miR-181可以抑制胶质瘤细胞 U251和SHG-44的增殖[53].
3.5 其他在胶质瘤中表达上调的 microRNA 近年来,miR-326、miR-214、miR-31、miR-142-3p、miR-205、miR-297、miR-326、miR-622和 miR-708等众多 miRNA被证实在胶质瘤中表达显著下调.据报道,miR-326在胶质瘤中表达水平显著下调,它可以通过抑制SMO的表达而抑制 Hedgehog信号通路,进而抑制胶质瘤细胞的增殖,侵袭和生存活力[54].miR-214在胶质瘤中表达下调,可以抑制 UBC9的表达,进而抑制肿瘤细胞的增殖、迁移、侵袭.miR-203在胶质瘤中表达表达显著下调,这与胶质瘤病人预后差密切相关,miR-297可以靶向抑制 DGK-α表达而抑制 GBM侵袭,miR-708同样在 GBM细胞中扮演着肿瘤抑制因子的角色.以上结果表明,此类在胶质瘤中表达下调的 miRNAs可以抑制胶质瘤的发生发展,可以作为胶质瘤临床治疗的靶向分子药物.
4 microRNA在胶质瘤基因治疗中的潜力
研究表明,正常脑组织与胶质瘤组织的 miRNA表达谱存在显著地差异,因此,miRNA可以成为胶质瘤诊断和治疗的生物靶标,此外,这些在胶质瘤组织中表达显著下调的众多 miRNA可以作为胶质瘤治疗的潜在分子药物.通过分析结肠癌,肝癌,胰腺癌和胃癌样本的miRNA表达谱,发现其miRNA表达谱可以作为其分级的重要分子指标[55].
近年来研究发现 miR-21、miR-196-a-2、miR-26等miRNA可以作为癌症诊断与治疗的重要生物标志物.在胰腺癌中 miR-196-a-2水平高的患者的中位生存期只有14.3个月,而miR-196-a-2低水平患者的中位生存期则高达26.5个月,miR-196-a-2水平可以作为预测患者存活时间的一项指标[56].研究表明,miRNA表达谱不仅在胶质瘤诊断中扮演着重要的角色,而且可以预测患者的预后,所以这些特异性表达的 miRNA可以作为胶质瘤基因治疗的分子靶标.Stanley等研究指出,采取 miR-21抑制剂与替莫组胺联合治疗可以较替莫组胺单独治疗可获得较高的细胞凋亡率,通过转染反义-miR-21寡核苷酸降低 GBM中 miR-21水平可以降低替莫组胺的化疗抗性[57].Griveau等用锁核酸-脂质纳米胶囊复合物(LNALNCs)技术降低GBM细胞中的 miR-21水平,增加了GBM细胞对辐射诱导致死的敏感性,该锁核酸-脂质纳米胶囊复合物技术为 miRNA用于胶质瘤临床治疗奠定了坚实的基础[58].
由于基因治疗低毒性和高特异性,其在癌症治疗中将得到广泛应用,开展基因治疗要建立在对透彻研究癌症发病机理的基础之上.miRNA可以抑制细胞信号通路中关键分子的表达,进而阻断参与机体新陈代谢的重要的信号通路,因此,它可以作为一种良好的基因治疗媒介分子,诸多miRNA可以作为胶质瘤基因治疗的靶标.然而,如何穿透血脑屏障,克服网状内皮组织吸收作用,解决细胞外基质及细胞内干扰等复杂因素,将 miRNA传送到中枢神经系统是目前面临的严峻挑战.为解决这些问题,近年来研究者们不断的在改善细胞传送策略,如用脂质胶囊靶向传送寡核苷酸,重组腺病毒(rAAVs)可以穿透血脑屏障,用来运输外源性的 miRNA直达病灶.为了减轻患者痛苦,改善预后,如何运输具有肿瘤抑制因子活性的miRNA到达胶质瘤病灶仍需深入研究.
5 总结与展望
胶质瘤是目前发病率最高的颅内恶性肿瘤,研究表明,miRNA在胶质瘤发病机理中扮演着重要的角色,然而,是肿瘤的发生发展导致 miRNA水平异常,还是miRNA水平异常引起肿瘤的发生和恶化目前尚不清楚.miRNA可以在转录后水平抑制基因表达,在胶质瘤中,它可以充当抑癌基因和癌基因,本文综述了在胶质瘤发生恶化过程中表达水平异常的 miRNAs,它们参与调控胶质瘤细胞的增殖、迁移、侵袭、凋亡,影响胶质瘤治疗的放、化疗抵抗,与胶质瘤病人预后密切相关.miRNA将是胶质瘤病理学中新的生物标志物,将为胶质瘤的临床诊断与治疗提供新的策略.
[1]Miller CR,Perry A.Glioblastoma[J].Arch Pathol Lab Med,2007,131(3):397-406.
[2]Kleber S,Sancho-Martinez I,Wiestler B,et al.Yes and PI3K bind CD95 to signal invasion of glioblastoma[J].Cancer Cell,2008,13(3):235-248.PMID:18328427.
[3]Novakova J,Slaby O,Vyzula R,et al.MicroRNA involvement in glioblastoma pathogenesis[J].Biochem Biophys Res Commun,2009,386:1-5.
[4]Cho DY,Lin SZ,Yang WK,et al.The role of cancer stem cells(CD133(+))in malignant gliomas[J].Cell Transplant,2011,20:121-125.
[5]Bao S,Wu Q,McLendon RE,et al.Glioma stem cells promote radioresistance by preferential activation of the DNA damage response[J].Nature,2006,444(7120):756-760.
[6]Becker KP,Yu J.Status quo-standard-of-care medical and radiation therapy for glioblastoma[J].Cancer J,2012,18(1):12-19.
[7]Corsten MF,Miranda R,Kasmieh R,et al.MicroRNA-21 knockdown disrupts glioma growth in vivo and displays synergistic cytotoxicity with neural precursor cell delivered S-TRAIL in human gliomas[J].Cancer Res,2007,67:8994-9000.
[8]Liu X,Fortin K,Mourelatos Z.MicroRNAs:biogenesis and molecular functions[J].Brain Pathol,2008,18:113-121.
[9]Lee SJ,Kim SJ,Seo HH,et al.Over-expression of miR-145 enhances the effectiveness of HSVtk gene therapy for malignant glioma[J].Cancer Lett,2012,320(1):72-80.
[10]Xi Y,Shalgi R,Fodstad,et al.Differentially regulated micro-RNAs and actively translated messenger RNA transcripts by tumor suppressor p53 in colon cancer[J].Clin Cancer Res,2006,12(7):2014-2024.
[11]Winter J,Jung S,Keller S,et al.Many roads to maturity:microRNA biogenesis pathways and their regulation[J].Nat Cell Biol,2009,11(3):228-234.
[12]Inui M,Martello G,Piccolo S.MicroRNA control of signal transduction[J].Nat Rev Mol Cell Biol,2010,11(4):252-263.
[13]Ziegler DS,Wright RD,Kesari S,et al.Resistance of human glioblastoma multiforme cells to growth factor inhibitors is overcome by blockade of inhibitor of apoptosisproteins[J].J Clin Invest,2008,118(9):3109-3122.
[14]Zhang B,Pan X,Cobb GP,et al.microRNAs as oncogenes and tumor suppressors[J].Dev Biol,2007,302(1):1-12.
[15]Chan JA,Krichevsky AM,Kosik KS.MicroRNA-21 is an antiapoptotic factor in human glioblastoma cells[J].Cancer Res,2005,65(14):6029-6033.
[16]Ciafrè SA,Galardi S,Mangiola A,et al.Extensive modulation of a set of microRNAs in primary glioblastoma[J].Biochem Biophys Res Commun,2005,334(4):1351-1358.
[17]Gallia GL,Tyler BM,Hann CL,et al.Inhibition of Akt inhibitsgrowth of glioblastoma and glioblastoma stem-like cells[J].Mol Cancer Ther,2009,8(2):386-393.
[18]Li Y,Guessous F,Zhang Y,et al.MicroRNA-34a inhibits glioblastoma growth by targeting multiple oncogenes[J].Cancer Res,2009,69(19):7569-7576.
[19]Lv S,Sun B,Dai C,et al.The Downregulation of MicroRNA-146a Modulates TGF-β Signaling Pathways Activity in Glioblastoma[J].Mol Neurobiol,2014.[Epub ahead of print]
[20]Ehtesham M,Sarangi A,Valadez JG,et al.Ligand-dependent activation of the hedgehog pathway in glioma progenitor cells[J].Oncogene,2007,26:5752-5761.
[21]Gu W,Shou J,Gu S,et al.Identifying Hedgehog Signaling Specific MicroRNAs in Glioblastomas[J].Int J Med Sci,2014,11(5):488-493.
[22]Zhou X,Ren Y,Moore L,et al.Downregulation of miR-21 inhibits EGFR pathway and suppresses the growth of human glioblastoma cells independent of PTEN status[J].Lab Invest,2010,90(2):144-155.
[23]Zhang C,Wang G,Kang C,et al.Up-regulation of p27(kip1)by miR-221/222 antisense oligonucleotides enhances the radiosensitivity of U251 glioblastoma[J].Zhonghua Yixue Yichuanxue Zazhi,2009,26(6):634-638.
[24]Kefas B,Godlewski J,Comeau L,et al.microRNA-7 inhibits the epidermal growth factor receptor and the Akt pathway and is downregulated in glioblastoma[J].Cancer Res,2008,68(10):3566-3572.
[25]Gal H,Pandi G,Kanner AA,et al.MIR-451 and Imatinib mesylate inhibit tumor growth of Glioblastoma stem cells[J].Biochem Biophys Res Commun,2008,376(1):86-90.
[26]Gabriely G,Wurdinger T,Kesari S,et al.MicroRNA 21 promotes glioma invasion by targeting matrix metalloproteinase regulators[J].Mol Cell Biol,2008,28:5369-5380.
[27]Shang C,Guo Y,Hong Y,et al.MiR-21 up-regulation mediates glioblastoma cancer stem cells apoptosis and proliferation by targeting FASLG[J].Mol Biol Rep,2014.[Epub ahead of print]
[28]Gwak HS,Kim TH,Jo GH,et al.Silencing of microRNA-21 confers radio-sensitivity through inhibition of the PI3K/AKT pathway and enhancing autophagy in malignant glioma cell lines[J].PLoS One,2012,7(10):e47449.
[29]Qian X,Ren Y,Shi Z,et al.Sequence-Dependent Synergistic Inhibition of Human Glioma Cell Lines by Combined Temozolomide and miR-21 Inhibitor Gene Therapy[J].Mol Pharmaceutics,2012,9:2636-2645.
[30]Hermansen SK,Dahlrot RH,Nielsen BS,et al.MiR-21 expression in the tumor cell compartment holds unfavorable prognostic value in gliomas[J].J Neurooncol,2013,111:71-81.
[31]Iorio MV,Visone R,Di Leva G,et al.MicroRNA signatures in human ovarian cancer[J].Cancer Res,2007,67:8699-8707.
[32]Lavon I,Zrihan D,Granit A,et al.Gliomas display a microRNA expression profile reminiscent of neural precursor cells[J].Neuro-Oncology,2010,12(5):422-433.
[33]Dong H,Siu H,Luo L,et al.Investigation gene and microRNA expression in glioblastoma[J].BMC Genomics,2010,11(Suppl 3):S16.
[34]Fang L,Deng Z,Shatseva T,et al.MicroRNA miR-93 promotes tumor growth and angiogenesis by targeting integrin-β8[J].Oncogene,2011,30(7):806-821.
[35]Lewis BP,Shih IH,Jones-Rhoades MW,et al.Prediction of mammalian microRNA targets[J].Cell,2003,115:787-798.
[36]Gillies JK,Lorimer IA.Regulation of p27Kip1 by miRNA 221/222 in glioblastoma[J].Cell Cycle,2007,6(16):2005-2009.
[37]Medina R,Zaidi SK,Liu CG,et al.MicroRNAs 221 and 222 bypass quiescence and compromise cell survival[J].Cancer Res,2008,68:2773-2780.
[38]Zhang J,Han L,Ge Y,et al.miR-221/222 promote malignant progression of glioma through activation of the Akt pathway[J].Int J Oncol,2010,36:913-920.
[39]Chen X,Hao B,Liu Y,et al.MiR-372 regulates glioma cell proliferation and invasion by directly targeting PHLPP2[J].J Cell Biochem,2015,116(2):225-232.
[40]Lv S,Sun B,Dai C.The Downregulation of MicroRNA-146a Modulates TGF-β Signaling Pathways Activity in Glioblastoma[J].Mol Neurobiol,2014.[Epub ahead of print]
[41]Zhang Y,Chao T,Li R,et al.MicroRNA-128 inhibits glioma cells proliferation by targeting transcription factor E2F3a[J].J Mol Med,2009,87(1):43-51.
[42]Godlewski J,Nowicki MO,Bronisz A,et al.Targeting of the Bmi-1 oncogene/stem cell renewal factor by microRNA-128 inhibits glioma proliferation and self-renewal[J].Cancer Res,2008,68(22):9125-9130.
[43]Papagiannakopoulos T,Friedmann-Morvinski D,Neveu P,et al.Pro-neural miR-128 is a glioma tumor suppressor that targets mitogenic kinases[J].Oncogene,2012,31(15):1884-1895.
[44]Peruzzi P,Bronisz A,Nowicki MO,et al.MicroRNA-128 coordinately targets Polycomb Repressor Complexes in glioma stem cells[J].Neuro-Oncology,2013,15(9):1212-1224.
[45]Dong Q,Cai N,Tao T,et al.An xis Involving SNAI1,microRN A-128 and SP1 Modulates Glioma Progression[J].PLoS One.,2014,9(6):e98651.
[46]Liu Z,Jiang Z,Huang J,et al.miR-7 inhibits glioblastoma growth by simultaneously interfering with the PI3K/ATK and Raf/MEK/ERK pathways[J].Int J Oncol,2014,44(5):1571-1580.
[47]Liu Z,Liu Y,Li L,et al.MiR-7-5p is frequently downregulated in glioblastoma microvasculature and inhibits vascular endothelial cell proliferation by targeting RAF1[J].Tumour Biol,2014,35(10):10177-10184.
[48]Xia H,Yan Y,Hu M,et al.MiR-218 sensitizes glioma cells to apoptosis and inhibits tumorigenicity by regulating ECOP-mediated suppression of NF-kβ activity[J].Neuro Oncol,2013,15(4):413-422.
[49]Liu Y,Yan W,Zhang W,et al.MiR-218 reverses high invasiveness of glioblastoma cells by targeting the oncogenic transcription factor LEF1[J].Oncol Rep,2012,28(3):1013-1021.
[50]Tu YY,Gao XC,Li G,et al.MicroRNA-218 Inhibits Glioma Invasion,Migration,Proliferation,and Cancer Stem-like Cell Self-Renewal by Targeting the Polycomb Group GeneBmi1[J].CancerRes,2013,73(19):6046-6055.
[51]Shi L,Cheng Z,Zhang J,et al.has-mir-181a and hsa-mir-181b function as tumor suppressors in human glioma cells[J].Brain Res,2008,1236:185-193.
[52]Gong A,Ge N,Yao W,et al.Aplysin enhances temozolomide sensitivity in glioma cells by increasing miR?181 level[J].Cancer Chemother Pharmacol,2014,74(3):531-538.
[53]Wang F,Sun JY,Zhu YH,et al.MicroRNA-181 inhibits glioma cell proliferation by targeting cyclin B1[J].Mol Med Rep,2014,10(4):2160-2164.
[54]Du W,Liu X,Chen L.et al.Targeting the SMO oncogene by miR-326 inhibits glioma biological behaviors and stemness[J].Neuro Oncol,2014.[Epub ahead of print]
[55]Lu J,Getz G,Miska EA,et al.MicroRNA expression profiles classify human cancers[J].Nature,2005,435(7043):834-838.
[56]Bloomston M,Frankel WL,Petrocca F,et al.MicroRNA expression patterns to differentiate pancreatic adenocarcinoma from normal pancreas and chronic pancreatitis[J].JAMA,2007,297(17):1901-198.
[57]Wong ST,Zhang XQ,Zhuang JT,et al.MicroRNA-21 Inhibition Enhances In VitroChemosensitivity of Temozolomide-resistant Glioblastoma Cells[J].Anticancer Res,2012,32(7):2835-2841.
[58]Griveau A,Bejaud J,Anthiya S,et al.Silencing of miR-21 by locked nucleic acid-lipid nanocapsule complexes sensitize human glioblastoma cells to radiation-induced cell death[J].Int J Pharm.2013,454(2):765-774.
《实用医学杂志》2015年征订启事
《实用医学杂志》创刊于 1972年,是由广东省卫生厅和计划生育委员会主管、广东省医学学术交流中心(广东省医学情报研究所)主办的全国性综合性医学学术类期刊.本刊以临床实用为基础,提高与普及相结合,主要报道全国各地各级临床医生及医学科研工作者的最新研究成果、实用性较强的临床经验、医学新技术、新动态等,旨在加强国内外医学学术的传播,给广大医务人员提供更广阔的学习和交流的平台,推动学术进步.本刊以各级医药卫生技术人员为主要读者对象,向国内外公开发行.
本刊为综合性医药卫生类核心期刊(中文核心期刊)、中国科技核心期刊(中国科技论文统计源期刊)、第2届中国精品科技期刊(2011年评出,全国仅300家杂志入选)、RCCSE中国核心学术期刊、广东省第二、三、四届优秀科技期刊、美国《化学文摘》(CA)收录期刊、美国《化学文摘》(CA)“期刊千种表”收录期刊、世界卫生组织西太平洋地区医学索引(WPRIM)收录期刊、中国学术期刊综合评价数据库来源期刊、中国学术期刊网数据库入选期刊、国家科技部万方数据库入选期刊、中国生物医学文献数据库入选期刊、中国生物医学现刊目次数据库入选期刊、中国学术期刊光盘版数据库入选期刊.
本刊设有指南解读、述评、专家论坛、专题笔谈、专题报道、临床新进展、基础研究、临床研究、临床总结、循证医学、药物与临床、检验与临床、调查研究、误诊分析、中医中药、临床护理、综述、医院管理、经验交流、病例报告、临床病例讨论等栏目.本刊对符合以下条件的论文给予优先审稿、发表:(1)受国家或部、省级以上基金资助的论文;(2)重点攻关项目的论文;(3)报道的内容属国内外领先水平的论文;(4)有重要指导意义或发表后具有广泛应用价值的论文.热忱欢迎全国各地医药卫生工作者踊跃向本刊投稿.
本刊为半月刊,大16开.国际刊号:ISSN 1006-5725,国内刊号:CN 44-1193/R.每期定价10元,全年定价240元,邮发代号46-44.欢迎广大医务工作者到各地邮局订阅,也可直接向编辑部汇款订阅.汇款地址:广州市越秀区惠福西路进步里2号之6《实用医学杂志》编辑部(邮编:510180),收款人:《实用医学杂志》编辑部.联系电话:(020)81866302,传真:(020)81866302,E-mail:syyxzz@syyxzz.com,投稿及查询网址:http//www.syyxzz.com/.
A systematic review of microRNAs and the therapeutic potential in glioma
LIU Nan1,TU Yan-Yang1,ZHANG Yong-Sheng21Department of Experimental Surgery,2Tangdu Hospital,Fourth Military Medical University,Xi'an 710038,China
MicroRNAs(miRNA)are short non-coding RNAs,and the discovery of miRNA has provided a novel idea to the research of tumor pathogenesis,and a new strategy to the diagnosis and prognosis of human cancers.Currently,numerous studies have indicated that the deregulation of miRNAs in glioma is closely related to glioma pathogenesis and progress.Glioma is the most frequent and malignant brain tumor,which was classified five grades(I-IV)according to WHO,and each level includes various pathological subtypes.miRNAs function as key regulator of glioma through negative control the target gene expression,and could decrease the key regulator level by targeting the 3′-UTR of it's mRNA which regulates the cell proliferation,apoptosis and prognosis of glioma.Moreover,the radiation and chemotherapy resistance in glioma therapy are also effected by deregulation of miRNAs,which suggested that miRNAs would act as tumor suppressor or oncogene in glioma,and it can be used as a biomarker of glioma diagnose and therapy,but also a novel target of glioma gene therapy.In this review,we summarize the current finding of miRNAs which is deregulated in glioma and discuss the molecular diagnostic and therapeutic potential of miRNAs in glioma.
microRNAs;glioma;molecular therapy
R739.41
A
2095-6894(2015)02-005-09
2015-01-15;接受日期:2015-01-30
刘 楠.硕士.研究方向:胶质瘤基因治疗.Tel:029-84778169 E-mail:516395838@qq.com.
张永生.E-mail:zhangys_td@163.com

