多次交配对雌性蛾类生殖适应性影响的Meta 分析
张诗语,曾菊平,吴先福,彭龙慧,刘兴平
(江西农业大学林学院,南昌 330045)
鳞翅目为昆虫纲的第二大目,全世界已知种类约20 万种,其中蛾类是该目中最大的多数为农林害虫的类群。相对其它昆虫种类而言,蛾类具有寿命短,成虫交配频率少等特点,近年来常常被用于开展昆虫交配策略、精子竞争、性别选择及其进化等方面的研究。此外,蛾类在生殖过程中主要依赖嗅觉作用利用性信息素进行配偶定位、识别和交配等过程(Foster and Ayers,1996),开发对环境友好型的合成性信息素并通过交配干扰(mating disruption)的方式直接应用于防治实践的相关研究也成为当前的热点(孟宪佐,2000;Mori and Evenden,2012)。因而全面调查和了解蛾类昆虫的交配策略及其生殖适应性,在理论研究上有助于丰富我们对蛾类昆虫交配行为和配偶选择的全面理解,在应用实践中为监测和评估行为调控措施对蛾类昆虫的生态治理提供基本信息。
对于行两性生殖的昆虫而言,不同的昆虫种类在进化过程中能够选择合适的交配策略以确保其获得最大的繁殖成功和自身及后代的适应性并形成独特的交配系统。昆虫的交配系统通常包括单配制(或称一雌一雄制Monogamy,是指雌虫一生仅与一个雄性配偶交配)、多配制(包括一雄多雌制Polygyny 和一雌多雄制Polyandry,是指雄虫或雌虫一生能与多个配偶交配)和滥交制(Promiscuity,即雌雄虫均能与多个配偶交配)三种典型的交配策略(Thornhill and Alcock,1984)。传统的性别选择理论认为昆虫雌雄间的交配策略存在明显的差异。雄虫的生殖成功通常受到与之交配的雌虫数量的限制,因而最佳的雄虫交配策略是通过获得尽可能多的配偶来扩大其生殖利益,而雌虫的生殖利益则受到交配时雄虫所转移的物质资源的限制,通常认为一次或少数几次交配就足于获得最大的生殖利益(Trivers,1972;Jennions and Kokko,2010)。然而最近几十年来对昆虫的实例研究发现,许多种类的雌虫在一个生殖季节里能够发生多次交配行为 (Arnqvist and Nilsson,2000)。当前已有许多学者通过理论和实例研究探讨了雌虫多次交配行为所获得的利益和代价(Arnqvist and Nilsson,2000;刘兴平等,2008;Slatyer et al.,2012)。现有的研究表明雌性蛾类同样具有单配制和多配制两种交配策略且两种交配策略的雌蛾在一个生殖季节里均能发生多次交配行为(Drummond 1984;表1)。然而,对于蛾类的多次交配行为带来哪些生殖适应性利益,以及多次交配行为所带来的利益在不同交配策略的蛾类之间是否有差异等等问题目前还没有确切的答案,有些研究认为多次交配行为对蛾类的生殖适应性具有正相关性,而有些则认为两者呈负相关甚至没有影响(见表1)。
为了更为明确地了解多次交配行为对蛾类生殖适应性的影响,本文通过搜集国内外有关蛾类昆虫的交配策略对雌虫生殖适应性影响的实例研究性文献,利用当前在医学、社会学和生态学等领域得到广泛应用的Meta 分析方法,分析比较了不同交配策略的蛾类中多次交配行为的作用,旨在评价多次交配行为是否会影响蛾类昆虫的雌性产卵量、卵的孵化率和雌蛾寿命等生殖适应性参数,以及多次交配行为对不同的交配策略的蛾类的影响是否存在差异,从而提供蛾类多次交配与雌虫生殖适应性关系的综合定量估计,为鳞翅目蛾类的生殖行为生态学研究和该类害虫的生态防控提供理论依据。
1 材料与方法
1.1 文献检索及筛选标准
利用国内外网络数据库CNKI、Black-Willy、Springer、Web of Science、Google scholar 等,设定关键词(多次交配、重复交配、一雌多雄、适应性、产卵量、孵化率、寿命、(螟)蛾类等),采用检索和回溯检索相结合方法,检索鳞翅目蛾类昆虫有关多次交配试验的中英文文献,检索年限至2015年。在进行数据提取之前,对所有收集到的文献资料进行再次评价,符合以下条件者视为有效文献:1)文献必须是实例研究资料,即针对某一种蛾类昆虫的多次交配行为的实验研究;2)研究报道中必须具备对照组(交配1 次)和实验组(交配2 次或以上);3)数据资料中应至少包含多次交配对蛾类某一种生殖适应性参数(如产卵量、孵化率或寿命等)的影响;4)文献资料的数据应是具体的数值(包括图表),数据包含平均值和标准差(或标准误);5)具有重复报道的数据只选用其中一篇。根据以上标准,本文选取了相关文献共24 篇作为再分析的对象,共涉及8 科的25 种蛾类(表1)。
1.2 蛾类交配策略的界定
目前对昆虫交配策略所属类型的界定主要有两种,一是Arnqvist 等 (2000)和McNamara 等(2008)根据雌虫的交配频率来界定其交配策略,他们认为一个种群中如果雌虫平均交配次数低于1.5 次,则这一种类属单配制交配策略,而高于这个阈值则为多配制的交配策略。二是Torres-Vila 等(2004)根据雌虫的多次交配的比例来划分交配策略,即种群中多次交配的比例<40%时为单配制交配策略,而当多次交配的比例>40%时为多配制交配策略。本文同时以这两种标准来区分雌性蛾类的交配策略。
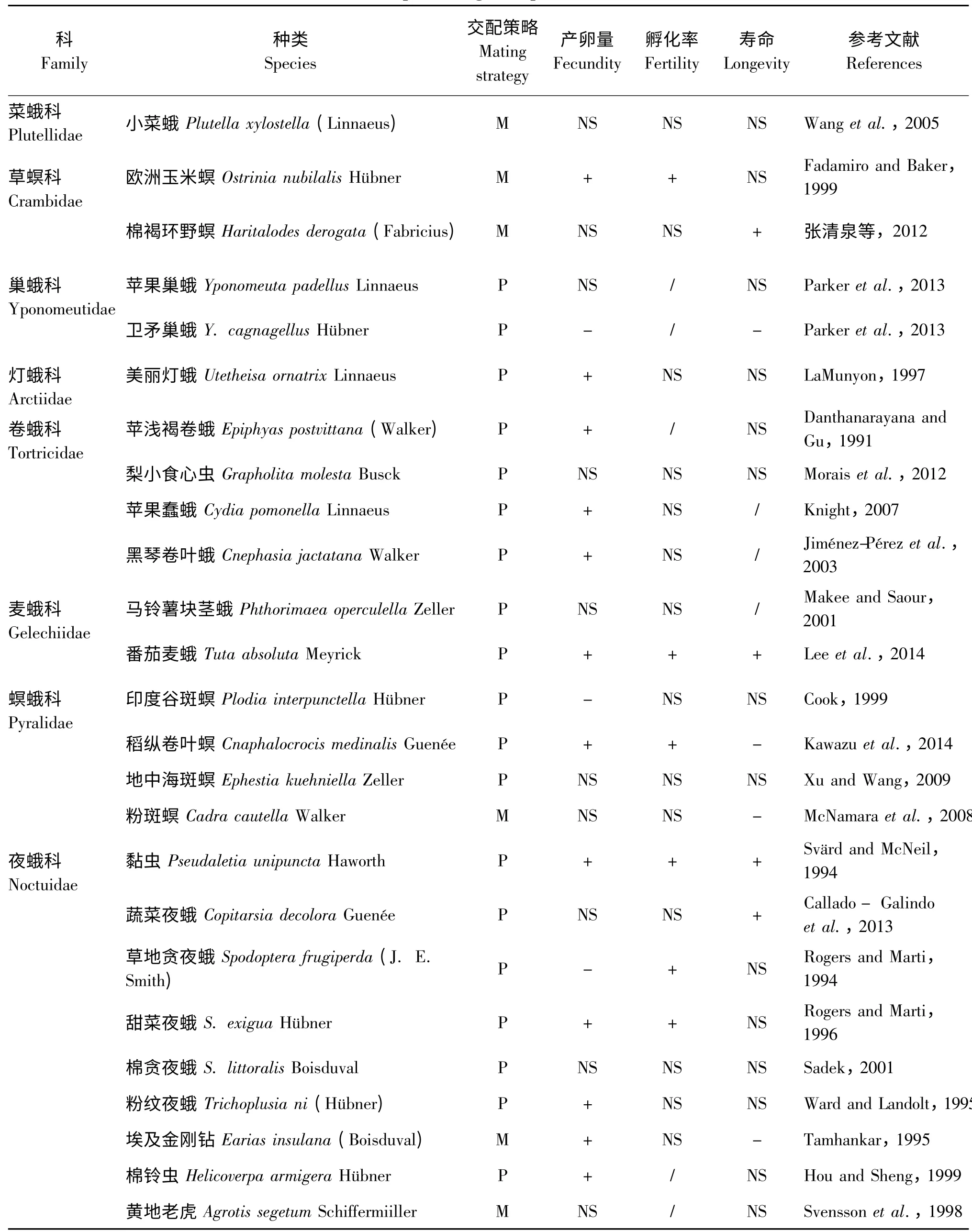
表1 多次交配对雌性蛾类的生殖适应性的影响Table 1 The effect of multiple mating on reproductive fitness in female moths
1.3 Meta 分析统计方法
1.3.1 数据提取
衡量昆虫生殖适应性的指标众多,本研究通过对已有文献资料结果的归纳总结,选取了雌蛾总产卵量、卵的孵化率和雌蛾寿命等作为反映雌蛾生殖适应性的3个指标。人工摘录文献中交配频率和生殖适应性参数的数据结果,包括该虫的交配策略、实验样本量(n)、平均值(M)、标准误(SE)或标准差(SD)和统计量(P 值)等。为了分析蛾类昆虫多次交配的利益与代价,将各篇文献中交配一次的实验处理设为对照组,交配2 次或以上设为实验组。若文献中含有多个多次交配的处理(即交配2 次、3 次或更多次),则将这些处理中的平均值和标准误或标准差进行加权处理从而获得多次交配处理组的平均值或标准差并作为实验组。在少数文献中,仅提供了总的样本量,我们则将总样本量一分为二平分到处理组和对照组中。如果原文有表格且已给出样本数量、平均值和标准误(或标准差),则直接抄录;如果为图形,则通过图像处理方法进行数字化转换,得到相应的交配频率-适应性参数的数据。
1.3.2 数据分析方法
本文所有的数据利用Excel 和Review Manager 5.2软件进行统计分析。首先,我们采用Torres-Vila和Jennions (2004)的方法,将提取到的各篇文献中实验组或对照组的均值和标准差,利用Excel 统计每篇文献中相应参数的效应值(以Hedge's d 表示)和方差(以Var (d)表示)。具体计算公式如下:
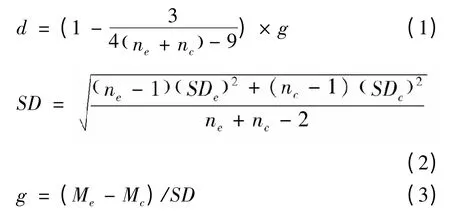
式中,Me,Mc分别为一个独立研究中实验组和对照组的平均值。SDe,SDc分别为实验组和对照组的标准差,ne,nc分别为实验组和对照组的样本量。
其方差为:

其次,利用Review Manager 5.2 统计各参数的合并效应值和95%置信区间,并进行异质性检验和合并效应值的Z 检验。异质性检验值的计算方法通常采用以下公式:
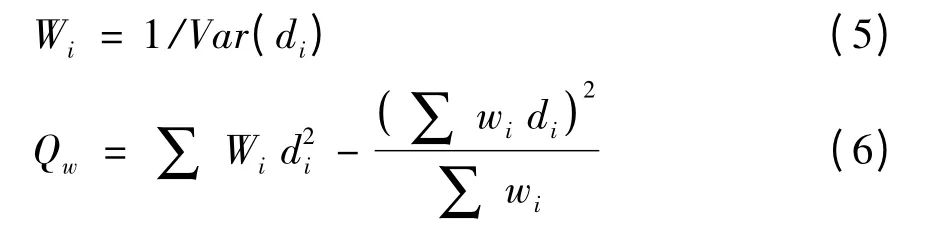
式中,di为每项研究的效应值,Wi为每项研究的权重,Qw为异质性检验值,Qw服从自由度df为总研究数减去1的卡方(χ2)分布。若异质性检验结果为P >0.10 时,多个研究具有同质性,可选择固定效应模型;若多个研究结果为P≤0.10时,多个研究不具有同质性,可选择随机效应模型。若置信区间在0 至1 之间则说明多次交配对测定参数具有明显的正相关性,若置信区间在-1 至0 之间则说明多次交配对测定参数具有明显的负相关性,否则两者之间不存在相关性。
2 结果与分析
2.1 多次交配对雌蛾产卵量的影响
对25 种多配制蛾类的分析发现,有21 种雌性蛾类多次交配后导致产卵量的增加,其中48%的种类多次交配与产卵量之间呈明显的正相关关系,而只有8%的种类存在负相关关系。对所有蛾类多次交配和产卵量的关系进行Meta 分析,结果如表2 所示,多次交配明显增加了雌蛾的产卵量(d=0.42;95%CI:0.32~0.51)。效应值检验结果表明多次交配对蛾类产卵量具有正相关性(Z=8.77,P<0.00001)。比较两种交配策略的多次交配对产卵量的影响发现(表2,图1A),19 种多配制雌蛾经多次交配后产卵量明显增加 (d=0.45,95% CI:0.35~0.56),6 种单配制蛾类的多次交配也导致产卵量的增加但未显示差异(d=0.18,95% CI:-0.07~0.42)。效应值检验同样表明,多次交配与多配制蛾类的产卵量呈正相关性(Qw=131.72,df=18;Z=8.89,P<0.00001),而对单配制蛾类的产卵量没有影响(Qw=23.82,df=5;Z=1.42,P=0.16)。两种交配策略之间的产卵量同样存在明显差异(χ2=4.14,df=1,P=0.04)。
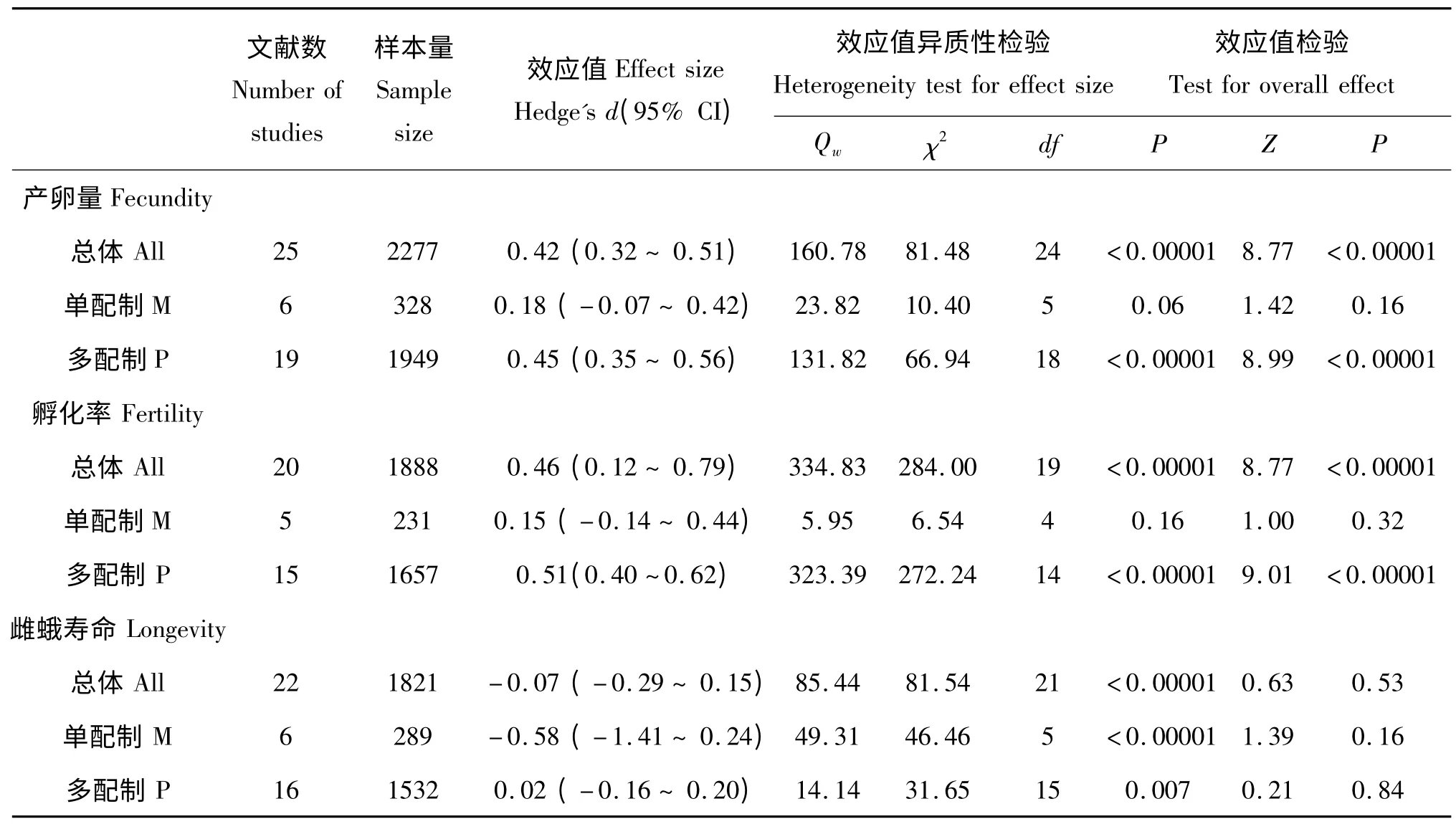
表2 蛾类昆虫多次交配与生殖适应性参数之间相互关系的效应值分析Table 2 Effect size analysis for the relationship between multiple mating and reproductive output in moths based on random effects models
2.2 多次交配对雌蛾卵孵化率的影响
对20 种蛾类的统计发现75%的雌蛾多次交配后导致孵化率的增加,其中30%的种类多次交配后孵化率显著增加,合并效应值d为0.46 (95%CI:0.12~0.79)。效应值检验结果表明多次交配对蛾类孵化率存在明显的正相关关系(Z=8.77,P<0.00001,表2)。进一步对两种交配策略蛾类的多次交配结果表明(表2,图1B),多次交配明显增加多配制种类的孵化率(d=0.51,95% CI:0.40~0.62;Z=9.01,P<0.00001),而多次交配虽然导致单配制种类的卵孵化率增加,但没有明显差异(d=0.15,95% CI:-0.14~0.44;Z=1.00,P=0.32)。两种交配策略之间的卵孵化率同样存在明显差异(χ2=5.21,df=1,P=0.02)。
2.3 多次交配对雌性蛾类寿命的影响
对参与统计的22 种蛾类进行分析表明,只有18.18%的种类导致多次交配后导致寿命显著延长,而59.09%的种类多次交配后导致寿命缩短。多次交配与雌蛾寿命关系的Meta 分析结果如表2所示,合并效应值d为-0.07 (95%CI:-0.29~0.15),说明多次交配导致雌虫寿命降低,但效应值检验结果表明多次交配并未显著影响雌虫寿命(Z=0.63,P=0.53)。然而,进一步分析两种不同交配策略的蛾类的多次交配发现 (表2,图1C),多次交配行为导致多配制雌蛾寿命的增加但没有明显差异(d=0.02,95% CI:-0.16~0.20;Z=0.21,P=0.84),而导致单配制雌蛾寿命的降低但也不存在明显差异(d=-0.58,95%CI:-1.41~0.24;Z=1.39,P=0.16)。两种交配策略之间的雌蛾寿命同样不存在明显差异(χ2=1.98,df=1,P=0.16)。
3 结论与讨论
基于对当前有关多次交配对蛾类生殖适应性影响的文献进行Meta 分析,结果表明雌蛾的多次交配明显增加了雌蛾的产卵量和卵的孵化率,而导致寿命的下降。然而,多次交配对两种不同交配策略蛾类的生殖适应性具有不同的影响,其中多次交配导致多配制蛾类产卵量和卵的孵化率明显的增加,寿命延长但没有显著差异;而对单配制蛾类而言,多次交配对雌蛾相应的适应性参数均没有明显的影响(表2,图1)。
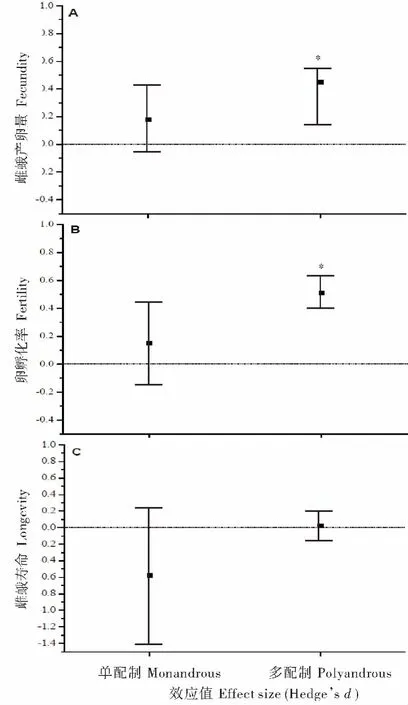
图1 多次交配对两种交配策略的雌蛾产卵量(A),卵孵化率(B)和雌蛾寿命(C)的影响Fig.1 The effect of multiple mating on female fecundity (A),fertility (B)and longevity (C)in two types of mating strategy of moth species
当前有3 种主要的假说来解释昆虫的多次交配行为。第一,多次交配行为导致雌虫获得了更多的由雄虫转移给雌虫的资源,从而提高了雌虫的产卵量,或卵的孵化率,或延长了雌虫寿命。Arnqvist and Nilsson (2000)对122 篇研究性文献中78 种昆虫种类的分析表明,在一些具有营养性婚食的种类中,多次交配的雌虫明显产更多的后代,但在一些没有提供营养性婚食的种类中多次交配却导致雌虫产卵量和孵化率的降低。第二种解释是多次交配可能是雌虫的一种“便利性交配”的策略,这种策略主要是因为雌虫接受一次交配比阻止一次交配要花费更少的代价。在这种情况下,雌虫的多次交配可能并没有获得产卵量或孵化率的利益(Arnqvist et al.,2005)。第三种解释是雌虫的多次交配行为获得了基因利益,多次交配通过精子竞争为雌虫提供了交配后配偶选择的机会,以此提高后代的基因多样性(Tregenza and Wedell,2002)。然而,Svärd and McNeil (1994)通过实例研究证实蛾类的多次交配不太可能增加后代的基因多样性,因为多数情况下蛾类不发生多次交配,就算雌蛾会发生多次交配,随后交尾的雄蛾精子在精子竞争中并不存在优势。
对于蛾类昆虫来说,多次交配对两种不同交配策略的蛾类的生殖适应性具有明显不同的影响。本文的分析表明,多次交配导致多配制蛾类产卵量和卵孵化率的明显增加,而在单配制蛾类中,产卵量和孵化率并不随交配次数的增加而增加(表2,图1A 和B)。Ridley (1988)曾报道了多次交配行为对多配制昆虫产卵量的增加作用明显高于单配制昆虫种类。本文对多次交配与产卵量之间的相关关系的分析与Torres-Vila 等(2004)对41 种鳞翅目种类的Meta 分析结果一致。对于多配制昆虫而言,多次交配和多配制昆虫产卵量和卵孵化率之间的正相关关系可能有以下几种解释:1)多次交配行为使雌蛾获得了更多的使卵受精及刺激产 卵的精 子数量 (Jiménez-Pérez et al.,2003)。多配制蛾类的多次交配行为获得孵化率利益进一步表明精子缺乏是引起蛾类多次交配的一个主要原因,通过多次交配,雌蛾获得足够的精子,从而保证其一生的生殖成功 (Drummond,1984)。2)多次交配行为使雌蛾获得了更多的雄虫在交配过程中转移的营养性物质和其它附腺物质(LaMunyon,1997)。大量的证据表明,鳞翅目昆虫的雄虫在交配过程中转移了大量的除精子之外的营养性物质并贮存在雌虫的精包中,这些营养性物质对雌虫的产卵量具有明显的促进作用,对提高卵的孵化率和为生殖和身体维持贮存能量等具有重要的作用(Ridley,1988;Jiménez-Pérez et al.,2003)。同时,研究表明雄虫在交配过程中随精子转移的附腺分泌物对于增加产卵量也同样具有重要的刺激作用(Fadamiro and Baker,1999)。3)多次交配增加雌蛾的产卵量可能与激素效应有关,来自雄蛾的激素可能通过激素效应诱导卵的形成,从而提高产卵量(Wiklund et al.,1993)。另外,雌蛾的多次交配也可能与雌蛾本身的身体大小和产卵能力相关,身体较大和产卵能力较高的个体更趋于交配多次 (Ward and Landolt,1995)。然而,分析表明,在许多单配制蛾类中,多次交配并没有增加雌蛾的产卵量和卵的孵化率(表2,图1A 和B),说明单配制蛾类的多次交配行为可能没有获得这类由雄蛾转移的营养性物质和其它附腺物质。因而,单配制蛾类的多次交配行为不能用已有的多次交配的利益来解释。通常,雌虫在一次交配后能使其生殖产量达到最大,显然精子补充也不是这类雌蛾多次交配的真正原因。雌蛾维持单配制交配策略的原因被认为是通过两个互不排斥的过程产生的,首先,单配制蛾类一次交配就足于孵育所有的卵,因而选择一个较低的交配频率可以降低交配所带来的代价 (Ward and Landolt,1995)。其次,单配制蛾类可能是雄虫强迫的行为导致雌虫机械性地或生理性地阻止重复交配,如有些蛾类的雄虫为了确保拥有自己的后代产生而在交配完成后形成“交配栓”以阻止其它雄蛾对该雌蛾的交配,这可能是由于性别对抗演变的结果(Arnqvist and Rowe,2005)。另外,单配制蛾类中少部分个体出现多次交配更多的原因可能是由于交配或受精失败所致(Drummond,1984)。
对22 种蛾类的分析表明,未交配的雌蛾比已交配的雌蛾存活更久,而单次交配的雌蛾又比多次交配的雌蛾寿命更长。我们的分析结果表明尽管多次交配对两类交配策略的雌蛾寿命没有明显的影响,但多次交配趋于降低单配制雌蛾的寿命而延长多配制雌蛾的寿命(表2,图1C)。多次交配导致雌蛾寿命降低的主要原因可能归结为产卵和身体代谢消耗了大量的能量和营养(Fadamiro and Baker,1999)。雌蛾在生殖期间的各种生殖行为过程,如信息素的产生、求偶、交配和产卵等过程需要消耗大量的能量,因而可供身体维持的资源将减少(Hou and Sheng,1999)。多配制雌性蛾类在成虫期更能通过多次交配获得雄虫提供的营养物质,或自身从体外摄食水分或一些营养性含糖量物质,因而可以明显改善和补充生殖期间的资源消耗,而不至于导致寿命降低甚至有可能延长寿命,但单配制蛾类的多次交配可能未获得雄虫在交配期间传递的营养,从而降低雌虫的生理条件而导致寿命缩短。
不同于以往的综述性文章,Meta 分析提供了一个客观的方法,通过实例研究来总结多次交配为雌性蛾类带来的利益和代价。然而,当前筛选出来的符合分析条件的文献数量非常有限。另外,当前众多的研究表明,雌蛾的交配频率可能随配偶的大小、日龄和交配经历等发生变化(Michereff et al.,2004)。因而需要利用更多的蛾类昆虫作为研究材料开展多次交配行为的研究,这样才能更为精确地反映两种交配策略的蛾类进行多次交配的原因及其适应性意义。
References)
Arnqvist G,Edvardsson M,Friberg U,et al.Sexual conflict promotes speciation in insects [J].P.Natl.Acad.Sci.USA,2000,97 (19):10460-10464.
Arnqvist G,Rowe L.Sexual Conflict [M].Princeton,NJ:Princeton University Press,2005.
Arnqvist G,Nilsson T.The evolution of polyandry:Multiple mating and female fitness in insects [J].Anim.Behav.,2000,60 (2):145-164.
Arnqvist G,Nilsson T,Katvala M.Mating rate and fitness in female bean weevils [J].Behav.Ecol.,2005,16 (1):123-127.
Callado GMM,Villa-Ayala P,Castrejón AF,et al.Effect of age,body weight and multiple mating on Copitarsia decolora (Lepidoptera:Noctuidae)reproductive potential and longevity [J].J.Insect Behav.,2013,26 (6):860-872.
Cook PA.Sperm numbers and female fertility in the mothPlodia interpunctella (Hubner)(Lepidoptera:Pyralidae) [J].J.Insect Behav.,1999,12 (6):767-779.
Danthanarayana W,Gu H.Multiple mating and its effect on the reproductive success of female Epiphyas postvittana (Lepidoptera:Tortricidae)[J].Ecol.Entomol.,1991,16 (2):169-175.
Drummond BA.Multiple mating and sperm competition in the Lepidoptera.In:Smith RL,ed.Sperm Competition and the Evolution of Animal Mating Systems [M].New York:Academic Press,1984,291-370.
Fadamiro HY,Baker TC.Reproductive performance and longevity of female European corn borer,Ostrinia nubilalis:Effects of multiple mating,delay in mating,and adult feeding [J].J.Insect Physiol.,1999,45 (4):385-392.
Foster SP,Ayers RH.Multiple mating and its effects in thelightbrown apple moth,Epiphyas postvittana (Walker)[J].J.Insect Physiol.,1996,42 (7):657-667.
Hou ML,Sheng CF.Fecundity and longevity of Helicoverpa armigera(Lepidoptera:Noctuidae):Effects of multiple mating [J].J.Econ.Entomol.,1999,92 (3):569-573.
Jennions MD,Kokko H.Sexual selection.In:Westneat DF,Foz CW,eds.Evolutionary Behavioral Ecology [M].Oxford:Oxford University Press,2010,343-364.
Jiménez-Pérez A,Wang Q,Markwick N.Remating behavior of Cnephasia jactatana Walker females (Lepidoptera:Tortricidae)[J].J.Insect Behav.,2003,16 (6):797-809.
Kawazu K,Shintani Y,Tatsuki S.Effect of multiple mating on the reproductive performance of the rice leaffolder moth,Cnaphalocrocis medinalis (Lepidoptera:Crambidae)[J].Appl.Entomol.Zool.,2014,49 (4):519-524.
Knight AL.Multiple mating of male and female codling moth(Lepidoptera:Tortricidae)in apple orchards treated with sex pheromone [J].Environ.Entomol.,2007,36 (1):157-164.
LaMunyon CW.Increased fecundity,as a function of multiple mating in an arctiid moth,Uteheisa ornatrix [J].Ecol.Entomol.,1997,22 (1):69-73.
Lee MS,Albajes R,Eizaguirre M.Mating behaviour of female Tuta absoluta (Lepidoptera:Gelechiidae):Polyandry increases reproductive output [J].J.Pest Sci.,2014,87 (3):429-439.
Liu XP,Peng JH,He HM,et al.The effect of multiple mating on fitness in insects [J].Acta Agriculturae Universitatis Jiangxiens,2008,30 (4):592-600.[刘兴平,彭接辉,何海敏,等.多次交配对昆虫适应性的影响[J].江西农业大学学报,2008,30 (4):592-600]
Makee H,Saour G.Factors influencing mating success,mating frequency,and fecundity in Phthorimaea operculella (Lepidoptera:Gelechiidae)[J].Environ.Entomol.,2001,30 (1):31-36.
McNamara KB,Elgar MA,Jones TM.A longevity cost of re-mating but no benefits of polyandry in the almond moth,Cadra cautella [J].Behav.Ecol.Sociobiol.,2008,62 (9):1433-1440.
Meng XZ.Progress of the research and application of insect pheromones in China [J].Entomological Knowledge,2000,37 (2):75-84.[孟宪佐.我国昆虫信息素研究与应用的进展[J].昆虫知识,2000,37 (2):75-84]
Michereff MFF,Vilela EF,Filho MM,et al.Effects of delayed mating and male mating history on the reproductive potential of Leucoptera coffeella (Lepidoptera:Lyonetiidae) [J].Agr.Forest Entomol.,2004,6 (3):241-247.
Morais RM,Redaelli LR,Sant AJ.Age and multiple mating effects on reproductive success of Grapholita molesta (Busck)(Lepidoptera,Tortricidae)[J].Rev.Bras.Entomol.,2012,56 (3):319-324.
Mori BA,Evenden ML.When mating disruption does not disrupt mating:fitness consequences of delayed mating in moths [J].Entomol.Exp.Appl.,2012,146 (1):50-65.
Parker K,Roessingh P,Menken SBJ.Do female life span and fecundity of small ermine moth increase with multiple mating and adult nutrition?[J].J.Insect Behav.,2013,26 (3):416-427.
Ridley M.Mating frequency and fecundity ininsects [J].Biol.Rev.,1988,63 (4):509-549.
Rogers CE,Marti OG.Reproductive potential of once-mated moths of the fall armyworm(Lepidoptera:Noctuidae)[J].Fla.Entomol.,1994,77 (4):402-410.
Rogers CE,Marti OG.Beet armyworm (Lepidoptera:Noctuidae):effects of age at first mating on reproductive potential [J].Fla.Entomol.,1996,79 (3):343-352.
Sadek MM.Polyandry in field-collected Spodoptera littoralis moths and laboratory assessment of the effects of male mating history [J].Entomol.Exp.Appl.,2001,98 (2):165-172.
Slatyer RA,Mautz BS,Backwell PRY,et al.Estimating genetic benefits of polyandry from experimental studies:A meta-analysis [J].Biol.Rev.,2012,87 (1):1-33.
Svärd L,McNeil JN.Female benefit,male risk:Polyandry in the true armyworm Pseudaletia unipuncta [J].Behav.Ecol.Sociobiol.,1994,35 (5):319-326.
Svensson MGE,Marling E,Löfqvist J.Mating behavior and reproductive potential in the turnip moth Agrotis segetum (Lepidoptera:Noctuidae)[J].J.Insect Behav.,1998,11 (3):343-359.
Tamhankar AJ.Host influence on mating behavior and spermatophore reception correlated with reproductive output and longevity of female Earias insulana (Boisduval)(Lepidoptera:Noctuidae) [J].J.Insect.Behav.,1995,8 (4):499-511.
Thornhill R,Alcock J.The Evolution of Insect Mating Systems [D].Cambridge,MA:Harvard University Press.
Torres-Vila LM,Rodriguez-Molina MC,Jennions MD.Polyandry and fecundity in the Lepidoptera:Can methodological and conceptual approaches bias outcomes?[J].Behav.Ecol.Sociobiol.,2004,55(4):315-324.
Tregenza T,Wedell N.Polyandrous females avoid costs of inbreeding[J].Nature,2002,415:71-73.
Trivers RL.Parental investment and sexual selection.In:Campbell B,ed.Sexual Selection and the Descent of Man [M].London:Heinemann,1972,136-179.
Wang XP,Fang YL,Zhang ZN.Effect of male and female multiple mating on the fecundity,fertility,and longevity of diamondback moth,Plutella xylostella (L.) [J].J.Appl.Entomol.,2005,129 (1):39-42.
Ward KE,Landolt PJ.Influence of multiple matings on fecundity and longevity of female cabbage looper moths (Lepidoptera:Noctuidae)[J].Ann.Entomol.Soc.Am.,1995,88 (6):768-772.
Wiklund C,Kaitala A,Lindors V,et al.Polyandry and its effect on female reproduction in the green veined butterfly (Pieris napi L.)[J].Behav.Ecol.Sociobiol.,1993,33 (1):25-33.
Xu J,Wang Q.A polyandrous female moth discriminates against previous mates to gain geneticdiversity [J].Anim.Behav.,2009,78 (6):1309-1315.
Zhang QQ,Zhang XL,Lu W.Effects of adult age and mating status on fecundity of Haritalodes derogate [J].Plant Protection,2012,38 (2):71-74.[张清泉,张雪丽,陆温.成虫日龄与交配状态对棉褐环野螟繁殖力的影响[J].植物保护,2012,38 (2):71-74]

