青花菜绿雄80游离小孢子培养因素研究
李江渝,俞金龙,2,巫水钦,赵 辉,梁 娟,熊 琴,俞 洋
(1.浙江美之奥种业有限公司,浙江嘉兴 314000;2.金华市农业科学研究院,浙江金华 321000)
青花菜绿雄80游离小孢子培养因素研究
李江渝1,俞金龙1,2,巫水钦1,赵 辉1,梁 娟1,熊 琴1,俞 洋1
(1.浙江美之奥种业有限公司,浙江嘉兴 314000;2.金华市农业科学研究院,浙江金华 321000)
以大田生长的青花菜绿雄80为供试材料,研究影响小孢子培养因素。结果表明,材料在4℃预处理24 h,经B5培养基抽提后,以17%蔗糖的NLN培养基添加0.1 mg·mL-1的AC,33℃热激1 d,放入25℃暗培养,形成细胞团后50 r·min-1振荡培养,可大大提高出胚率。
青花菜;预处理;活性炭;小孢子培养
文献著录格式:李江渝,俞金龙,巫水钦,等.青花菜绿雄80游离小孢子培养因素研究[J].浙江农业科学,2015,56(5):681-684.
DOI 10.16178/j.issn.0528-9017.20150537
自从1982年Lichter在芸薹属植物游离小孢子技术取得突破后,该技术现已在世界范围内被广泛应用。其中以加拿大、英国、瑞典、挪威、日本等多家所获得的成果尤为突出。1988年,Chuong等[1]利用小孢子技术队埃塞俄比亚芥蓝的研究中成功获得了再生植株。Takahat等[2],1991年通过对青花菜和芥蓝等材料的研究,成功地获得了小孢子和再生植株。在国内,由于小孢子技术起步较晚,但发展迅猛,并取得了可喜的成果[3]。李光涛等[4]在对紫菜苔的研究中首次获得了游离小孢子再生植株。虽然在许多材料上已经成功获得了小孢子材料,但其获得频率不高,这一难题逐渐成为人们研究的热点。本研究旨提高青花菜小孢子成胚频率,为青花菜的遗传育种研究提供新的育种手段。
1 材料与方法
1.1 材料
实验于2014年3月至2014年7月在浙江美之奥种业有限公司作物分子设计育种中心进行。供试的绿雄80材料来源于日本时田公司引进品种。
1.2 游离小孢子培养实验方法
1.2.1 培养基
提取液(B5):不含激素的B5培养基(Gamborg etal,1968),13%蔗糖(B5-13),pH值5.80~5.95,121℃高压灭菌。
诱导基本培养基(NLN):购买的商品NLN干粉的培养(Liehter,1982),17%蔗糖(NLN-17) pH值5.85~5.95,0.22 μm滤膜过滤除菌,置4℃冰箱备用。
1.2.2 花蕾大小的选择
采集绿雄80新鲜花蕾,用解剖针挑取花药与载玻片上,于显微镜下DAPI染色镜检,选择单核靠边期至双核早期的花蕾作为试验材料。
1.2.3 小孢子的分离纯化
开花期采集健壮植株上长2~5 mm(小孢子发育处于单核靠边期至双核早期)的花蕾,蒸馏水冲洗3次,经70%乙醇溶液表面消毒30 s,再用2%NaClO溶液灭菌8 min,无菌水洗涤3次,每次5 min。沥干水分后,在B5液体洗涤培养基中用玻璃棒碾压花蕾,挤出小孢子。小孢子悬浮液经孔径40 μm的尼龙网过滤后,800 r·min-1离心5 min;弃上清液,沉淀物加5 mL B5洗涤培养基,摇匀,800 r·min-1离心3 min;弃上清液,所得沉淀物即为纯化小孢子。
1.2.4 小孢子的培养
将纯化后的小孢子加入NLN培养基,在显微镜下镜检并稀释到小孢子浓度为1×105个分装到6 cm的无菌培养皿中,用Parafilm膜封口。在33℃恒温培养箱中热激处理一段时间后,再转至25℃下静置暗培养,待出现肉眼可见的胚状体后,置于摇床上振荡培养。
1.2.5 小孢子胚诱导率研究
影响小孢子成胚的因素很多,本试验从材料预处理、活性炭培养、高温热激时间这几个方面进行了研究。实验按前述方法进行分离纯化悬浮培养,4周后统计胚状体诱导率,胚诱导率以平均每皿产生胚状体数计算。
4℃低温预处理。取生长旺盛的花序放入4℃冰箱处理24,48 h后,按1.2.3节的方法获得游离小孢子,于33℃热激24 h,之后转入25℃暗培养。
热激时间实验。以新鲜材料,分别设4℃冰箱处理24,48 h后,及未低温预处理为对照,按1.2.3节的方法获得游离小孢子,于33℃热激0, 24,30,45,48 h,然后转入25℃暗培养。
活性炭实验。以新鲜材料以及4℃冰箱处理24,48 h,按1.2.3节的方法获得游离小孢子后,分加入不同以下浓度的活性炭0.050,0.075, 0.100,0.150,0.175,0.200 mg·mL-1,于33℃热激24 h,之后转入25℃暗培养。
1.3 胚状体再生植株
胚状体再生植株基本培养基:1)MS+3%蔗糖+0.8%琼脂;2)B5+3%蔗糖+0.8%琼脂。
1.4 再生植株生根实验
以MS添加0.1,0.2,0.3,0.4,0.5 mg·L-1的NAA诱导再生植株生根的影响。
1.5 再生植株倍性检测
将培养基中的小苗移出到室外炼苗后,定植到田间,待新的叶片产生后,取再生植株幼嫩叶片,利用流式细胞仪采用Jaroslav[5]的方法检测其倍性。
2 结果与分析
采用挤压法获得的游离小孢子效率高,且污染率低,选择合适的时期的小孢子是诱导成胚的关键。选择单核靠边期至双核早期的材料,能成功观察到游离小孢子经过处理后有膨大现象(图1和2),其他时期的小孢子则基本无反应。
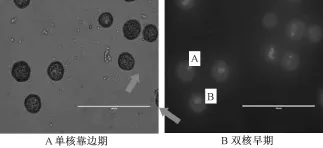
图1 小孢子DAPI染色
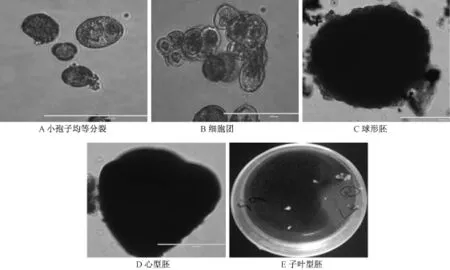
图2 小孢子发育途径
通过对小孢子4℃预处理以及结合热激时间研究,结果(图3)表明,单一通过4℃预处理的小孢子无法形成胚状体,而结合热激24 h后的小孢子材料,能形成少量的胚。这说明热激能够促进小孢子的胚性转化,从而诱导出胚。
通过4℃预处理24 h结合33℃热激处理24 h,然后结合添加活性炭0.1 mg·mL-1,能够形成大量的胚,出胚率达到平均每皿60个(图4)。说明合适浓度的活性炭有利于促进小孢子成胚,提高出胚率。

图3 预处理结合热激处理效果

图4 预处理结合热激添加活性炭处理效果
通过对2种再生培养基的对比,结果(图5)表明:MS+3%蔗糖+0.8%琼脂效果较好,成苗率高,且褐化较少,而B5+3%蔗糖+0.8%琼脂容易褐化,难成苗。这说明MS培养基营养元素比B5效果更好,更适合诱导其再生成苗。

图5 不同培养基诱导胚状体再生成苗
通过不同浓度的NAA诱导再生植株生根,结果(图6)表明,0.3 mg·L-1的NAA生根效果最好,且植株健壮。
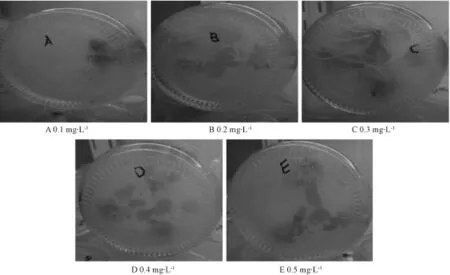
图6 不同浓度NAA诱导生根
通过流式细胞仪对再生植株植物叶片细胞进行倍性鉴定,以正常种子萌发的植株叶片叶肉细胞为对照。结果(图7)表明,测定的60份材料中,其中单倍体材料占10%,四倍体材料占5%,混倍体材料占5%,二倍体材料占80%。检测结果中二倍体材料占的比例大,说明小孢子再培养过程中发生了自然加倍现象,这结果与许多学者研究结果大致一致。
3 小结和讨论
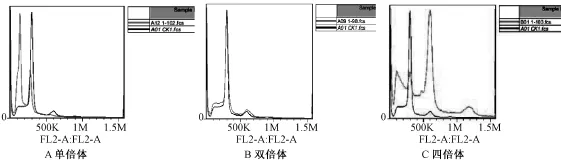
图7 不同倍性青花菜小孢子植株叶片细胞核DNA相对含量曲线
本文在研究游离小孢子培养时,发现花蕾大小的选择是能否成功诱导出小孢子胚的前提条件。选择合适的花蕾(小孢子处于单核靠边期或双核早期),通过预处理后,能明显观察到小孢子膨大。而选择的花蕾过小或者过大,经过预处理后,均不能观察到小孢子有膨大现象。小孢子经热激处理后能否膨大,是小孢子能否分化成胚状体的先决条件[6-9]。通过低温预处理与热激处理结合,可以使本身无法成胚的材料获得少量的胚状体,低温及热激处理能够诱导小孢子的胚性转化,从而诱导成胚,而单一的低温或者热激处理无法形成胚。添加合适浓度的外源活性炭可以大大促进成胚率,而高浓度的活性炭能抑制成胚,这与韩阳等所报道的结果大致相同[10]。通过对再生植株的倍性鉴定,发现大多数为二倍体材料,少数为单倍体、嵌合体及四倍体材料,这很有可能是小孢子培养时发生了自然加倍所导致。与Chen等的研究结果大体一致[11]。青花菜小孢子培养过程中的自然加倍现象,省去了人工加倍步骤,为创制DH系提供了便利,然而其具体是在小孢子培养时期自然加倍,还是在胚状体再生过程中由愈伤组织自然加倍而来的,还有待于进一步研究。
[1] Chuong P V,Deslauriers C,Kott L S.Effects of donor genotype and bud sampling on microspore culture of Brassica napus[J]. Canadian Journal of Botany,1988,66:1653-1654.
[2] Takahata Y,Keller W A.High frequency embryogenesis and plant regeneration in isolated microspore culture of Brassiea oleracea L.[J].Plant Science,1991,74:235-242.
[3] 杨淑琴,娄虹,韩阳.芸薹属蔬菜游离小孢子培养研究进展[J].辽宁大学学报:自然科学版,2005(1):91-94.
[4] 李光涛,李昌功.紫菜蔓游离小抱子培养再生小植株[J].华中农业大学报,1996,22(S0):111-113.
[5] Dolezel J,Lys K M A,Houwe I V D,et al.Use of flow cytometry for rapid ploidy determination in Musa species[J]. InfoMusa,1997,6(1):6-9.
[6] 姜立荣,刘凡,李怀军,等.大白菜小孢子胚状体发生早期的超微结构研究[J].北京农业科学,1996,16(3): 28-31.
[7] Fan Z,ArmstrongKC,KellerW A.Developmentof microspores in vivo and in vitro in Brassica napus L.[J]. Protoplasma,1988,147:191-199.
[8] Telmer C A,Newcomb W,Simmonds D H.Microspore development in Brassica napus and the effect of high temperature on division in vivo and in vitro[J].Protoplasma,1993, 172:154-165.
[9] AioneseiT,TouraevA,Heberle-BorsE.Pathwaysto microspore embryogenesis[C]//Palmer C E,Leller W A, Kashe K J.Haploids in crop improvement-biotechnology in agriculture and forestry[M].Germany:Springer-Verlag, 2005:11-34.
[10] 韩阳,叶雪凌,冯辉.大白菜小孢子培养影响因素研究[J].中国蔬菜,2006,1(7):16-18.
[11] Chen Z Z,Snyder S,Fan Z G,et al.Efficient production of doubled haploid plants through chromosome doubling of isolated microspores in Brassica napes[J].Plant Breeding,1994, 113:217-221.
(责任编辑:张 韵)
S 635
A
0528-9017(2015)05-0681-04
2015-03-27
李江渝(1985-),重庆丰都人,硕士,主要从事十字花科小孢子培养及育种工作,E-mail:182202833@qq.com。

