甘蓝DH系构建技术体系的建立
梁 娟,俞金龙,2,巫水钦,吴佳骅,李江渝,熊 琴,俞 洋
(1.浙江美之奥种业有限公司,浙江嘉兴 314000;2.金华市农业科学研究院,浙江金华 321000)
甘蓝DH系构建技术体系的建立
梁 娟1,俞金龙1,2,巫水钦1,吴佳骅1,李江渝1,熊 琴1,俞 洋1
(1.浙江美之奥种业有限公司,浙江嘉兴 314000;2.金华市农业科学研究院,浙江金华 321000)
以26份不同叶球类型及熟性的杂种1代及自交2代甘蓝为材料,探讨了花蕾长度、甘蓝类型、供体植株生长状况、供体植株花期等因素对甘蓝小孢子胚胎发生的影响,研究了DH植株的田间移栽方案,为建立高效、完善的结球甘蓝DH技术体系提供依据。
甘蓝;DH系;小孢子;胚状体
文献著录格式:梁娟,俞金龙,巫水钦,等.甘蓝DH系构建技术体系的建立[J].浙江农业科学,2015,56(5):669-674.
DOI 10.16178/j.issn.0528-9017.20150533
甘蓝(Brassica oleracea L.var.capitata L.)原产于地中海沿岸,为十字花科芸薹属二年生异花授粉作物,其杂种优势十分明显,杂交种在国内外已普遍应用于生产。近年来,随着小孢子培养技术的不断发展,应用花粉粒培养获得纯合二倍体分离群体即双单倍体(DH)成为可能[1]。甘蓝杂种1代的亲本选育采用游离小孢子培养技术,比传统的自交纯化方法省时3~5年,显著提高了育种效率,缩短了育种周期[2]。国内外学者在结球甘蓝游离小孢子培养技术上已取得了一定进展[3-7]。但小孢子培养的胚胎发生频率、基因型的反应范围仍存在非常大的差异,尤其在目标基因型中难以获得胚状体,这些问题限制了小孢子培养在甘蓝遗传育种和基础研究中的进一步应用。本研究以26个不同品种的甘蓝为试材,对甘蓝小孢子培养过程中影响胚状体产生的几个关键因素及田间移栽配套技术进行探讨。
1 材料与方法
1.1 材料
甘蓝为浙江美之奥种业有限公司甘蓝育种组选育或引进的国内外不同叶球类型及熟性的杂种1代及自交2代,共26个品种,均种植于嘉兴美奥农场基地。于2013年8月播种,9月定植于大田, 12月割球,然后每个品种各选5株移植于营养钵,置于温室大棚。分别于2014年3月下旬至5月下旬进行游离小孢子培养。
1.2 方法
1.2.1 花蕾选取
供试植株抽薹开花后,于晴天上午9:00~11: 00选取主花序和分枝上外形饱满、大小不同的花蕾作为游离小孢子的供体花蕾,装入冰盒带回实验室,于4℃保存备用。测量花蕾长度,并将长度一致的花蕾归类。各类长度花蕾随机选取3~5个压片,显微镜下观察该花蕾小孢子的发育时期,以单核靠边期的长度花蕾为标准选取花蕾游离小孢子。
1.2.2 小孢子游离和培养
将花蕾用75%的酒精消毒30~40 s,然后用2%NaClO消毒15 min(可在摇床上振荡以充分消毒),最后用无菌水清洗3次,每次5 min。
将灭过菌的花蕾放置于50 mL离心管中,加入1~2滴B5液体培养液,用玻璃棒轻轻挤压使花粉散出,再加入10 mL B5溶液,倒入过滤器过滤;花粉滤液转移至无菌离心管(用封口膜封口), 800 r·min-1,离心5 min,弃去上清液,加入B5抽提液再次悬浮离心,重复3次,最后一次用NLN-13培养液清洗。
离心结束,加入5 mL NLN-13培养液制成孢子悬浮液,调整浓度至1.0×105mL-1,随后再把小孢子悬浮液分装于直径60 mm的培养皿中,每皿3 mL,封口膜膜封口,置于32℃恒温培养箱中暗培养1~2 d,然后温度调至25℃继续暗培养,直至形成肉眼可见胚。
1.2.3 胚状体植株再生
出胚培养皿移至恒温摇床,50 r·min-1, 25℃继续暗培养。暗培养25 d左右,将获得的子叶形胚移入固体培养基,在20℃,光照周期16 h光照/8 h黑暗,光照度2 000 lx条件下进行再生苗的诱导培养。
1.2.4 再生植株倍性鉴定和移植
利用流式细胞仪(BD Accuri C6)对获得的再生苗进行倍性检测。染色体加倍植株一般先从组培瓶移栽到装有土壤和蛭石或泥炭的钵中炼苗1~2周,再移植到大田。本研究采用3种定植方式,以便摸索出最适宜的DH植株田间移栽技术。3种种植方式分别为(1)直接定植于露地;(2)铺设地膜,定植于塑料大棚;(3)移植到50 cm×50 cm营养钵中,放置于塑料大棚。
2 结果与分析
2.1 花蕾长度对小孢子出胚率的影响
前期花蕾染色结果表明,大部分品种3~6 mm的花蕾均含有不同比例的单核靠边期小孢子,因此本研究将采集的花蕾混合,按照长度大小归类,分为3个等级:(1)3.0~3.5 mm,(2)3.6~4.5 mm,(3)4.6~5.5 mm(图1和2)。镜检和DAPI染色观察,分别抽提小孢子进行离体培养。

图1 不同大小的花蕾进行归类分级

图2 不同长度花蕾的小孢子发育情况(10倍)
32℃热激培养24 h和48 h后分别观察小孢子变化,然后25℃继续暗培养观察是否有可见的颗粒状胚形成。不同长度花蕾游离小孢子培养结果表明, 4.6~5.5 mm大小的花蕾无论是32℃热激培养24 h还是48 h,小孢子均可见到明显的膨大(图3),且在25℃暗培养5 d时就观察到第1次分裂(图4), 16 d时已形成肉眼可见胚状体,而3.0~3.5 mm和3.6~4.5 mm的花蕾在热激阶段就遇到阻碍,最终没有获得胚状体(图5),这可能和不同长度花蕾小孢子的发育阶段、比例、数量有关系,4.6~5.5 mm长度的花蕾小孢子处在单核中期-双核早期的比例较大且发育一致性较好(图6和7)。
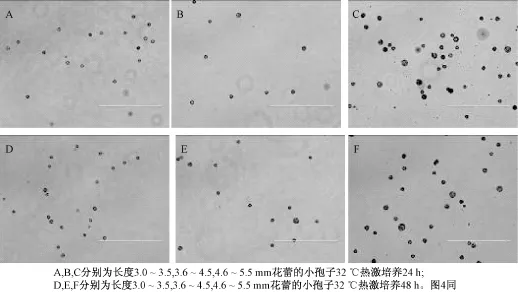
图3 32℃热激培养24 h和48 h后小孢子形态变化

图4 25℃暗培养5 d各处理的小孢子形态变化
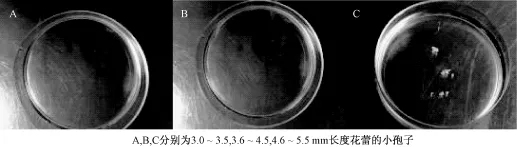
图5 25℃暗培养16 d各处理的小孢子形态变化

图6 4.6~5.5 mm大小的花蕾镜检和DAPI染色观察结果(10倍)
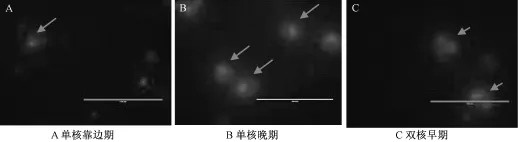
图7 4.6~5.5 mm大小的花蕾所含不同发育时期的小孢子(40倍)
2.2 不同品种甘蓝的小孢子胚胎发生能力比较
从表1可以看出,供试的26份材料中,共有12个基因型产生了胚状体,出胚率为46%,且在这12个基因型中,产胚率存在很大差异。在不同叶球类型甘蓝中,17份圆球类型有8份出胚,出胚概率为47%,每蕾出胚范围在0.41~4.20个; 9份扁球类型中4份获得胚状体,出胚概率为44%,每蕾出胚范围在0.10~0.50。由此可知,不同叶球类型的甘蓝小孢子胚胎发生能力无明显差异。此外,12份早熟甘蓝的出胚率为50%,且每蕾出胚率大于1个的易出胚甘蓝均为中早熟类型甘蓝;11份晚熟甘蓝的出胚率为45%,与早熟甘蓝相比无明显差异,但每蕾成胚率较低,为0.10~0.50,推测甘蓝的熟性及栽培季节与小孢子胚发生能力存在一定的相关性。

表1 不同类型甘蓝诱导形成胚状体结果
2.3 生长环境对小孢子胚胎发生能力影响
从3月21日供体植株进入初花期开始采样进行游离小孢子试验,至5月23日结束,共取样32批次,其中出胚的花蕾采样日期在4月7日至5月13日,出胚材料采样日期及胚状体诱导情况如表2所示。从4月初至5月中旬日平均气温基本维持在20~25℃,之后随着天气转暖,气温逐渐升高达到30℃左右,这可能对小孢子成胚能力产生一定影响。此外,5月10日以后供体植株陆续进入末花期,此时小孢子的活力逐渐衰退,且发育时期不同步。出胚率最高的品种杰出(F2)采样日期在5月8日,小孢子培养获得的胚状体和胚状体诱导再生情况见图8。

表2 已出胚材料采样日期及胚状体诱导情况
2.4 再生植株倍性检测
成活胚状体转移到固体培养基上进行植株再生培养,共获得再生植株233株,采用流式细胞仪测定植株染色体是否加倍。结果表明,共124株单倍体,87株二倍体,17株四倍体以及5株嵌合体,加倍率达到44.6%(表3)。推测愈伤组织诱导成苗阶段发生了染色体自然加倍,且加倍频率较高。

表3 再生植株倍性检测
2.5 再生植株的田间移植
因移植后期遇大幅度降温,3种定植方法中,方法(1)的成活率只有91%,方法(2)和(3)移栽成活率均达到100%(图9)。从成本角度考虑,方法(2)比(3)节省人力、财力,但方法(3)在温肥水分管理上更易灵活操作。
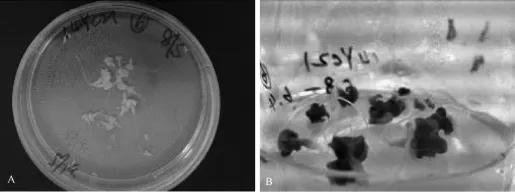
图8 杰出F2小孢子培养获得的胚状体(A)和胚状体诱导再生(B)

图9 DH植株的3种不同移栽方式
3 小结与讨论
本研究对结球甘蓝游离小孢子培养中的几个关键因素进行了初步研究,建立了一套切实可行的甘蓝DH系构建技术体系。
甘蓝小孢子诱导培养中小孢子所处发育时期至关重要,处于单核靠边期的小孢子诱导成胚概率较高[8-9]。研究结果表明,4.6~5.5 mm长度的花蕾小孢子处在单核靠边期的比例较大且发育一致性较好,热激后无论是膨大数量还是分裂的细胞数目都远远高于其他长度的花蕾。不同叶球类型及熟性的甘蓝品种小孢子胚发生能力也有一定差异,可能是受供体植株基因型的影响。
供体植株生长环境和营养条件也对小孢子培养结果有较大影响。张凤兰等[10]研究表明,在长日照(14~18 h)和15~20℃条件下培养的白菜小孢子,胚状体发生数量及植株再生率高于短日照(12 h)和较高温度(25℃)培养的白菜小孢子。方淑桂等[11]认为气温对大白菜小孢子有明显影响,供体植株适宜在10~25℃生长,最高气温超过28℃时小孢子诱导率大大降低。本研究中也观察到类似现象,且能够产胚的花蕾多处于初花期-盛花期,这可能与此期的供体植株营养状况有关,推测花粉母细胞减数分裂时期的光周期、温度和营养条件对小孢子全能性有较大影响。
甘蓝胚状体再生培养中发生的高频自然加倍现象与Chen等研究结果一致[12],自然加倍省去了繁琐的人工加倍工作量,为纯和二倍体植株的创制提供便利。后续研究可尝试通过在小孢子暗培养阶段添加秋水仙素的方法进一步提高加倍率[13]。
甘蓝胚植株再生率不同,同时反复继代培养复壮造成DH植株从9-12月分多批从培养基中转出移栽。针对不同生长情况的植株,可采用不同移栽方式来提高组培苗移植成活率并确保植株正常开花结实。应季移植的植株,可采用常规大棚覆膜定植;错过生长季节的组培苗可利用营养钵种植,必要时转入光温水气均自动控制的人工气候室中进行低温春化或越夏培养。
[1] 赵卫国,王灏,赵小萍,等.甘蓝型油菜DH系主要性状及SSR分子标记分析[J].西北农业学报,2013,22 (11):32-36.
[2] 杨丽梅,方智远,刘玉梅,等.利用小孢子培养选育甘蓝自交系[J].中国蔬菜,2003(6):31-32.
[3] Duijs J G,Voorrips R E,Visser D L,et al.Microspore culture is successful in most crop types of Brassica oleracea L.[J]. Euphytica,1992(60):45-55.
[4] Dias J C S.Effect of activated charcoal on Brassica oleracea microspore culture embryogenesis[J].Euphytica,1999,108 (1):65-69.
[5] 陈文辉,方淑桂,曾小玲,等.甘蓝和青花菜杂种小孢子培养[J].热带亚热带植物学报,2006,14(4): 321-326.
[6] 方淑桂,陈文辉,曾小玲,等.结球甘蓝游离小孢子培养及植株再生[J].园艺学报,2006,33(1):158-160.
[7] 方淑桂,曾小玲,朱朝辉,等.结球甘蓝游离小孢子胚胎发生[J].植物科学学报,2005,23(6):530-534.
[8] Hansen M.ABA treatment and desiccation of microsporederived embryos of cabbage(Brassica oleracea ssp.capitata L.)improves plantdevelopment[J].JournalofPlant Physiology,2000,156(2):164-167.
[9] Petrova S,Antonova G.In vitro androgensis of Brassica oleracea var.capitata L.[J].Cruciferae Newsletter,1995(17):38.
[10] 张凤兰,钉贯靖久,吉川宏昭.环境条件对白菜小孢子培养的影响[J].华北农学报,1994,9(1):95-100.
[11] 方淑桂,陈文辉,曾小玲,等.大白菜游离小孢子培养技术研究初报[J].福建农业学报,2003,18(2): 123-126.
[12] Chen Z Z,Snyder S,Fan Z G,et al.Efficient production of doubled haploid plants through chromosome doubling of isolated microspores in Brassica napus[J].Plant Breeding,2006,113 (3):217-221.
[13] 石淑稳,周永明,吴江生,等.甘蓝型油菜小孢子培养、染色体加倍、试管苗继代越夏和田间移栽配套技术的研究及其在油菜育种中的应用[J].中国农学通报,2001,17 (2):57-59.
(责任编辑:侯春晓)
S 635.1
A
0528-9017(2015)05-0669-05
2015-02-11
梁 娟(1986-),女,安徽蚌埠人,硕士,主要从事甘蓝育种工作。E-mail:liangjuan7674@163.com。

