上皮性卵巢肿瘤中COX-2和PTEN蛋白的表达及其临床意义
孙丽丽,林涛
上皮性卵巢肿瘤中COX-2和PTEN蛋白的表达及其临床意义
孙丽丽,林涛
目的 检测卵巢癌患者中环氧化酶 2(COX-2)和 PTEN蛋白的表达情况,探讨其相关的临床意义。
方法 收集我院妇产科 2008年 1月至 2013年 1月收治的卵巢上皮癌患者 88例,取卵巢良性肿瘤和正常卵巢组织各 30例作为对照。免疫组化染色检测 COX-2和 PTEN蛋白表达的变化。
结果 正常卵巢、卵巢良性肿瘤以及卵巢癌组织中 COX-2蛋白的阳性率分别为 3.3%、16.7%和 65.9%,PTEN蛋白的阳性率分别为 100%、83.3%和 56.8%,各组之间具有显著性差异(P<0.05)。不同卵巢癌组织高分化 COX-2蛋白阳性率显著低于中、低分化(41.2%vs 81.5%,P<0.05)。无淋巴结转移 COX-2蛋白阳性率显著低于有淋巴结转移患者(57.5%vs 72.9%,P<0.05)。临床 I、II期 COX-2蛋白阳性率显著低于临床 III、IV期(28.6%vs 80.6%,P<0.05)。而高分化患者中 PTEN蛋白阳性率显著高于中、低分化(79.4%vs 42.6%,P<0.05)。无淋巴结转移 PTEN蛋白阳性率显著高于有淋巴结转移(85.0%vs 33.3%,P<0.05),临床 I、II期 PTEN蛋白阳性率显著高于临床 III、IV期(75.0%vs 46.8%,P<0.05)。COX-2和 PTEN的表达呈显著负相关(r=–0.584,P<0.05)。
结论 COX-2和 PTEN蛋白的异常表达参与了卵巢癌的发生、发展过程,有可能成为卵巢癌诊断、分级以及预后评估的分子标记物。
卵巢肿瘤; 环氧化酶 2; PTEN
卵巢癌是女性生殖系统中常见的一种恶性肿瘤,其人群发病率为 3%~5%,但近年来其发病呈逐年增加和年轻化的趋势[1],卵巢位置比较隐蔽,早期诊断困难,而且卵巢癌恶性程度高,患者就诊时多已经发展到中、晚期,错过了最佳治疗时间,因此卵巢癌的早期诊断和病情的判断是临床急需解决的问题[2]。环氧化酶 2(cyclooxygenase-2,COX-2)是前列腺素合成过程中的一种限速酶,近期的研究显示 COX-2在上皮细胞的增殖中发挥重要作用,在人类多种肿瘤中异常表达,与肿瘤的生长、浸润以及转移密切相关[3]。PTEN(phosphatase and tensin homologue)是一个具有磷酸酶活性的抑癌基因,具有抑制细胞生长与促进凋亡,调控细胞迁移等生物学功能,PTEN基因失活与人类各种肿瘤的发生、发展密切相关[4]。本研究检测了卵巢癌患者中 COX-2和 PTEN蛋白的表达情况,以探讨它们与卵巢癌的关系及相关的临床意义。
1 材料与方法
1.1 对象和材料
1.1.1 临床病例资料 收集我院妇产科 2008年1月至 2013年 1月收治的卵巢上皮癌患者88例,年龄37~75岁,平均(51.3±12.4)岁,所有患者均经病理确诊为卵巢上皮癌。其中有浆液性 61例,黏液性 9例,子宫内膜样变 6例,透明细胞癌 7例,混合性 5例。卵巢癌患者的临床分期使用 FIGO(1985年)临床分期标准,其中 I期8例,II期 18例,III期 42例,IV期 20例,有淋巴结转移 48例(发生率 54.5%),无淋巴结转移 40例(发生率 45.5%),高分化肿瘤 34例,中、低分化肿瘤 20和 34例。所有病例术前均未行放化疗或其他肿瘤相关治疗。同时取同期我院妇科收治并确诊的卵巢良性肿瘤 30例和我院行全子宫并双附件切除获得的正常卵巢组织 30例作为对照,三组样本在年龄等一般临床资料方面无显著性差异(P>0.05),具有可比性。
1.1.2 主要试剂和仪器 COX-2和 PTEN抗体购自美国 Proteintech Group公司;柠檬酸钠抗原修复液、SP免疫组化试剂盒及 DAB显色试剂盒购自福建迈新生物技术公司;BX51奥林巴斯显微镜购自日本奥林巴斯株式会社。
1.2 方法
1.2.1 COX-2和 PTEN蛋白的免疫组化染色 所有标本经 10%甲醛固定,石蜡包埋,4 μm连续石蜡切片,严格按照 SP免疫组化试剂盒的说明书操作,柠檬酸钠缓冲溶液高压修复抗原,一抗 1∶100稀释,4℃ 湿盒孵育过夜,加入辣根过氧化物酶标记的二抗,孵育 30 min,DAB显色,苏木精复染,脱水,透明,封面并显微镜下观察。
1.2.2 结果判断 COX-2定位于细胞质和细胞膜,PTEN定位于细胞质,阳性染色细胞呈现棕黄色或浅黄色颗粒,每片随机选取 10个高倍视野,阳性细胞率 ≤10%定义为阴性,阳性细胞率>10% 定义为阳性。每次检测均设立阴性和阳性对照。
1.3 统计学处理
采用 SPSS13.0软件进行分析,分类变量用频率表示,计数资料采用 χ2检验,Pearson相关性分析分析各检测指标的相关关系,P<0.05为统计学有显著性差异。
2 结果
2.1 COX-2和 PTEN蛋白在不同卵巢组织中的表达
免疫组化结果显示 COX-2定位于细胞质和细胞膜,PTEN定位于细胞质。正常卵巢、卵巢良性肿瘤以及卵巢癌组织中 COX-2蛋白的阳性率分别为 3.3%、16.7%和 65.9%,PTEN蛋白的阳性率分别为 100%、83.3%和 56.8%,各组之间具有显著统计学差异(P<0.05),如表 1所示。
2.2 不同卵巢癌组织中 COX-2和 PTEN蛋白与临床各相关指标之间的关系
卵巢癌患者中,高分化 COX-2蛋白阳性率为41.2%,显著低于中、低分化的 81.5%(P<0.05)。有淋巴结转移 COX-2蛋白阳性率为 72.9%,显著高于无淋巴结转移的 57.5%(P<0.05)。临床 I、II期 COX-2蛋白阳性率为 28.6%,显著低于临床III、IV期的 80.6%(P<0.05)。
卵巢癌患者中高分化 PTEN蛋白阳性率为79.4%,显著高于中、低分化的 42.6%(P<0.05)。有淋巴结转移 PTEN蛋白阳性率为 33.3%,显著低于无淋巴结转移的 85.0%(P<0.05),临床 I、II期 PTEN蛋白阳性率为 75.0%,显著高于临床III、IV期的46.8%(P<0.05)(表 2)。
2.3 COX-2和 PTEN蛋白表达的相关性分析
Pearson相关性分析显示卵巢癌组织中COX-2和 PTEN蛋白的表达呈显著负相关(r= –0.584,P<0.05)(表 3)。

表1 三组 COX-2和 PTEN蛋白表达阳性率的比较Table 1 Positive rate comparison of three groups COX-2 and PTEN protein expression
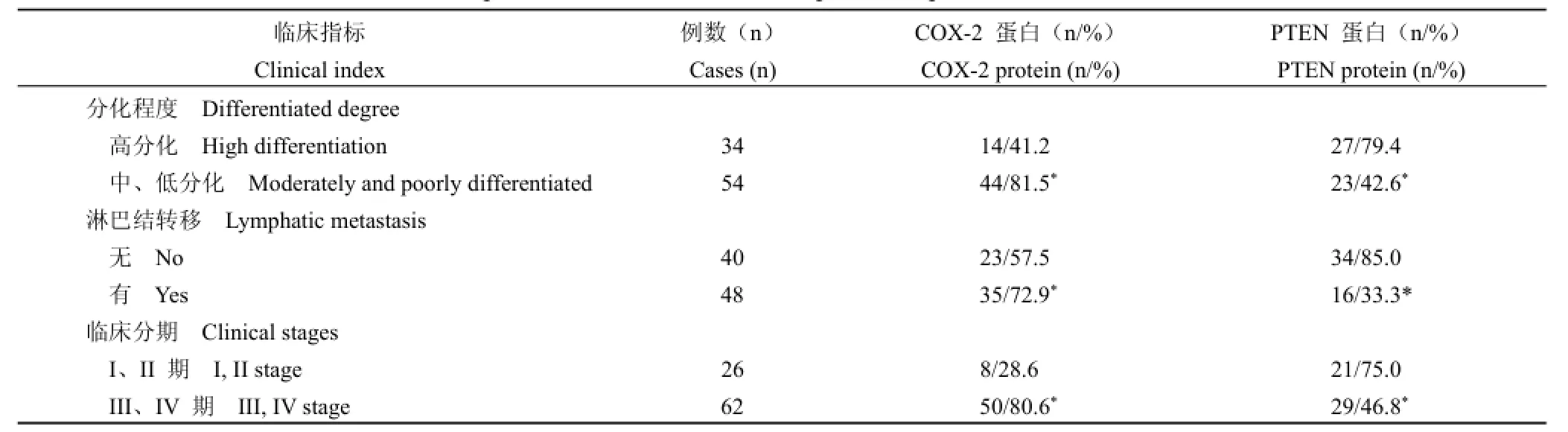
表2 不同卵巢癌组织中 COX-2和 PTEN蛋白表达阳性率的比较Table 2 Positive rate comparison of COX-2 and PTEN protein expression in different ovarian cancer tissue

表3 COX-2表达与 PTEN蛋白表达的相关性分析结果Table 3 Correlation analysis result of COX-2 expression and PTEN protein expression
3 讨论
卵巢癌死亡率居女性生殖系统恶性肿瘤首位,其发病机制目前仍不清楚。众所周知,恶性肿瘤的发生、发展是一个多步骤变化过程,其中涉及到多种基因的激活,或者多个基因的失活[5]。研究认为多种肿瘤组织中 COX-2蛋白过表达使肿瘤组织PGs产生过多,PGs除了促进正常细胞 DNA的合成外,也可以促进肿瘤细胞的增殖,主要是通过激活 bcl-2基因抑制促凋亡蛋白表达而抑制细胞凋亡,促进细胞增殖[6-7]。PTEN作为抑癌基因表达PTEN蛋白,PTEN蛋白通过其磷酸酶活性使 PIP3去磷酸化,阻断 PKB/Akt信号通路,进而抑制细胞分裂、增殖,诱导细胞凋亡[8-9]。本研究也显示卵巢癌组织中 COX-2阳性率显著高于非癌组织,PTEN阳性率显著低于非癌组织,说明了 COX-2基因的激活和 PTEN基因的失活可能参与了卵巢癌的发生、发展过程。
本研究观察到卵巢癌患者组织中 COX-2阳性率在高分化组显著低于中、低分化组,PTEN阳性率在高分化组显著高于中、低分化组,说明了COX-2和 PTEN的异常表达与卵巢上皮性癌组织分化程度密切相关。COX-2阳性率在有淋巴结转移组显著高于无淋巴结转移组,PTEN阳性率在有淋巴结转移组显著低于无淋巴结转移组,说明了COX-2和 PTEN的异常表达可能参与了卵巢上皮性癌的侵袭和转移。COX-2阳性率在临床 I、II组显著低于 III、IV期组,PTEN阳性率在临床 I、II组显著高于 III、IV期组,说明了 COX-2和PTEN的异常表达可用于患者预后的评估。
本研究显示卵巢癌组织中 COX-2和 PTEN蛋白的表达呈显著负相关,说明了两者之间可能存在着一定的负调控机制,已有研究显示,COX-2可通过调节 PTEN和AKT来抑制由 Fas介导的细胞凋亡,另外选择性 COX-2抑制剂可上调人癌细胞 PTEN基因表达[10],两者之间具体的调控机制还有待进一步的研究。
目前,CA125已被公认在多种癌症患者体内表达异常,可作为癌症诊断的标志物之一,对肿瘤的临床诊断有着较好的指示意义。结合本研究显示卵巢癌组织中存在 COX-2和 PTEN蛋白的异常表达,三者的联合检测有可能成为卵巢癌诊断、分级以及预后评估的新分子标记物。
[1] Stein SM,Tiersten A,Hochster HS,et al.A phase 2 study of oxaliplatin combined with continuous infusion topotecan for patients with previously treated ovarian cancer.Int J Gynecol Cancer,2013,23(9):1577-1582.
[2] Wu S,Ma JJ,Jiang Y,et al.The expression of scinderin in epithelial ovarian cancer and the clinicopathologic significance.J Pract Obstet Gynecol,2013,29(7):522-525.(in Chinese)
吴姗,马晶晶,姜旖,等.卵巢上皮性癌中肌切蛋白的表达及其临床意义.实用妇产科杂志,2013,29(7):522-525.
[3] Lee JY,Myung SK,Song YS.Prognostic role of cyclooxygenase-2 in epithelial ovarian cancer:a meta-analysis of observational studies. Gynecol Oncol,2013,129(3):613-619.
[4] Tanwar PS,Kaneko-Tarui T,Lee HJ,et al.PTEN loss and HOXA10
expression are associated with ovarian endometrioid adenocarcinoma
differentiation and progression.Carcinogenesis,2013,34(4):893-901. [5] Brucka A,Szyllo K.Immunoexpression of the PTEN protein and matrix metalloproteinase-2 in endometrial cysts,endometrioid and clear cell ovarian cancer.Ginekol Pol,2013,84(5):344-351.
[6] Wang Y,Lin Y,Sun JY,et al.The clinical significance of the expression of COX-2 and PTEN in cutaneous basal cell carcinoma tissue.China Prac Med,2013,8(20):22-23.(in Chinese)
汪雁,林渊,孙健宇,等.COX-2、PTEN在皮肤基底细胞癌中的表达与临床意义.中国实用医药,2013,8(20):22-23.
[7] Joki T,Heese O,Nikas DC,et al.Expression of cyclooxygenase 2 (COX-2)in human glioma and in vitro inhibition by a specific COX-2 inhibitor,NS-398.Cancer Res,2000,60(17):4926-4931.
[8] Saini MK,Sanyal SN.PTEN regulates apoptotic cell death through PI3-K/Akt/GSK3β signaling pathway in DMH induced early colon carcinogenesis in rat.Exp Mol Pathol,2012,93(1):135-146.
[9] Huang HY,Liu XL,Chen H,et al.Expression levels and clinical significance of PTEN and FHIT in epithelial ovarian tumors.Matern Child Health Care China,2010,25(5):654-656.(in Chinese)
黄海玉,刘小乐,陈衡,等.PTEN和FHIT在上皮性卵巢肿瘤中的表达及其临床意义.中国妇幼保健,2010,25(5):654-656.
[10]Lai CR,Hsu CY,Chen YJ,et al.Ovarian cancers arising from endometriosis:a microenvironmental biomarker study including ER,HNF1ß,p53,PTEN,BAF250a,and COX-2.J Chin Med Assoc,2013,76(11):629-634.
Methods A total of 88 ovarian cancer patients were enrolled in our hospital.30 cases of benign ovarian tumor and 30 cases of normal ovarian tissue were used as control.The protein expresssion of COX-2 and PTEN was detected by immunohistochemical analysis.
Results The positive rate of COX-2 in normal ovarian tissue,benign ovarian tumor,and ovarian carcinomas was 3.3%,16.7%,and 65.9%,respectively.The positive rate of PTEN in normal ovarian tissue,benign ovarian tumor,and ovarian carcinomas was 100%,83.3%,and 56.8%,respectively.There was significant difference among the three groups(P<0.05).The positive rate of COX-2 was significantly lower in the well-differentiated ovarian cancer than that in poorly-and moderately-differentiated ovarian cancer(41.2% vs 81.5%,P<0.05).The positive rate of COX-2 in cancer without lymph node metastasis was significantly lower than that in those with lymph node metastasis(57.5%vs 72.9%,P<0.05).The positive rate of COX-2 in clinical I and II stage was lower than stage III and IV(28.6%vs 80.6%,P<0.05).At the same time,the positive rate of PTEN was higher in the well-differentiated ovarian cancer than that in poorly-and moderately-differentiated ovarian cancer(79.4%vs 42.6%,P<0.05).The positive rate of PTEN in cancer without lymph node metastasis was significantly higher than that in those with lymph node metastasis(85.0%vs 33.3%,P<0.05).The positive rate of PTEN was higher in clinical I and II stage than stage III and IV(75.0%vs 46.8%,P<0.05).The protein expression of COX-2 was significantly negative related with PTEN in epithelial ovarian cancer(r=–0.584,P<0.05).
Conclusion The upregulation of COX-2 and downregulation of PTEN was involved in the occurrence and development of ovarian cancer,which can be used as the markers for diagnosis by estimating the grade of differentiation and prognosis of ovarian tumor.
The expresssion and clinical significance of COX-2 and PTEN protein in epithelial ovarian cancer
SUN Li-li,LIN Tao
Objective To detect the protein expresssion of COX-2 and PTEN in epithelial ovarian cancer and explore their clinical significance.
Ovarian neoplasms;Cyclooxygenase 2;PTEN
SUN Li-li,Email:404397017@qq.com
10.3969/cmba.j.issn.1673-713X.2015.02.010
251100山东省德州市,齐河县人民医院妇产科
孙丽丽,Email:404397017@qq.com
2015-03-11
www.cmbp.net.cn 中国医药生物技术,2015,10(2):149-152
AuthorAffiliation:Gynecology and Obstetrics of Qihe County People's Hospital,Dezhou Shandong 251100,China
www.cmbp.net.cn Chin Med Biotechnol,2015,10(2):149-152

