大鼠骨髓间充质干细胞的分离鉴定及其在胶质瘤治疗中的作用
刘 辉,张鹏幸,范菲艳,刘 楠,任东妮,张永生,涂艳阳 (第四军医大学唐都医院实验外科,陕西西安710038)
·基础与转化医学·
大鼠骨髓间充质干细胞的分离鉴定及其在胶质瘤治疗中的作用
刘 辉,张鹏幸,范菲艳,刘 楠,任东妮,张永生,涂艳阳 (第四军医大学唐都医院实验外科,陕西西安710038)
目的:建立大鼠骨髓间充质干细胞(BMSCs)的分离、培养、纯化方法,并对其进行形态学和细胞表面分子标记鉴定,确定其对胶质瘤细胞的趋向性和慢病毒对其的可感染性,为其作为载体携带目的基因或药物对胶质瘤进行治疗提供实验依据.方法:通过全骨髓培养法、差速贴壁的原理和形态学观察分离、纯化出生长旺盛、形态单一的细胞,并通过流式细胞仪对分离细胞进行细胞表面标记分子的鉴定;确定分离细胞为 BMSCs后将其与胶质瘤 U87MG细胞共培养观察其对胶质瘤细胞的趋向性,并用慢病毒载体对其进行可感染性的确定.结果:分离出的 BMSCs以成纤维细胞样为主,生长旺盛,呈放射状排列的细胞集落,可稳定传代.流式细胞仪结果显示,所分离的细胞均呈 CD29和 CD90的阳性表达,而CD11b/c和 CD45的表达均呈阴性;按1∶100的比例将 BMSCs和U87MG共培养后发现,BMSCs有靶向U87MG的特性并且在一定程度上可以抑制 U87MG的生长;慢病毒可感染我们分离出的BMSCs且感染率较高.结论:我们采用的方法操作简单,可在体外分离、鉴定出大量纯度高的 BMSCs,并证明了其在体外可以靶向胶质瘤细胞生长,且易于被慢病毒载体感染.这些结果均为后续研究 BMSCs提供充足的种子细胞,将其作为载体携带目的基因或药物治疗胶质瘤提供了前期的实验依据.
骨髓间充质干细胞;分离;鉴定;趋向性;胶质瘤
0 引言
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是骨髓中克隆性产生的非造血干细胞,是一类具有多向分化潜能,并且在一定条件下能跨胚层向骨、脂肪和神经等多种谱系分化的成体干细胞[1-2],其应用具有骨髓采集相对安全、方便,供者无明显并发症、可避免伦理学问题等优点,有利于体外扩增和自体回植.因此,BMSCs是理想的种子细胞来源之一,在基因治疗、细胞替代治疗及组织器官再造中具有重要的临床应用价值[3].恶性胶质瘤是中枢神经系统常见的原发性肿瘤,即便最大程度地切除肿瘤后联合进行放化疗,其预后仍然很差,其中一个重要的原因就是其在颅内呈强侵袭性、转移性生长,其分布的不均匀性导致用重组病毒等载体转染颅内胶质瘤细胞成功的转染率不高.而有研究表明,干细
dentification;tropism;glioma胞载体能克服上述缺点,它具有明显的趋肿瘤性,在体内和体外的实验中均发现它能向胶质瘤细胞迁移,并且分布在瘤细胞周围[4].目前,干细胞联合基因治疗恶性胶质瘤已成为研究胶质瘤治疗的热点.携带自杀基因、免疫基因及诱导凋亡基因的干细胞载体植入胶质瘤动物模型体内后,既可以很好地整合于宿主脑组织发挥自身的肿瘤抑制作用,又可以发挥上述基因的肿瘤杀伤作用[5-6],且其移植方式呈多样化,在实验和临床应用中都较为方便.因此,本研究首先对间充质干细胞的培养条件进行了探索,实现了其体外分离及扩增,获得了生长状态良好、较纯化和足够数量的形似BMSCs细胞,并根据其细胞表面分子鉴定结果鉴定其确为BMSCs,接着从体外实验探讨了BMSCs对胶质瘤 U87MG细胞的趋向性和慢病毒对其的可感染性,为进一步探明BMSCs作为基因或者药物载体对抗胶质瘤的可能性奠定了基础.
1 材料和方法
1.1 材料
1.1.1 实验动物 Sprague-Dawley(SD)雌性大鼠,4周龄,体质量(120±20)g,购自第四军医大学实验动物中心,动物实验符合伦理学标准.
1.1.2 细胞 胶质瘤 U87MG细胞系,本实验室保存.
1.1.3 主要试剂 DMEM/F12培养基、胎牛血清(FBS)、胰蛋白酶,二甲基亚砜(DMSO),分别购自Hyclone、Gibco公司,PE标记的抗大鼠 CD11b/c、CD90,FITC标记的抗大鼠CD29、CD45,购自 eBioscience公司.慢病毒载体、凝聚胺(polybrene)购自纽恩(上海)生物科技有限公司.
1.2 方法
1.2.1 BMSCs的体外分离、培养和纯化 采用颈椎脱臼法处死4周龄SD大鼠,75%乙醇中浸泡10 min;在超净工作台中取下双后肢,逆向解剖法游离股骨和胫骨,PBS清洗3次;剪掉股骨和胫骨的骨垢端,暴露骨髓腔,用添加了胎牛血清、谷氨酰胺、丙酮酸钠、维生素C及青、链霉素的DMEM/F12培养基冲出骨髓,反复吹打;然后经 200目不锈钢滤网过滤细胞悬液,1 000 r/min离心5 min,弃上清重悬后采用全骨髓培养法接种于10 cm培养皿中,置37℃、5%CO2培养箱中培养;1.5 h后小心吸取培养液后全量换液,48~72 h后再全量换液一次,利用 BMSCs的贴壁特性洗去不贴壁的其它细胞,之后每3~4 d全量换液;待细胞密度长至 80%~90%时,0.25%胰酶消化 2 min,按1∶3比例传代;此后通过BMSCs可贴壁但不紧密的特性不断换液、传代以纯化细胞,每日用倒置相差显微镜观察细胞生长状况、形态变化及拍照.
1.2.2 BMSCs的鉴定 通过换液、传代不断纯化的细胞经形态学观察初步鉴定后,取第6~10代形态相符、生长状态良好的细胞进行 BMSCs特异性分子表面标记鉴定:0.25%胰酶消化,1 000 r/min离心5 min,PBS洗3次后进行细胞计数,调整细胞浓度,使每管细胞数约1×105个,之后每管分别加入 CD11b/c、CD29、CD45及CD90单克隆抗体,同时设阴性对照.在4℃条件下孵育30 min,PBS清洗3次后以500 μL PBS重悬细胞,用流式细胞仪进行检测分析.
1.2.3 BMSCs与胶质瘤细胞 U87MG共培养时的旁观者效应 分别按1∶10、1∶100和 1∶1 000的比例将BMSCs和U87MG共培养,观察BMSCs是否有趋向U87MG生长的趋势及旁观者效应,并确定两种细胞的最佳比例.
1.2.4 慢病毒载体对 BMSCs可感染性的确定 慢病毒感染BMSCs前两天,将BMSCs以1∶3的比例传至六孔板中,使细胞在慢病毒感染时达到 70% ~80%的融合;感染前,弃原培养基,用含有6 mg/L凝聚胺(Polybrene)的0.5 mL新鲜培养基覆盖细胞表面,每孔分别加入5 μL、10 μL、15 μL、20 μL慢病毒悬液,37℃孵育,期间不断缓慢晃动培养板;4 h后加入1.5 mL新鲜培养基以稀释 Polybrene;继续培养24 h,用新鲜培养基替换含有病毒的培养基继续培养.因慢病毒含有EGFP,一般转染48 h后可见明显荧光表达,72 h后更加明显.
1.2.5 BMSCs的冻存及复苏 取已经过鉴定,生长旺盛且已基本长满培养皿底的第3~4代 BMSCs细胞消化,用培养基清洗3次,最后用1 mL DMSO与胎牛血清(FBS)(DMSO:FBS为1∶10)悬浮细胞,混匀后加入冻存管中,BMSCs的终浓度大约为 2.5×109cells/L,4℃静置30 min后于 -20℃保存2 h,再置于-80℃冰箱过夜后放入液氮罐中长期保存.6个月后,将冻存管从液氮罐中取出后迅速置于 37℃温水中,摇动使其快速融化后将全部细胞冻存液移入 5 mL培养基,混匀后1 000 r/min离心5 min,弃上清重悬后全部接种于 10 cm培养皿中,置 37℃、5%CO2培养箱中培养,观察细胞生长增殖情况及形态学变化.
2 结果
2.1 BMSCs的原代、传代培养及形态学变化 采用全骨髓培养法,3 d首次换液后,出现个别贴壁细胞,呈三角形或星形,也有椭圆形、短梭形,且伸出长短不一、粗细不等的胞质突起相互连接(图 1).接种 5 d后,贴壁细胞数量明显增加并形成细胞团,常为短梭形、椭圆形.7~8 d后铺满10 cm细胞培养皿.用0.25%胰蛋白酶消化后传代至新培养皿.传代后细胞形态更趋于BMSCs典型形态,且细胞生长速度明显加快,约3~5 d可铺满皿底.根据BMSCs贴壁且不紧密的特性,传代时需严控消化时间以不断提高BMSCs纯度,当传至第 5~6代时,细胞形态趋于一致,纯度较高,多呈放射状成纤维细胞样,平行排列或呈旋涡状生长(图2).

图1 BMSCs的原代培养
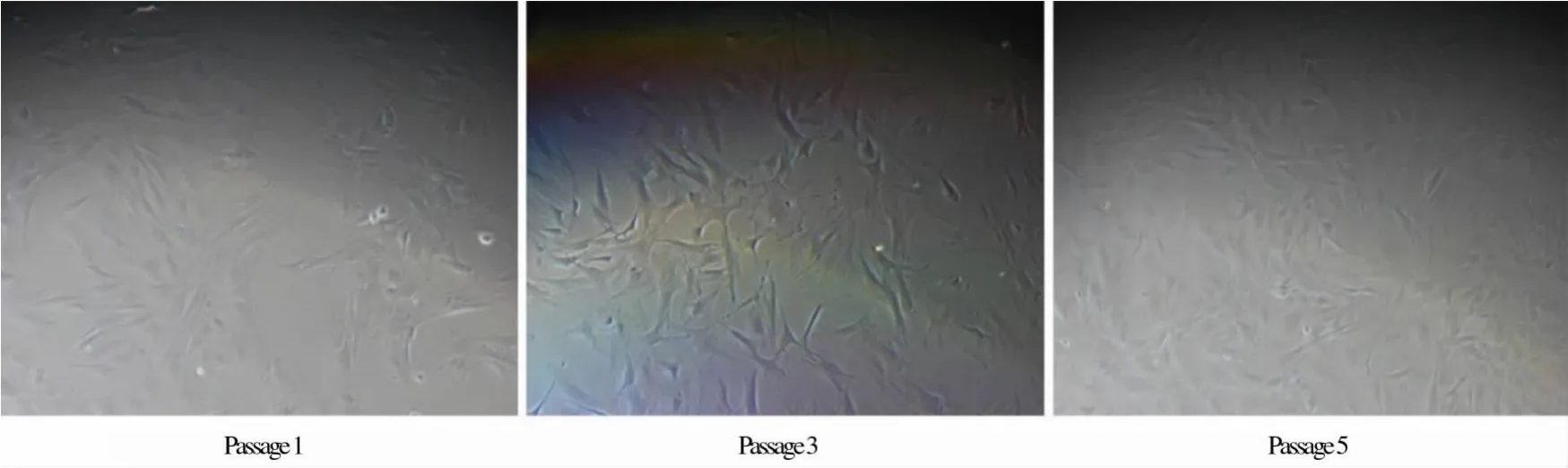
图2 BMSCs的传代培养
2.2 BMSCs的表面标记分子的流式鉴定 我们根据细胞治疗国际协会(International Society for Cellular Therapy,ISCT)规范的间充质干细胞表面标记分子标准,再结合大量外文文献结果,最终选择了 PE标记的CD11b/c、CD90和FITC标记的CD29、CD45四种分子对所分离出的细胞进行了表面标记分子鉴定.结果显示,所分离细胞 CD29和CD90表达呈阳性,而CD11b/c和CD45表达呈阴性(图 3),确定分离细胞为骨髓间充质干细胞.
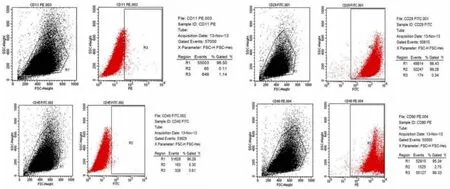
图3 BMSCs的细胞表面标记分子鉴定
2.3 BMSCs与胶质瘤 U87MG共培养时的旁观者效应 经过筛选,我们在BMSCs与U87MG接种比例为1∶100的实验中观察到了比较明显的旁观者效应,可见BMSCs有趋向U87MG生长的趋势,且与单独培养U87MG细胞组相比,BMSCs本身对 U87MG的生长有抑制作用,BMSCs周围的 U87MG数量明显偏低(图4).
2.4 慢病毒载体对 BMSCs可感染性的确定 在验证 BMSCs具有靶向胶质瘤细胞的功能之后,为进一步验证其是否可以作为载体携带各种目的基因而使其对胶质瘤发挥治疗作用成为可能,又因为慢病毒对转染细胞病理作用小,对一些较难转染的细胞,如原代细胞、干细胞及不分化的细胞等有较高的感染效率,可携带基因的片段大,所以我们选取了慢病毒对其进行了可感染性的确定.结果表明,慢病毒可成功感染我们分离鉴定出的BMSCs(图5),为其以后的研究和应用提供了实验依据.
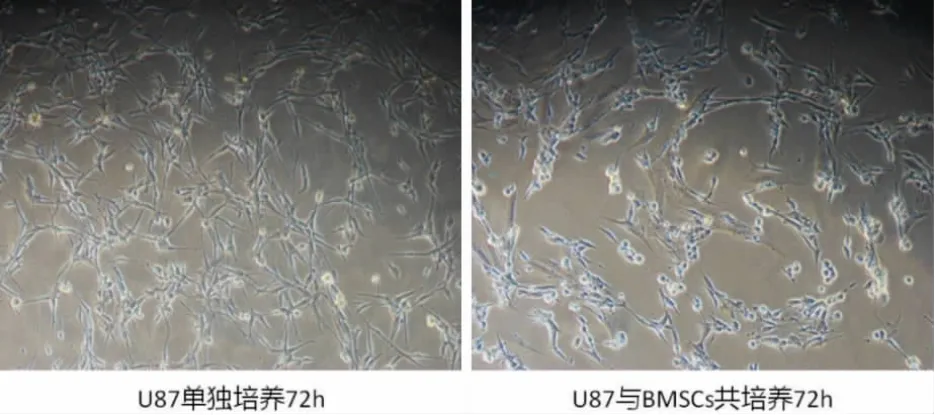
图4 BMSCs与 U87MG共培养时的旁观者效应
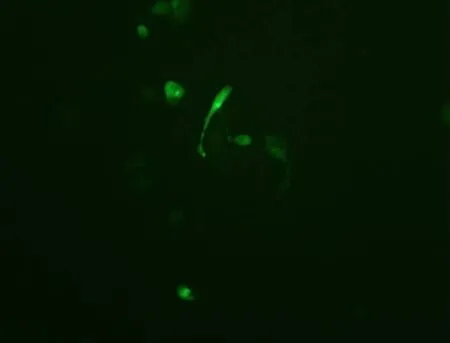
图5 慢病毒对BMSCs可感染性的确定
2.5 BMSCs的冻存及复苏 BMSCs经过 6个月的液氮冻存后复苏培养,在形态学和生长状况方面与冻存前没有明显差别,均呈成纤维细胞样(图6).

图6 冻存的 BMSCs复苏培养3 d后
3 讨论
快速、无污染地获得大鼠股骨和胫骨是制备骨髓间充质干细胞的先决条件,但鲜有文献对这一看似简单的操作进行具体描述.虽然有个别研究者也发表过类似报道[7],但其方法操作速度慢且容易损伤股骨和胫骨,不能成为简捷统一的方法.我们参考了付必莽等[8]的逆向解剖法,可迅速游离出大鼠的股骨和胫骨.以镊子固定骨骼后再以剪刀沿骨干逆肌肉走向进行“剪合-滑动-折转”3个动作,即可以完全清除附着于股骨和胫骨的肌肉,且用时很短.后面细胞原代和传代培养的结果也表明,细胞生长旺盛且形态、活力无明显下降,证实了本方法的可行性.这种方法易于重复操作、快捷实用,在能完全清除附着在股骨和胫骨上肌肉的同时解决了损伤和污染骨髓腔的问题,显著减少了长时间缺血对骨髓细胞的影响,为后面对 BMSCs的研究提供了良好的基础.
我们采取的全骨髓培养法操作简单,对细胞损伤小,能被广泛应用[9].虽然传统的方法所分离的原代培养物中除了成纤维细胞样的 BMSCs外还有巨噬细胞、造血细胞以及红细胞等杂质细胞,但我们通过不锈钢网过滤、1.5 h换液去除黏附能力弱的杂质细胞和组织碎片,有效地提高了BMSCs的纯化效率.随着培养时间的延长,培养液中的营养成分被大量消耗,培养物中还积累了大量的活性细胞代谢产物以及坏死细胞的裂解产物等有害物质和一些杂质细胞分泌的细胞因子,影响了 BMSCs的生长和干性维持[10].我们又通过 48~72 h再次全量换液,去除了这些培养基中的不利成分,提供了一个适合 BMSCs生长增殖的有利环境.我们首次利用 24 h和 48~72 h两次全量换液法,在原代即获得了形态均一、性状稳定的BMSCs,且操作快捷简单,为对BMSCs进行后续研究和将其作为种子细胞提供了实验基础.
BMSCs的表面抗原并不是独特的,它同时具有间质细胞、内皮细胞和肌肉细胞等多种细胞的表面抗原.一般认为,整合素家族蛋白 CD29、细胞黏附分子免疫球蛋白超家族蛋白 CD44、CD90、CD105等是BMSCs的重要标志物[11],而其不表达造血细胞的表面抗原,如 CD11b、CD34、CD38和 CD45等.我们再结合国际细胞治疗学会间充质及组织干细胞委员会提出的 BMSCs的标准[12],最后选取了 BMSCs表达的阳性指标CD29和CD90,和表达阴性的指标 CD11b/c和 CD45作为鉴定参考指标.流式细胞仪的检测结果显示,我们分离出的细胞确实符合 BMSCs的表面标志物特征.
有研究表明,BMSCs对部分肿瘤有明显的趋向性,并且能发挥自身的肿瘤抑制作用或通过介导特定细胞因子来抑制肿瘤的生长[13].此外,其还能克服许多病毒载体的缺陷,又具有分离方便、低免疫原性和易基因修饰等特点,其作为载体在携带药物和目的基因抗肿瘤的研究中越来越具有潜力[14].因此,验证其对肿瘤细胞的趋向性十分有必要.我们通过体外共培养探讨了 BMSCs对胶质瘤 U87MG细胞的趋向性,结果表明其可靶向胶质瘤细胞并发挥一定的肿瘤细胞抑制作用,又以慢病毒对其进行感染确定了其可携带目的基因的可能性,为进一步将其作为载体治疗胶质瘤提供了支持.
综上所述,BMSCs在细胞替代治疗及基因治疗肿瘤等方面具有广阔的应用前景,受到了国内外学者的高度重视.目前对其的研究和应用尚处于初级阶段,随着对其研究的不断深入,BMSCs在不久的将来一定会成为抗肿瘤治疗的有力工具和途径.
[1]Jaiswal RK,Jaiswal N,Bruder SP,et al.Adult human mesenchymal stem cell differentiation to the osteogenic or adipogenic lineage is regulated by mitogen-activated protein kinase[J].J Biol Chem,2000,275(13):9645-9652.
[2]Prockop DJ.Marrow stromal cells as stem cells for nonhematopoietic tissues[J].Science,1997,276(5309):71-74.
[3]Van Damme A,Vanden Driessche T,Collen D,et al.Bone marrow stromal cells as targets for gene therapy[J].Current Gene Therapy,2002,2(2):195-209.
[4]Tyler MA,Ulasov IV,Sonabend AM,et al.Neural stem cells target intracranial glioma to deliver an oncolytic adenovirus in vivo[J].Gene Ther,2009,16(2):262-278.
[5]Rath P,Shi H,Maruniak JA,et al.Stem cells as vectors to deliver HSV/tk gene therapy for malignant gliomas[J].Curr Stem Cell Res Ther,2009,4(1):44-49.
[6]Hwang DH,Lee HJ,Park IH,et al.Intrathecal transplantation of human neural stem cells overexpressing VEGF provide behavioral improvement,disease onset delay and survival extension in transgenic ALS mice[J].Gene Ther,2009,16(10):1234-1244.
[7]Soleimanil M,Nadri Sl.A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow[J].Nat Protoc.2009,4(1):102-106.
[8]付必莽,苏莹珍,何小文,等.逆向解剖法游离股骨/胫骨快捷制备小鼠骨髓细胞[J].中国组织工程研究与临床康复,2011,15(14):2601-2604.
[9]Wang X,Hisha H,Mizokami T,et al.Mouse mesenchymal stem cells can support human hematopoiesis both in vitro and in vivo:the crucial role of neural cell adhesion molecule[J].Haematologica,2010,95(6):884-891.
[10]苏永锋,霍思维,江小霞,等.CD34+细胞来源的树突状细胞对骨髓间充质干细胞的生物学特性影响[J].中国实验血液学杂志,2009,17(4):981-985.
[11]De Ugarte DA,Alfonso Z,Zuk PA,et al.Differential expression of stem cell mobilization-associated molecules on multi-lineage cells from adipose tissue and bone marrow[J].Immunol Lett,2003,89(2-3):267-271.
[12]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[13]Hu YL,Fu YH,Tabata Y,et al.Mesenchymal stem cells:a promising targeted-delivery vehicle in cancer gene therapy[J].J Control Release,2010,147(2):154-162.
[14]Morikawa S,Mabuchi Y,Kubota Y,et al.Prospective identification isolation and systemic transplantation of multipotent mesenchymal stem cells in murine bone marrow[J].J Exp Med,2009,206(11):2483-2496.
Isolation and identification of rat bone marrow mesenchymal stem cells and its contribution in the treatment of glioma
LIU Hui,ZHANG Peng-Xing,FAN Fei-Yan,LIU Nan,REN Dong-Ni,ZHANG Yong-Sheng,TU Yan-Yang
Department of Experimental Surgery,Tangdu Hospital,Fourth Military Medical University,Xi'an 710038,China
AIM:To establish a method of isolating,cultivating and purifying rat bone marrow mesenchymal stem cells(BMSCs)in vitro,to indentify cell morphology and cell surface markers,to investigate the tropism of BMSCs towards U87MG glioma and infection of lentiviral vector to BMSCs,to provide the experimental evidence for the gene therapy and medication of glioma with BMSCs acting as vectors.METHODS:BMSCs keeping strong growth and stable morphology from rats were isolated,cultured and purified by the whole bone marrow adherence method combined with the different adherent capacities of kinds of cells and the cells morphology observations.Then the cell surface markers were assessed by flow cytometry.BMSCs were co-cultured with U87MG to investigate their tropism towards U87MG glioma and infected with the lentiviral vector to verify their potentiality for gene therapy.RESULTS:The isolated BMSCs were fibroblastlike,showing radial colony arrangement.Cells could keep strong growth and passage in continuous and stable manner over passages.According to the FCM,BMSCs were positive for CD29 and CD90,but negative for CD11b/c and CD45.After being co-cultured with U87MG with the ritio of 1∶100,BMSCs had significant tropism towards U87MG and restrained the U87MG growth to some extent.Also,the lentiviral vector infected BMSCs successfully with high rate of infection.CONCLUSION:Our method is simple and can isolate,purify and amplify BMSCs in vitro and BMSCs have a tropism towards U87MG glioma and can be infected by the lentiviral vector.All these results provide adequate source of seed cells for further study of BMSCs and experimental evidence for gene therapy and medication of glioma with BMSCs as vectors.
bone marrow mesenchymal stem cells;isolation;i-
R739.4
A
2095-6894(2015)01-010-05
2014-12-28;接受日期:2015-01-19
国家自然科学基金青年项目(81101736)
刘 辉.硕士.研究方向:胶质瘤的基因治疗.Tel:029-84778169 E-mail:liuhui13209@163.com
张永生,涂艳阳.E-mail:tu.fmmu@gmail.com

