2015年9月美国、欧盟和日本新批准药物概述
孙友松
·世界上市新药·
2015年9月美国、欧盟和日本新批准药物概述
孙友松

编者按:《药学进展》自2015年第9期开始,每期推出当月美国、欧盟和日本新批准药物及研发进展系列报道,向读者及时、全面地介绍全球新药研发动态,为从事药物研发的人员提供参考,启迪思路。
2015年9月,美国、欧盟和日本共批准46个新药,包括新分子实体、新有效成分、新生物制品、新增适应证及新剂型药物。本文对全球首次获得批准的新分子实体、新有效成分、新生物制品进行分析,重点介绍这些药物的临床研究结果和研发历史进程。
新药批准;临床试验;新分子实体;新生物制品
美国、欧盟和日本医药市场规模庞大,一直处于国际前列,新药研发竞争也日益激烈。2015年9月,共46个新药在上述3个区域获得批准,其中9个属于全球首次获得批准的新药,包括6个新分子实体,1个新有效成分,1个新生物制品和1个药械组合。
1 2015年9月美国FDA新批准药物
2015年9月美国FDA共批准14个药物,包括3个全球首次批准的新分子实体[罗拉吡坦(1)、尿苷三乙酸酯(2)、卡利拉嗪(3)]和2个美国首次批准的新分子实体(Lonsurf®、德谷胰岛素),此外还有4个新增适应证的药物、4个新剂型和1个新复方药物(见表1)。
3

表1 2015年9月美国FDA新批准药物Table 1 New drugs approved by FDA in September 2015
1.1 罗拉吡坦
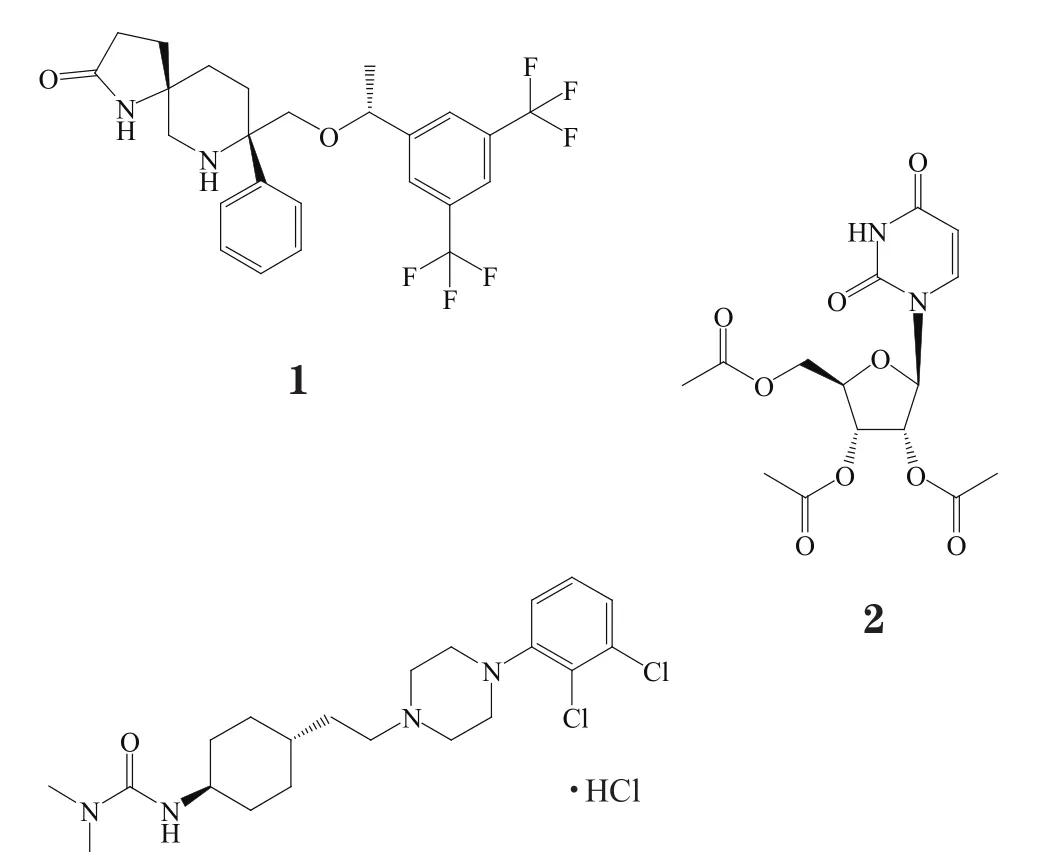
罗拉吡坦(rolapitant)是一种神经激肽1(neurokinin-1,NK-1)受体拮抗剂,由TESARO公司开发,商品名Varubi®。2015年9月1日,美国FDA全球率先批准罗拉吡坦[1],该药与5-羟色胺3(5-HT3)受体拮抗剂格拉司琼和长效糖皮质激素类药物地塞米松联用,可预防化疗引起的恶心和呕吐,TESARO公司针对该适应证共开展三项国际、多中心、随机、双盲、对照的Ⅲ期临床研究[2]。
第一项临床研究(NCT01500226)共召募1 369名患者,这些患者全部接受中度致吐性化疗,其中一半是接受蒽环类药物化疗的乳腺癌患者。患者分为罗拉吡坦+格拉司琼+地塞米松组和格拉司琼+地塞米松组,以无任何呕吐发作且无需服用治疗恶心的药物作为完全应答(complete response,CR),结果显示,罗拉吡坦+格拉司琼+地塞米松组受试者24~120 h延迟相完全应答率超过格拉司琼+地塞米松组(71.3% vs 61.6%,P< 0.001),达到研究主要终点,且0~24 h急性相(83.5% vs 80.3%,P = 0.143)和0~120 h总体相(68.6% vs 57.8%,P < 0.001)也超过格拉司琼+地塞米松组,达到部分次要终点。
第二项临床研究(NCT01500213)和第三项临床研究(NCT01499849)分别召募555名和532名患者,这些患者全部接受高度致吐性化疗,受试者分为罗拉吡坦+格拉司琼+地塞米松组和格拉司琼+地塞米松组,以无任何呕吐发作且无需治疗恶心的药物作为完全应答,结果显示,两项研究的罗拉吡坦+格拉司琼+地塞米松组受试者24~120 h延迟相完全应答率均超过格拉司琼+地塞米松组(72.7% vs 58.4%,P < 0.001和70.1% vs 61.9%,P = 0.043),达到研究主要终点。以无任何呕吐和恶心发作为应答指标分析,以上三项预防化疗引起的恶心和呕吐Ⅲ期临床研究结果表明罗拉吡坦+格拉司琼+地塞米松组应答率相比格拉司琼+地塞米松组也有明显提升。
罗拉吡坦最先由先灵葆雅公司开发,2009年OPKO Health公司从先灵葆雅公司获得该药开发上市销售权,TESARO公司2010年以总价1.21亿美元(包括预付款、研发和上市销售里程碑付款)从OPKO Health公司获得该药全球开发上市销售权,2015年7月江苏恒瑞医药从TESARO公司获得该药中国地区开发上市销售权。
P物质是一种存在于脑中的神经肽,通过兴奋神经激肽1(NK-1)受体引起恶心、呕吐。NK-1受体拮抗剂可阻止P物质与NK-1受体结合,从而产生止吐效果,是继5-羟色胺3受体拮抗剂后的一类新型止吐药。默沙东公司阿瑞匹坦(aprepitant)2003年在美国上市,是第一个获批的NK-1受体拮抗剂,商品名Emend®,2015年8月28日美国FDA新增阿瑞匹坦适应证人群,现可用于12岁或30 kg以上儿童。默沙东公司注射用福沙匹坦二甲葡胺(fosaprepitant dimeglumine),即阿瑞匹坦前药,在三唑环氮原子上引入磷酰基与2个甲葡胺形成盐,可增加水溶性,在体内水解为阿瑞匹坦,2008年在美国上市,商品名Emend®IV。卫材公司Akynzeo®(奈妥吡坦/帕洛诺司琼)是NK-1受体拮抗剂和5-羟色胺3受体拮抗剂的复方制剂,2014年美国FDA批准该药。与此前获批的NK-1受体拮抗剂相比,罗拉吡坦血浆半衰期更长,高达180 h,且不作用于细胞色素P-450 CYP3A4酶,可与CYP3A4酶底物如特非那定(terfenadine)、阿司咪唑(astemizole)和西沙必利(cisapride)等合用[3]。
1.2 尿苷三乙酸酯
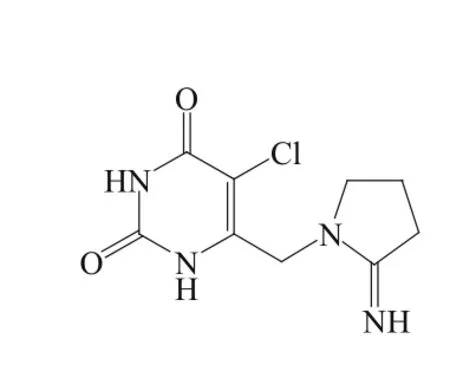
尿苷三乙酸酯(uridine triacetate)是尿嘧啶核苷的前药,可在体内水解为尿嘧啶核苷,该药由Wellstat Therapeutics公司开发,商品名Xuriden®。2015年9月4日美国FDA全球率先批准该药[4],作为遗传性乳清酸尿症(hereditary orotic aciduria)替代疗法,美国FDA批准该药同时授予了Wellstat Therapeutics公司一张优先审评券(Priority Review Voucher),依据2014年Wellstat Therapeutics公司与阿斯利康公司签订的协议,这张优先审评券被转让给阿斯利康公司。
Wellstat Therapeutics公司针对该适应证开展了一项开放性Ⅱ期临床研究(NCT02110147),共召募4名遗传性乳清酸尿症患者,患者年龄3至19岁。尿苷三乙酸酯代替尿嘧啶核苷给药6周,拓展研究延长给药至6个月,评价预先设定的血液参数稳定性,研究结果表明给药6周和6个月患者血液参数均稳定。
乳清酸尿症又称尿嘧啶核苷酸合成酶缺陷症(uridine monophosphate synthetase deficiency,UMPS deficiency)或乳清酸磷酸核糖转移酶和乳清酸核苷酸脱羧酶缺陷症(orotate phosphoribosyltransferase and OMP decarboxylase deficiency),是由于尿嘧啶核苷酸合成代谢过程中相关酶的缺失所致。患者体内乳清酸中磷酸核糖转移酶及乳清酸核苷酸脱羧酶缺乏或活性降低时,乳清酸磷酸核糖转移酶会催化乳清酸转变为乳清酸核苷酸,而乳清酸核苷酸脱羧酶又催化乳清酸核苷酸转变为尿嘧啶核苷酸。相关酶的异常,导致尿嘧啶核苷酸的合成被阻断,失去最终产物对合成代谢的抑制作用,导致乳清酸过度产生,尿中排出的乳清酸也增多,临床表现为遗传性乳清酸尿症。遗传性乳清酸尿症多见于近亲婚配所生的婴儿,出生5个月即发病,表现为低色素巨细胞性贫血,身体发育和智力发育障碍,目前该适应证全球已知患者数目约有20名[5]。
1.3 卡利拉嗪
卡利拉嗪(cariprazine)是一种多巴胺D2/D3受体激动剂,由匈牙利吉瑞大药厂(Gedeon Richter)开发,艾尔建公司拥有美国和加拿大开发上市销售权,商品名为Vraylar®。2015年9月17日,美国FDA全球率先批准该药,用于治疗成人躁狂发作或躁狂与抑郁混合发作的双相情感障碍Ⅰ型以及精神分裂症[6]。
卡利拉嗪属于非典型抗精神病药,与氯丙嗪、奋乃静等单纯作用于多巴胺D2受体的传统抗精神病药相比,卡利拉嗪还作用于多巴胺D3受体。精神分裂症根据临床症状不同分为Ⅰ型和Ⅱ型,Ⅰ型以阳性症状如幻觉、妄想、思维紊乱为主,Ⅱ型以阴性症状如情感淡漠、主动性缺乏、意志缺失等为主。传统抗精神病药对阳性症状疗效显著,对Ⅰ型精神分裂症疗效好,对Ⅱ型精神分裂症疗效较差甚至会加重病情。非典型抗精神病药包括硫利达嗪、氯氮平、舒必利、利培酮等,对阴性症状有效[7]。
2004年,森林实验室(Forest Laboratories)从匈牙利吉瑞大药厂获得卡利拉嗪在美国和加拿大开发上市销售权,药物代号RGH-188,当时在英国进行Ⅰ期临床研究。2014年阿特维斯收购森林实验室,获得该药开发上市销售权,2015年阿特维斯收购艾尔建并更名为艾尔建。
2012年11月森林实验室和匈牙利吉瑞大药厂向美国FDA首次提交新药上市申请(new drug application,NDA),申请基于超过1 700例精神分裂症患者和超过1 000例双相情感障碍Ⅰ型患者的临床研究结果,其中精神分裂症患者临床研究评价指标为阳性与阴性症状量表(positive and negative syndrome scale,PANSS),双相情感障碍Ⅰ型患者临床研究评价指标为杨氏躁狂量表(Young mania rating scale,YMRS),相比安慰剂对照,卡利拉嗪可显著降低PANSS和YMRS评分,改善患者症状。2013年11月,森林实验室和匈牙利吉瑞大药厂收到美国FDA的完全回应函(complete response letter,CRL),美国FDA声称认同卡利拉嗪的临床结果,但还需补充剂量优化方面的临床研究结果。2015年阿特维斯再次提交新药上市申请,美国FDA设立的处方药消费者付费法案(prescription drug user fee act,PDUFA)日期为2015年6月,美国FDA随后又延长PDUFA日期3个月,最后于2015年9月获批。
1.4 三氟胸苷/Tipiracil
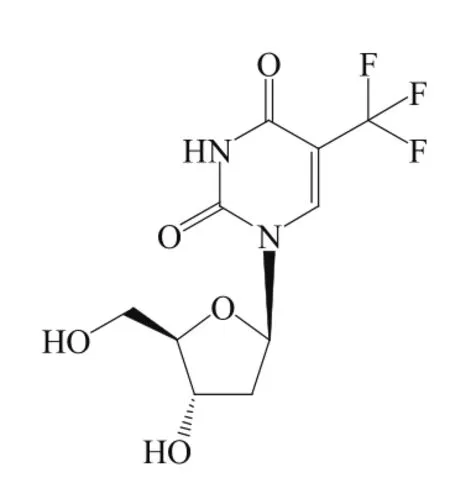
三氟胸苷(trifluridine,4)/ tipiracil(5)是一种新型抗代谢复方药物,由日本大鹏制药(Taiho Pharmaceutical)开发,药物代号TAS-102,商品名Lonsurf®,2014年3月日本全球率先批准该药。2015年9月22日,美国FDA批准Lonsurf®,用于对其他疗法(包括化疗和生物疗法)无效的难治性转移结直肠癌[8]。
4
5
三氟胸苷属于嘧啶核苷类似物,是DNA合成酶抑制剂,可干扰癌细胞DNA的合成;Tipiracil是胸苷磷酸化酶抑制剂,三氟胸苷是胸苷磷酸化酶的底物,抑制胸苷磷酸化酶可减少三氟胸苷降解,维持血药浓度,增强药效。
大鹏制药公司针对结直肠癌适应证开展了一项随机、双盲、安慰剂对照的Ⅲ期临床研究(NCT01607957),研究代号RECOURSE。RECOURSE研究共召募800名患者,研究结果显示Lonsurf组中位总生存期(median overall survival)相比安慰剂组长1.8个月(7.1个月vs 5.3个月,P < 0.001),达研究主要终点。
1.5 德谷胰岛素
德谷胰岛素(insulin degludec)是一种可溶性超长效基础胰岛素类似物,由丹麦诺和诺德公司(Novo Nordisk)开发,商品名Tresiba®,2012年在日本获全球首次批准。2015年9月25日,美国FDA批准Tresiba®,同一天美国FDA还批准了诺和诺德胰岛素类似物复方Ryzodeg®70/30(门冬胰岛素/德谷胰岛素),两药均可用于1型和2型糖尿病。
德谷胰岛素半衰期长达25 h,作用时长超过42 h,每周只需注射3次,效果与赛诺菲公司来得时(甘精胰岛素)类似,且低血糖事件发生率更低。2011年9月,诺和诺德首次向美国FDA提交新药上市申请,2012年美国FDA内分泌及代谢药物咨询委员会(Endocrinologic and Metabolic Drugs Advisory Committee)一致认定需补充心血管风险方面的研究结果,2013年2月,美国FDA拒绝批准该药,并发布完全回应函,要求诺和诺德进行心血管风险方面的研究,2013年10月,诺和诺德开展了心血管风险方面的DEVOTE研究(NCT01959529)。基于一系列BEGIN研究结果和DEVOTE研究中期分析结果,美国FDA最终批准Tresiba®,基于一系列BOOST研究结果和DEVOTE研究中期分析结果,美国FDA最终批准Ryzodeg®70/30。
2 2015年9月欧盟新批准药物
2015年9月,欧盟委员会(European Commission,EC)共批准11个药物,包括1个全球首次批准的新生物制品(sebelipase alfa),1个全球首次批准的药械组合(Zalviso®),4个新增适应证药物和5个欧盟首次批准药物(见表2)。

表2 2015年9月欧盟新批准药物Table 2 New drugs approved by European Commission in September 2015
Kanuma®(sebelipase alfa)即重组人溶酶体酸性脂肪酶,由Synageva BioPharma公司开发,2015年瑞颂(Alexion)公司以84亿美元收购Synageva BioPharma公司获得该药开发上市销售权利。欧盟委员会于2015年9月1日率先批准Kanuma®,作为溶酶体酸性脂肪酶缺乏症(Lysosomal acid lipase deficiency,LAL deficiency)酶替代疗法。同期批准的还有瑞颂公司低磷酸酯酶症(Hypophosphatasia)酶替代疗法Strensiq®(asfotase alfa)。
溶酶体酸性脂肪酶缺乏症又称Wolman病,是1956年Wolman最先描述的一种隐性遗传病。由于溶酶体酸性脂肪酶缺乏,导致胆固醇酯、甘油三酯在肝、脾、肾上腺和肠黏膜贮积,肾上腺广泛钙化。常于出生后数周发病,病程发展迅速,主要表现为腹泻、呕吐、肝脾肿大、贫血等,患者常于2~4个月内死亡[9]。此前无特效疗法,Kanuma®(sebelipase alfa)是针对该适应证的首个药物。
3 2015年9月日本批准新药
2015年9月,日本厚生劳动省(Ministry of Health,Labour and Welfare,MHLW)共批准21个药物,其中包括3个全球首次批准的新分子实体(奥泽沙星、lusutrombopag和奥格列汀),1个全球首次批准的新有效成分(艾氟洛芬),6个新增适应证药物和10个日本首次批准药物(见表3)。
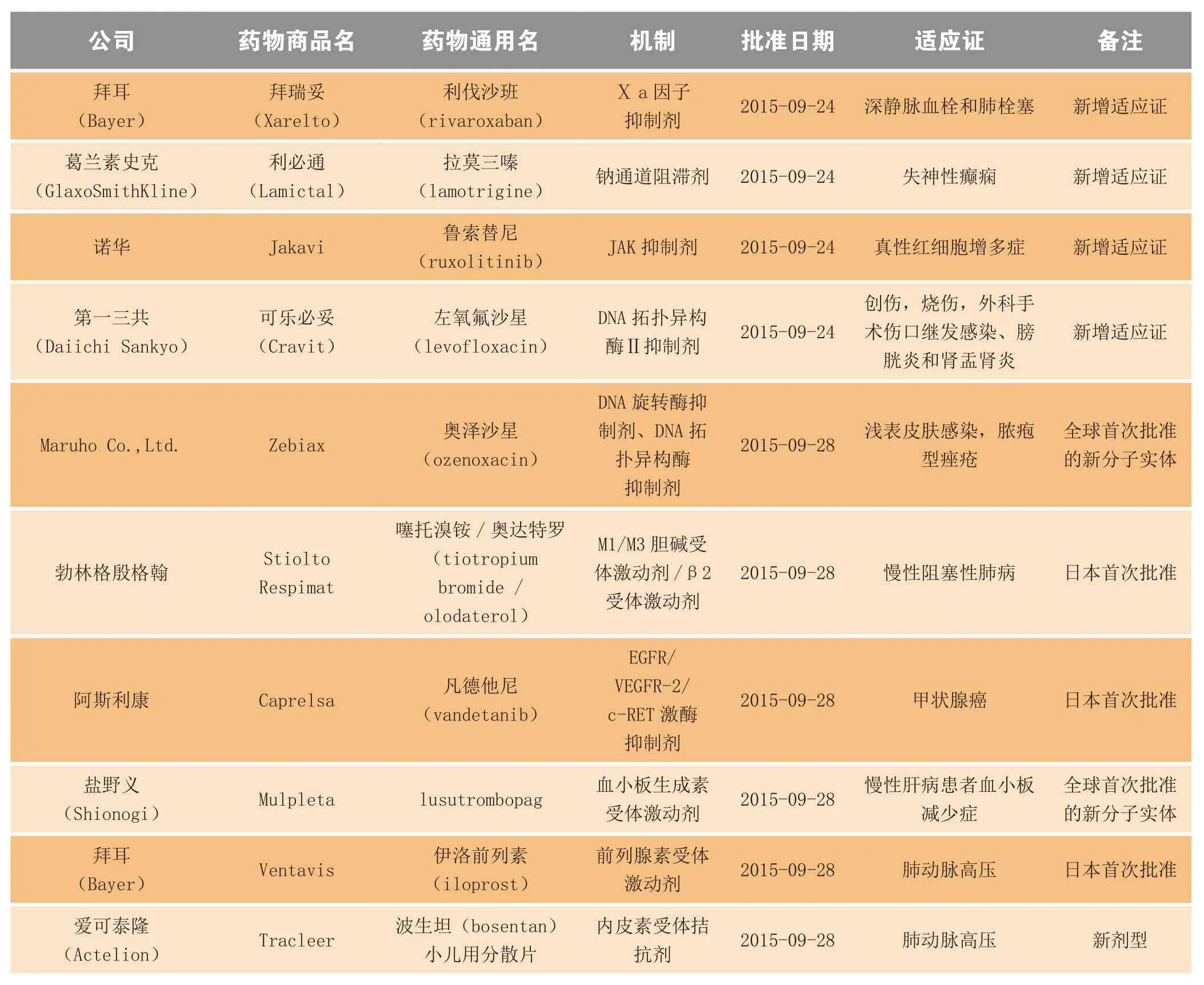
表3 2015年9月日本新批准药物Table 3 New drugs approved in Japan in September 2015

续表3
3.1 奥泽沙星
奥泽沙星(ozenoxacin,6)是一种非氟喹诺酮类抗菌药物,作用于DNA旋转酶和DNA拓扑异构酶,对革兰阳性菌有效。奥泽沙星由西班牙Ferrer公司开发,富士胶卷公司子公司Toyama化学首先获得该药日本地区开发上市销售权,后又转让给日本Maruho公司。日本厚生劳动省于2015年9月28日全球率先批准该药,用于治疗浅表皮肤感染及脓疱型痤疮,商品名Zebiax®。

6
奥泽沙星是继奈诺沙星(nemonoxacin)、加雷沙星(garenoxacin)后全球第3个获批的非氟喹诺酮类抗菌药物。传统氟喹诺酮类由于母核6位含有氟,可能引起肝脏毒性和光毒性等不良反应,非氟喹诺酮类药物的不良反应更低,抗菌谱更广,并对耐甲氧西林金黄色葡萄球菌(MRSA),耐万古霉素的金黄葡萄球菌(VRSA),耐喹诺酮类药物金黄葡萄球菌(QRSA),耐青霉素肺炎链球菌(PRSP),喹诺酮耐药肺炎链球菌(QRSP)等耐药菌有很强的活性。
Ferrer公司开展了一项针对脓疱型痤疮患者的随机、多中心、双盲、安慰剂对照的Ⅲ期临床研究,共召募465人,研究结果显示,用药6~7 d,奥泽沙星乳膏1%组相比于安慰剂对照组的临床成功率(clinical success rate)显著提高(34.8% vs 19.2%,P = 0.003);第1次用药后6~7 d,奥泽沙星乳膏1%组与安慰剂组微生物学成功率(microbiological success rate)分别为79.2%和56.6%,第2次用药后3~4 d,奥泽沙星乳膏1%组与安慰剂对照组微生物学成功率分别为70.8%和38.2%[10]。
该药美国开发上市销售权归Medimetriks Pharmaceuticals公司所有,加拿大开发上市销售权归Cipher Pharmaceuticals公司所有,已计划在美国、加拿大和欧洲提交新药上市申请。
3.2 Mulpleta®
Lusutrombopag(7)是一种血小板生成素(Thrombopoietin,TPO)受体激动剂,由日本盐野义公司开发,2015年9月28日,日本厚生劳动省率先批准该药,用于治疗慢性肝病患者血小板减少症,商品名Mulpleta®。
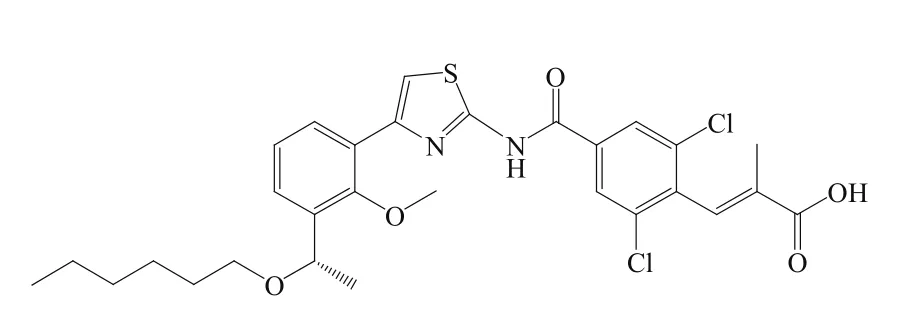
7
血小板生成素又称巨核细胞生长与发育因子或巨核细胞生成素,是一类主要作用于血小板生成的生理调节性造血生长因子。TPO主要来源于肝、肾和骨骼肌细胞,对巨核细胞生成的各阶段均有刺激作用,包括前体细胞的增殖和多倍体巨核细胞的发育及成熟,并分裂形成有功能的血小板,从而升高血小板数目。
Lusutrombopag是继艾曲波帕(eltrombopag)、罗米司亭(romiplostim)后获批的第3个血小板生成素受体激动剂,艾曲波帕最早于2008年在美国获批,已陆续获批用于治疗血小板减少症、再生障碍性贫血和特发性血小板减少性紫癜,罗米司亭于2008年在澳大利亚获批治疗免疫性血小板减少性紫癜,随后在美国、欧洲等地获批。
盐野义公司针对该适应证开展了两项随机、多中心,双盲的Ⅲ期临床研究(L-PLUS 1/L-PLUS 2),两项研究已分别于2014年和2015年达到临床主要终点。
3.3 奥格列汀
奥格列汀(omarigliptin,8)是一种小分子二肽基肽酶-4(dipeptidyl peptidase-4,DPP-4)抑制剂,由默沙东公司开发,2015年9月28日,日本厚生劳动省全球率先批准奥格列汀每周口服2次治疗2型糖尿病。
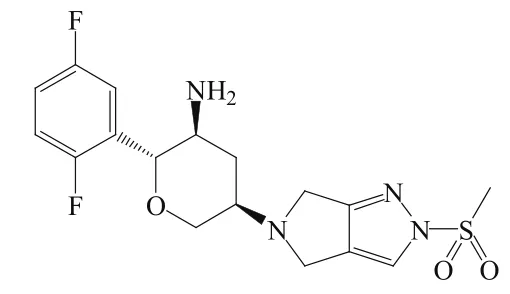
8
2014年11月,默沙东向日本药品和医疗器械局(Pharmaceuticals and Medical Devices Agency,PMDA)提交新药上市申请,该申请基于一项在日本完成的Ⅲ期临床研究(NCT01703221)结果,研究共召募414名2型糖尿病患者,奥格列汀用药24周降低糖化血红蛋白(HbA1c)水平明显优于安慰剂,且不劣于默沙东已上市的DPP-4抑制剂捷诺维®(西格列汀)。
默沙东公司的西格列汀(sitagliptin)是首个获批的DPP-4抑制剂,2006年在美国获批,国内也已上市。随后诺华公司的维达列汀(vildagliptin)、百时美施贵宝公司的沙格列汀(saxagliptin)、日本武田公司的阿格列汀(alogliptin)、勃林格殷格翰公司的利格列汀(linagliptin)、日本兴和公司的安奈格列汀(anagliptin)、日本田边三菱公司的替格列汀(teneligliptin)和日本武田公司的曲格列汀(trelagliptin)也相继获批上市。
胰高血糖素样肽-1(GLP-1)和抑胃肽(GIP)是由消化道生成的激素,两者负责食物摄入和控制血糖的功能,当摄入葡萄糖时,这些激素会引起胰岛素释放增加,随后血糖降低,研究显示这2种激素还有抑制胰高血糖素分泌和减缓胃排空的功能。然而GLP-1并不稳定,易被DPP-4降解,DPP-4抑制剂可以延长GLP-1和GIP的半衰期,从而控制2型糖尿病患者血糖水平[11]。
3.4 艾氟洛芬
艾氟洛芬(esflurbiprofen,9)即氟比洛芬(flurbiprofen)的S-异构体,是一种非甾体抗炎药,通过抑制环氧合酶(cyclooxygenase,COX)的活性从而达到消炎镇痛的目的。艾氟洛芬贴剂由日本大正制药公司(Taisho Pharmaceutical)开发,2015年9月28日日本厚生劳动省全球率先批准艾氟洛芬贴剂,用于治疗骨关节炎。
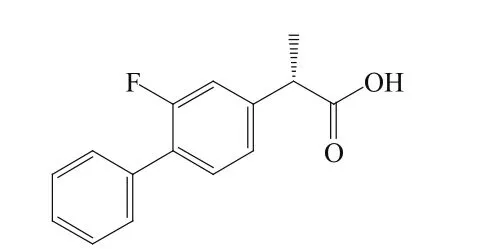
9
日本大正制药公司针对骨关节炎开展了一项Ⅲ期临床研究,共召募633名膝骨关节炎患者,视觉模拟评分法(visual analogue scale,VAS)为评价指标,研究结果显示,艾氟洛芬贴剂组VAS可降低40.9 mm,氟比洛芬贴剂对照组VAS降低30.6 mm,表明艾氟洛芬效果优于氟比洛芬。为期52周的Ⅲ期临床拓展研究共201名已经接受艾氟洛芬治疗的骨关节炎患者参加,临床结果显示80%的患者长期使用耐受性良好[12]。
[1]TESARO. TESARO announces U.S. FDA Approval of VARUBI(TM)(rolapitant) for nausea and vomiting associated with cancer chemotherapy [EB/OL]. (2015-09-02)[2015-09-03]. http://ir.tesarobio. com/releasedetail.cfm?ReleaseID=929869.
[2]Jordan K, Jahn F, Aapro M. Recent developments in the prevention of chemotherapy-induced nausea and vomiting (CINV): a comprehensive review[J]. Ann Oncol, 2015, 26(6): 1081-1090.
[3]翁玲玲. 临床药物化学[M].北京:人民卫生出版社, 2007:154-155.
[4]FDA. FDA approves new orphan drug to treat rare autosomal recessive disorder [EB/OL]. (2015-09-04)[2015-09-05]. http://www.fda.gov/ NewsEvents/Newsroom/PressAnnouncements/ucm457867.htm.
[5]张子彦.遗传性血液病学[M].北京:科学技术文献出版社, 2012:38-39.
[6]Allergan. Allergan and Gedeon Richter Plc. receive FDA approval of VRAYLAR™ (cariprazine) for treatment of manic or mixed episodes of bipolar I disorder and schizophrenia in adults[EB/OL]. (2015-09-17)[2015-09-18]. http://www.allergan.com/NEWS/News/Thomson-Reuters/ Allergan-and-Gedeon-Richter-Plc-Receive-FDA-Approv.
[7]毛理纳, 李秀丽. 药理学[M]. 2版. 郑州: 河南科学技术出版社,2012: 93-95.
[8]Taiho. Taiho Oncology, Inc. announces FDA approval of LONSURF®(trifluridine and tipiracil) for refractory metastatic colorectal cancer (mCRC)[EB/OL]. (2015-09-22) [2015-09-23]. https://www. taihooncology.com/us/newsroom/press-releases/Taiho-Oncology-Inc-Announces-FDA-Approval-of-LONSURF-for-Refractory-Metastatic-Colorectal-Cancer.
[9]王季午, 何南祥. 实用肝脏病手册[M]. 杭州: 浙江科学技术出版社,1990: 408-409.
[10]Savion G, Nuria A, Klaus C, et al.Ozenoxacin 1% cream in the treatment of impetigo: a multicenter, randomized, placebo- and retapamulincontrolled clinical trial[J]. Future Microbiol, 2014, 9(9): 1013-1023.
[11]Biftu T, Sinha-Roy R, Chen P, et al. Omarigliptin (MK-3102): a novel long-acting DPP-4 inhibitor for once-weekly treatment of type 2 diabetes[J]. J Med Chem, 2014, 57(8): 3205-3212.
[12]Taisho. Notice concerning announcement of results of phase 3 clinical trials of TT-063 anti-inflammatory analgesic patch formulation containing S-furbiprofen at the annual meeting of the Japanese clinical orthopaedic association[EB/OL]. (2015-07-21) [2015-09-29]. http:// www.taisho.co.jp/en/company/release/2015/2015072101-e.html.
An Overview of New Drugs Approved in the US, EU and Japan in September 2015
SUN Yousong
In September 2015, US Food and Drug Administration (FDA), European Commission, and Ministry of Health, Labour and Welfare(MHLW) of Japan had totally approved 46 new drugs, including new molecular entities, new active ingredients, new biologics and new line extensions(new indications and new formulations). In this article, the results of clinical trials and development histories of those new molecular entities, new active ingredients and new biologics that reached their frst market worldwide were summarized and the key events in global new drug development were also introduced.
drug approval; clinical trial; new molecular entity; new biologics
R97
A
1001-5094(2015)09-0703-09

