骨质疏松症的药物治疗研究进展
王芳,刘伟,闫利颖,于宝辉,王海盛
(扬子江药业集团北京海燕药业有限公司,北京 102206)
骨质疏松症的药物治疗研究进展
王芳,刘伟,闫利颖,于宝辉,王海盛*
(扬子江药业集团北京海燕药业有限公司,北京 102206)
骨质疏松症是一种全身性的骨代谢疾病,其主要特征是骨量减少、骨质微观结构退化,可导致各种脆性骨折,具有高发病率、高致残率和高死亡率的特点,已日渐成为全球性公共健康问题。近年来,科研人员积极研究安全有效的抗骨质疏松的治疗新方法。对骨质疏松症的药物治疗研究进展进行综述,为临床医务工作人员用药及相关药物研发提供参考。
骨质疏松症;促进骨形成药物;抗体;c-Src激酶抑制剂
骨质疏松症(osteoporosis,OP)是一种全身性的骨代谢疾病,由多种原因引起,其主要特征是骨量减少、骨质微观结构退化,可导致各种脆性骨折,以腰椎、髋骨和腕骨骨折多见。骨质疏松症已成为世界范围的一个主要健康问题,全世界有骨质疏松患者2亿多人,接近总人口的3%[1],由骨质疏松造成的骨折患者有130万~160万人。据统计,我国骨质疏松患者在6 000万~8 000万之间,女性患病率是男性的6~8倍,骨质疏松并发骨折患者高达10%以上。我国治疗骨质疏松药物市场从2010—2015年复合增长率将达到13.5%,药品销售额可达25亿美元。
骨质疏松症根据不同病因可分为三类:原发性骨质疏松症、继发性骨质疏松症和特发性骨质疏松症。原发性骨质疏松症是一种年龄相关性退行性病变,包括Ⅰ型妇女绝经后骨质疏松症和Ⅱ型老年性骨质疏松症[2];继发性骨质疏松症是由外因所诱发的骨质疏松症;特发性骨质疏松症多发于特定人群,如妊娠妇女及哺乳期女性或8~14岁的青少年,女性多于男性。
骨质疏松症的高发人群是老年人特别是老年女性,由于绝经后女性体内激素水平急剧降低,导致钙流失加剧从而极易患上骨质疏松症。年轻人通常不会发生骨质疏松,但对于城市中的年轻人,因室内工作时间长、体育锻炼不足、光照不足等因素,其体内维生素D缺乏,亦会患有骨质疏松症。
骨质疏松症的治疗和预防方法包括物理学疗法、运动疗法、食物疗法、药物疗法、矫形外科疗法、预防跌倒(老年人最严重的股骨颈骨折90%以上是由于跌倒所致)、中医药疗法和电磁治疗。以下对该疾病的药物疗法进行介绍。
1 促进骨矿化药物
1.1 钙制剂
使用钙制剂治疗是预防骨质疏松症最常见的方法,无机钙(如碳酸钙)是常用制剂,而有机钙效果更佳,如氨基酸螯合钙治疗老年妇女骨质疏松症有效率明显优于其他类型钙剂。有机钙生物利用度高,其以生物螯合物形式存在,稳定性好,溶解度、吸收度高,不易与食物中草酸结合,且副作用较小。一般钙剂因碱性过强,或可导致消化不良、便秘或腹泻等副作用,而氨基酸螯合钙的这种副作用很小[3]。刘晓芳等[4]用回顾性分析法分析了1992—2007年关于补充钙剂及钙剂联合其他药物对绝经后妇女骨质疏松预防效果的研究文献,发现单纯补充钙剂对预防45~70岁白种人及黄种人妇女的骨质疏松有效,而钙剂联用雌激素和(或)孕激素、维生素D3、降钙素预防骨质疏松的效果较单用钙剂更好。
1.2 维生素
骨质疏松的一个重要发病原因就是Ca2+在体内吸收不良,维生素D3可促进肠道对Ca2+的吸收以及促进肾脏对钙、磷的重吸收。研究发现维生素D3可以增加骨密度,对于降低绝经后妇女跌倒率和非脊柱骨折发生率都有较好效果[5]。然而,维生素D3在预防原发性老年性骨质疏松中的效果往往不太理想,因为缺乏维生素D3的现象并不常见,但作为一种辅助治疗手段,足量的维生素D3对于保持最佳疗效是必要的。
维生素K参与合成维生素K依赖蛋白质(BGP),BGP能调节骨骼中磷酸钙的合成。特别是对于老年人而言,其骨密度和维生素K呈正相关。常摄入大量含维生素K的绿色蔬菜能有效降低骨折风险。
2 促进骨形成药物
2.1 甲状旁腺激素
甲状旁腺激素(parathyriodhormone,PTH)具有双重作用,小剂量可以促进骨形成,大剂量时可促使破骨细胞前体细胞和间质细胞向破骨细胞转化,活化破骨细胞,促进骨基质和骨盐溶解。特立帕肽(teriparatide,rhPTH1-34)为重组人甲状旁腺激素,由礼来公司开发[6],可通过增加成骨细胞的活性及数量而促进骨生长,2002年经FDA批准在美国上市,也是首个获FDA批准的促进骨形成药物。本品适用于患骨质疏松症、有高度骨折危险的绝经期妇女,亦适用于有高度骨折危险的原发性或性腺机能减退性骨质疏松症男性患者。
Abaloparatide(1)是用于治疗绝经后骨质疏松的注射剂,其为甲状旁腺激素相关蛋白的合成肽类似物。Ⅲ期临床研究考察了Abaloparatide是否可减少有严重骨质疏松的绝经后妇女的骨折风险,受试者分别接受Abaloparatide(80 μg,n=690)和安慰剂(n=717),所有患者同时接受钙剂和维生素D补充剂。在超过18个月的治疗后,X射线显示Abaloparatide组患者椎骨或脊柱骨折率大大减少;Abaloparatide组患者新椎体骨折率为0.58%,明显低于安慰剂组(新椎体骨折率为4.2%);此外,Abaloparatide组患者非椎骨(包括髋关节、腕关节、股骨颈)骨折率比安慰剂组降低43%[7]。
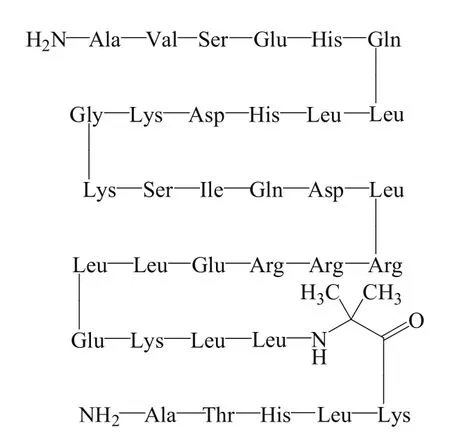
1
2.2 他汀类药物
他汀类药物通过调节骨形成蛋白(BMP)-2促进骨形成,另一方面可以使破骨细胞活性受到抑制,从而提高骨密度,且脂溶性他汀比水溶性他汀的骨保护作用更强。临床试验表明:使用他汀类药物的患者股骨骨密度升高,骨折风险降低[8]。他汀类代表药物有:洛伐他汀、辛伐他汀、匹伐他汀、罗苏伐他汀等。然而,他汀类药物对骨代谢影响的分子机制尚未被阐明,且目前临床应用的他汀药物主要作用于肝脏,口服后在骨骼中的分布浓度很低,因此该类药物的临床应用还存在一些问题。
2.3 氟化物
氟对骨有高度亲和性,其可取代羟磷灰石形成氟磷灰石,而氟磷灰石不易被破骨细胞溶解吸收,从而增加骨强度。氟的另一个作用是可以刺激成骨细胞有丝分裂,增加其数量和活性,从而促进骨形成。氟化物与其他药物联合使用可升高骨密度,减少骨折发生率,如氟化物与双膦酸盐类或雷诺昔芬联合应用,其疗效比单独应用氟化物明显要好[9]。
2.4 人类硬化蛋白单克隆抗体Romosozumab
骨硬化蛋白几乎只在成骨细胞中表达,是一种由骨细胞分泌的成骨细胞活性抑制因子,故而成为抗骨质疏松的首选靶标。单克隆抗体Romosozumab可与硬化蛋白结合,抑制其活性,从而增加骨形成。2011年,关于Romosozumab的第一项由健康男性和绝经后妇女参加的随机、双盲、安慰剂对照的临床实验结果表明,使用Romosozumab的受试者,其骨吸收标志物水平有所降低,同时骨形成标志物的水平呈剂量依赖性增加,且Romosozumab展现出较好的临床安全性与耐受性。Ⅱ期临床试验结果显示,Romosozumab可增加绝经后低骨量女性的骨密度和骨形成,并能减少骨吸收,表明硬化蛋白抗体治疗骨质疏松症具有良好的应用前景[10]。安进(Amgen)公司与合作伙伴UCB公司于2015年公布了针对romosozumab进行的一项名为STRUCTURE的多中心、随机、开标记、特立帕肽对照的Ⅲ期研究阳性数据。该研究在绝经后骨质疏松症女性患者中开展,比较了romosozumab与特立帕肽的安全性、耐受性及疗效。研究中,共436例先前接受过双膦酸盐治疗的患者,分别接受romosozumab(210 mg,sc,每月1次)或特立帕肽(20 μg,sc,qd),直至第12个月。结果显示,romosozumab治疗绝经后女性骨质疏松症的疗效显著优于特立帕肽,数据具有显著性差异,达到了研究的主要指标;各治疗组整体不良事件发生率总体平衡;详细数据尚未公布[11]。
3 骨吸收抑制剂
3.1 雌激素类药物
绝经后妇女体内雌激素水平急剧下降,导致体内钙大量流失,从而诱发绝经后骨质疏松症,大约一半的绝经后妇女都不同程度患有骨质疏松症。雌激素及其类似物一方面能够结合骨组织中雌激素受体,促进成骨细胞增殖,另一方面可促进维生素D3的生成和降钙素的合成[12]。然而,长期使用雌激素会导致乳腺癌、脑卒中和心脏病的患病风险增加[13]。
7-甲基异炔诺酮(替勃龙)具有雌激素样活性,可明显降低骨转化,增加骨密度,在临床上被广泛用于预防和治疗骨量丢失,每日低剂量(1.25 mg)口服本品就可以起到保持骨量、降低骨折发生率的作用[14]。
尼尔雌醇属于雌三醇的衍生物,动物实验及临床实践均证实尼尔雌醇可以治疗绝经后骨质疏松症[15-16],然而,由于尼尔雌醇具有使子宫内膜增生的危险,因此临床上需对其益处与风险进行综合考虑。
3.2 植物雌激素
植物雌激素(phytoestrogen,PE)来源于植物、水果和蔬菜,它能与雌激素受体结合,具有类似动物雌激素样生物活性。
植物雌激素的代表化合物为异黄酮(isoflavone),它是雌激素的天然替代品,其具有雌激素样作用但无明显雌激素样副作用。由于异黄酮主要来源于大豆及其制品中,因此俗称大豆异黄酮。大豆异黄酮能增加骨密度,维持骨的柔韧性,从而减少骨折的发生[17]。依普拉芬(ipriflavone)是一种理想的抗骨质疏松药物,能抑制骨吸收,同时增加骨形成并改善骨强度,防止骨折发生。依普拉芬作用机制与雌激素类似[18],此外还具有促进成骨细胞增殖、促进骨胶原形成和矿化、增加骨量的作用[19]。
3.3 选择性雌激素受体调节剂
选择性雌激素受体调节剂(selective estrogen receptor modulators,SERM)是人工合成的非激素制剂,已被用作抗骨质疏松一线用药,其治疗效果与雌激素相似,且对乳腺、心脏等没有潜在毒副作用。
1998年,FDA批准上市了选择性雌激素受体调节剂雷洛昔芬[20],其能够选择性阻断雌激素受体构象的改变,对不同组织中的雌激素受体表现出不同的激动或拮抗活性[21]。雷洛昔芬能改善骨密度和骨转换指标,减少骨折风险,同时减少转移性乳腺癌风险[22]。同类药物还有:他莫昔芬(2005年上市),巴多昔芬(2013年上市),奥培米芬(2013年上市)。2013年10月,FDA批准Duavee(共轭雌激素/巴多昔芬)用于绝经后骨质疏松症的预防。FDA指出,这款药物是首款将雌激素与雌激素受体调节剂结合在一起的产品,不仅能有效预防骨质疏松,还可降低子宫内膜增生的风险。
3.4 降钙素
降钙素(caicitonin,CT)具有抗骨吸收作用,其注射剂和鼻喷剂均获FDA批准,用于治疗骨质疏松症。降钙素能与破骨细胞受体结合,直接抑制破骨细胞对骨的吸收,同时促进骨骼吸收血浆中的钙,使血钙降低。此外,降钙素还可以作用于神经中枢特异性受体,升高内啡肽水平,具有止痛的功效[23]。
3.5 双膦酸盐类
双膦酸盐类(bisphosphonates,BPs)药物是一类非生物性焦磷酸盐衍生物,是目前应用最广泛的能明显抑制骨吸收的药物,可作为大多数骨质疏松患者的首选药物[24-25]。主要包括伊班膦酸盐、阿仑膦酸钠、依替膦酸钠、唑来膦酸、帕米膦酸钠、利塞膦酸盐和米诺膦酸等[26-27]。有研究报道,利塞膦酸盐对胃的副作用小于阿仑膦酸盐和米诺膦酸,可能比其他双膦酸盐类药物安全性更高[28]。伊班膦酸钠能特异地作用于骨组织,其适应证为伴有或不伴有骨转移的恶性肿瘤引起的高钙血症。部分制药公司也在开发其另一适应证——骨质疏松症。2015年3月30日,中外制药(Chugai)和大正制药(Taisho)宣布伊班膦酸钠水合物口服制剂在日本进行的治疗骨质疏松症的Ⅲ期临床试验获阳性结果。该结果最先公布于国际骨质疏松基金会目前在意大利米兰举行的世界骨质疏松症、骨关节炎和肌肉骨骼疾病世界大会上。大会上介绍了约400名超过55岁的骨质疏松症患者参加、名为MOVEST的多中心、随机、双盲、平行、对照的研究,评估伊班膦酸钠口服制剂(100 mg)的安全性和有效性,其中对照组受试者静脉注射伊班膦酸钠注射液(商品名:Bonviva®,规格:1 mg)。该研究达到了主要指标,即12个月时伊班膦酸钠口服制剂组受试者脊柱腰椎(L2~L4)的骨矿物质密度(BMD)较治疗前增长了5.22%(95%置信区间:4.65%~5.80%),注射液组为5.34%(95%置信区间:4.78%~5.90%)。伊班膦酸钠口服制剂相比于伊班膦酸钠注射液的非劣效结果已被证实。第2个指标即股骨骨密度和骨代谢标志物也表现出类似结果。安全性与以往的全球研究结果一致,骨质疏松患者对伊班膦酸钠口服制剂表现出良好耐受性。基于上述数据和其他数据,中外制药在日本提交伊班膦酸钠口服制剂治疗骨质疏松症的新药申请[29]。
唑来膦酸属于第三代双膦酸药物[30],每年只需1次静脉注射就可以起到降低骨转化的作用,降低了口服药物所导致的不良反应,患者的耐受性大大提高[31]。
由韩国YUYU公司研发的一种新型人工合成的用于治疗骨质疏松症的阿仑膦酸钠+骨化三醇合剂,于2004年在韩国上市。阿仑膦酸钠可以提高骨质量和骨容量,而骨化三醇可以提高成骨细胞的活性、增加肠道钙吸收、提高肌肉质量,因此两者具有协同作用[32],此外,阿仑膦酸钠骨化三醇片对胃肠道黏膜的损伤小于阿仑膦酸钠,且服药依从性更高[33]。
3.6 抗体药物
狄诺塞麦(denosumab,AMG-162)是一种人源性的单克隆抗体,FDA于2009年批准其用于治疗绝经后骨质疏松[34],并被美国临床内分泌医师学会列为妇女绝经后骨质疏松症诊疗指南中的一线用药[35]。本品可靶向作用于核因子κB受体活化因子(receptor activator of nuclear factor kappa B,RANK)/ RANK配体(RANK ligand,RANKL)系统,对RANKL有高度亲合力,可竞争性抑制RANK和RANKL结合,抑制破骨细胞分化,从而减少骨吸收,其作用类似于骨保护素[36]。目前正在中国进行狄诺塞麦的两项临床研究,一项是狄诺塞麦在中国健康成年人中安全性、药代动力学和药效学研究(登记号:CTR20131298),另一项是狄诺塞麦用于治疗骨折风险增加的绝经后骨质疏松症妇女的研究(登记号:CTR20130903)。
纳米抗体是由骆驼血清中存在的一种天然缺失轻链的重链抗体经克隆其可变区获得的相对分子质量为15 000的椭圆形单域抗体[37]。纳米抗体由Ablynx公司研发,具有相对分子质量小、可溶性好、稳定性强、易表达等优点。纳米抗体在疾病的检测和治疗方面都有显著应用成果[38-40]。目前,与骨质疏松症治疗有关的纳米抗体主要为ALX-0141,该药为一种特异性靶向RANKL配体的药物。一项针对健康的绝经期妇女的临床试验结果显示,单次使用ALX0141对骨重吸收生物标记物具有强效和长期的抑制作用。病人耐受性良好,未见严重毒副作用或剂量限制性毒性反应。
3.7 组织蛋白酶K抑制剂
组织蛋白酶K是骨吸收过程中的一个关键酶,为破骨细胞中表达量最高、溶骨活性最强的一种半胱氨酸蛋白酶。它与骨质疏松症关系密切,其药效学特点是在不影响骨形成的同时抑制骨吸收。组织蛋白酶K抑制剂在治疗和预防骨质疏松症方面有明显的临床价值和市场前景,已经成为治疗骨质疏松症的一种新型治疗方法[41]。
3.7.1 奥达卡替 默沙东公司研发的奥达卡替(odanacatib)为组织蛋白酶K的选择性可逆性抑制剂,可快速降低骨吸收。为期2年的Ⅱ期临床试验比较了每周口服1次安慰剂或奥达卡替3、10、25和50 mg(所有受试者均同时接受维生素D3和钙剂治疗)对骨密度和骨转换生化指标的影响。结果表明,接受奥达卡替的受试者其骨密度呈剂量依赖性增加,50 mg剂量组受试者骨密度增加程度最为明显,与安慰剂组相比,腰椎和全髋骨密度分别增加了5.5%和3.2%。奥达卡替耐受性好,该组受试者与安慰剂组相比无明显不良反应[42]。2014年9月,默沙东宣布奥达卡替治疗16 714例被确诊为骨质疏松症且绝经至少5年的妇女(65岁及以上)的骨质疏松症的Ⅲ期临床试验达到主要指标,与安慰剂组相比,奥达卡替组新发和不断恶化的脊椎骨折相对风险降低54%(P<0.001)、临床髋部骨折相对风险降低47%(P<0.001)、临床非脊椎骨折相对风险降低23%(P<0.001)、临床脊椎骨折相对风险降低72%(P<0.0001)。此外,奥达卡替组患者腰椎和髋骨骨矿物质密度(BMD)在治疗5年内逐步增加[43]。在另一项针对男性骨质疏松症的研究中,奥达卡替也显示出令人满意的效果[44]。
3.7.2 ONO-5334 ONO-5334由日本小野制药公司研制,目前已进入Ⅲ期临床试验阶段。在名为OCEAN的欧洲临床研究中发现,ONO-5334与阿仑膦酸钠相比,对骨生成标志物基本没有影响,且ONO-5334和阿仑膦酸钠对骨再吸收标志物有类似的抑制作用[45]。
4 双重作用机制药物
锶盐(strontium)代表药物雷奈酸锶是具有双重作用(既能抑制骨吸收又能促进骨形成)的抗骨质疏松药物。雷奈酸锶由法国施维雅公司研发,2004年11月在爱尔兰首次上市,同年12月在英国上市。雷奈酸锶可降低破骨细胞活性、减少破骨细胞分化、诱导其凋亡,进而抑制骨吸收,同时增强成骨细胞前体细胞的增殖和分化,并能持续提高骨密度,对多部位均有抗骨折作用[46]。
5 c-Src激酶抑制剂
c-Src激酶是一种膜相关蛋白,能够活化破骨细胞,并且对成骨细胞活化进行负调控。c-Src激酶在骨稳态中起着关键作用[47],其介导的信号通路与骨质疏松症的发生、发展有密切关系,因此,c-Src激酶抑制剂已成为治疗骨质疏松症的研究方向之一。
AP23451是由美国ARIAD制药集团研制的一种骨组织高度选择性的二碳磷酸盐化合物,其具有骨组织高度选择性,ELISA试验结果显示,AP23451抑制Src激酶的IC50值为68 nmol·L-1[48]。在动物体内进行的研究表明,AP23451具有抑制骨吸收、刺激骨形成的作用。
塞卡替尼(saracatinib,AZD0530)是一种c-Src激酶抑制剂,可使破骨细胞活性受到抑制。一项共有59位健康年轻男性受试者参加的Ⅰ期临床试验结果显示,受试者使用塞卡替尼25天后,血清中Ⅰ型胶原C末端肽和尿液中Ⅰ型胶原N末端肽的含量分别降低了88%和67%,且呈剂量依赖性[49]。塞卡替尼组的不良反应发生率与对照组基本相近;塞卡替尼组发生率较高的不良反应为皮疹和稀便,分别为30%和24%,对照组分别为6%和0%。目前尚无塞卡替尼用于治疗骨质疏松的最新进展,有报道称一项Ⅱa期临床研究正在考察该药用于另一适应证——阿尔茨海默病的疗效[50]。
达沙替尼(dasatinib)是一种口服有效的c-Src抑制剂,FDA于2006年2月批准该药用于治疗慢性髓性白血病。曾有研究报道称,达沙替尼对破骨细胞和骨吸收有明显抑制作用[51]。然而,尚未见达沙替尼用于治疗骨质疏松症的最新研究进展。
6 结语
骨质疏松症是人口老龄化进程中一种非常普遍的慢性疾病,随着对骨质疏松症在病理生理机制更深入的了解,多种极具潜力的新型治疗药物被成功研发,将对骨质疏松性骨折的防治有很大的改善,从而最大限度降低骨质疏松患者的骨折风险。未来,随着新靶点、新的治疗机制、新的药物剂型、新的给药方式以及联合用药的不断发展,相信会有更多高效低毒的药物进入临床,造福广大骨质疏松症患者。
[1]赵燕玲, 潘子昂, 王石麟, 等. 中国原发性骨质疏松症流行病学[J].中国骨质疏松杂志, 1998, 4 (1): 1-4, 27.
[2]中国老年学学会骨质疏松委员会手册编写专家组. 中国人群骨质疏松诊疗手册(2007年版)[J]. 中国骨质疏松杂志, 2007(增刊): 1-67.
[3]邵利民. 氨基酸螯合钙治疗老年妇女骨质疏松症临床对比观察[J].实用妇科杂志, 2004, 20 (4): 254.
[4]刘晓芳, 许良智. 补充钙剂对绝经后妇女骨质疏松的预防作用[J].中华妇幼临床医学杂志, 2009, 5 (1): 42-47.
[5]Porthouse J, Cockayne S, King C, et al. Randomised controlled trial of calcium and supplementation with cholecalciferol (vitamin D3) for prevention of fractures in primary care [J]. BMJ, 2005, 330 (7498):1003.
[6]Kaback L A, Soung do Y, Naik A, et al. Teriparatide (1-34 human PTH)regulation of osterix during fracture repair [J]. J Cell Biochem, 2008,105 (1): 219-226.
[7]MedSci. 骨质疏松类药物abaloparatide, 降低骨折风险的研究 [EB/ OL]. (2015-03-09) [2015-05-09]. http://www.medsci.cn/article/show_ article.do?id=ca914e92142.
[8]Luisetto G, Camozzi V. Statins, fracture risk, and bone remodeling [J]. J Endocrinol Invest, 2009, 32 (4 Suppl): 32-37.
[9]Reginster J Y, Felsenberg D, Pavo I, et al. Effect of raloxifene combined with monofluorophosphate as compared with monofluorophosphate alone in postmenopausal women with low bone mass: a randomized,controlled trial [J]. Osteoporos Int, 2003, 14 (9): 741-749.
[10]Padhi D, Jang G, Stouch B, et al. Single-dose, placebo-controlled,randomized study of AMG 785, a sclerostin monoclonal antibody [J]. J Bone Miner Res, 2011, 26 (1): 19-26.
[11]QQYY全球医院网. 安进公布romosozumab III期STRUCTURE研究的数据 [EB/OL]. (2015-09-04) [2015-09-20]. http://yaopin.qqyy. com/article/1509/04/5b81.html.
[12]Gupta G, Aronow W S. Treatment of postmenopausal osteopomsis [J]. Compr Ther, 2007, 33 (3): 114-119.
[13]Manson J E, Hsia J, Johnson K C, et al. Women's healthy initiative investigators. Estrogen plus progestin and the risk of coronary heart disease [J]. N Engl J Med, 2003, 349: 523-534.
[14]Verit F F, Oguz H, Ozkul Y, et al. Long-term effects of tibolone on ocular functions in postmenopausal women [J]. Arch Gynecol Obstet,2007, 275 (4): 255-261.
[15]张兆强, 刘浩宇, 刘锡仪. 尼尔雌醇对去卵巢大鼠骨矿盐代谢的影响[J]. 中国临床康复, 2004, 8 (2): 282-283.
[16]肖新华, 廖二元, 胡平安, 等. 尼尔雌醇对人成骨样MG 63细胞护骨素和骨钙素基因表达的影响[J]. 中华内分泌代谢杂志, 2004, 20(1): 56-58.
[17]那晓琳, 刘晓华, 崔洪斌. 大豆异黄酮对去卵巢大鼠骨力学性能的影响[J]. 中国公共卫生, 2004, 20 (3): 265.
[18]Yao J, Zhang J, Hou J F. Effects of ipriflavone on caged layer bone metabolism in vitro and in vivo [J]. Poult Sci, 2007, 86 (3): 503-507.
[19]Recker R R, Delmas P D, Halse J, et al. Effects of intravenous zoledronic acid once yearly on bone remodeling and bone structure [J]. J Bone Miner Res, 2008, 23 (1): 6-16.
[20]Maximov P Y, Lee T M, Jordan V C. The discovery and development of selective estrogen receptor modulators (SERMs) for clinical practice [J]. Curr Clin Pharmacol, 2013, 8 (2): 135-155.
[21]Reginster J Y. Treatment of postmenopausal osteoporosis [J]. BMJ,2005, 330 (7496): 859-860.
[22]Recker R R, Mitlak B H, Ni X, et al. Long-term raloxifene for postmenopausal osteoporosis [J]. Curr Med Res Opin, 2011, 27 (9): 1755-1761.
[23]Inzerillo A M, Zaidi M, Huang C L. Calcitonin: physiological actions and clinical applications [J]. J Pediatr Endocrinol Metab, 2004, 17 (7):931-940.
[24]Gopal G K, Tam K L, Krishnan S P, et al. Bisphosphonate-associated atypical subtrochanteric femur fractures in the older patient [J]. New Zeal Med J, 2014, 127 (1389): 81-85.
[25]Erviti L J, Gorricho M J. Time to reassess bisphosphonates, drug regulations, and rethink our attitudes [J]. An Sist Sanit Navar, 2013, 36(2): 325-328.
[26]Diab D L, Watts N B. Bisphosphonates in the treatment of osteoporosis[J]. Endocrinol Metab Clin North Am, 2012, 41 (3): 487-506.
[27]Keizman D, Ish-Shalom M, Pili R, et al. Bisphosphonates combined with sunitinib may improve the response rate, progression free survival and overall survival of patients with bone metastases from renal cell carcinoma [J]. Eur J Cancer, 2012, 48 (7): 1031-1037.
[28]Sun J, Song F, Zhang W, et al. Effects of alendronate on human osteoblast-like MG63 cells and matrix metallo-proteinases [J]. Arch Oral Biol, 2012, 57 (6): 728-736.
[29]Chugai Pharmaceutical Co., Ltd.. Results of phase III clinical trial of ibandronate sodium hydrate oral formulation, bisphosphonate antiresorptive agent, in Japanese patients with osteoporosis presented[EB/OL]. (2015-05-30) [2015-06-08]. http://www.chugai-pharm.co.jp/english/news/detail/20150330113000.html.
[30]汪茜, 黄明炜, 廖勇敢. 唑来膦酸钠治疗绝经后骨质疏松症临床观察 [J]. 中国老年保健医学杂志, 2013, 11 (4): 45-46.
[31]Saag K, Lindsay R, Kriegman A, et al. A single zoledronic acid infusion reduced bone resorption markers more rapidly than weekly oral alendronate in postmenopausal women with low bone mineral density [J]. Bone, 2007, 40 (5): 1238-1243.
[32]杨杰. 阿仑膦酸钠联合骨化三醇治疗女性绝经后骨质疏松性髋部骨折的疗效及对骨代谢的影响 [J]. 中国老年杂志, 2013, 33 (4): 809-811.
[33]Chung Y S, Choi Y J, Kim S H. Improved dosage form of the combined alendronate and calcitriol (Maxmarvil) on the absorption of alendronate in Korean postmenopausal women [J]. Arch Pharm Res, 2013, 36 (8):966-972.
[34]郑振峰, 林珊. 狄诺塞麦:治疗绝经期女性骨质疏松的新希望[J].国际内分泌代谢杂志, 2011, 31 (3): 161-164.
[35]Watts N B, Bilezikian J P, Camacho P M, et al. American Association of Clinical Endocrinologists Medical Guide-lines for Clinical Practice for the diagnosis and treatment of postmenopausal osteoporosis [J]. Endocr Pract, 2010, 16 (Suppl 3): 1-37.
[36]Scheiner S, Pivonka P, Smith D W, et al. Mathematical modeling of postmenopausal osteoporosis and its treatment by the anti-catabolic drug denosumab [J]. Int J Numer Method Biomed Eng, 2014, 30 (1): 1-27.
[37]Hamers-Casterman C, Atarhouch T, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains [J]. Nature, 1993, 363 (6428):446-448.
[38]Skottrup P D, Leonard P, Kazmarek J Z, et al. Diagnostic evaluation of a nanobody with picomolar affnity toward the protease RgpB from Porphyromonas gingivalis [J]. Anal Biochem, 2011, 415: 158-167.
[39]Abbady A Q, Al-Mariri A, Zarkawi M, et al. Evaluation of a nanobody phage display library constructed from a Bruella-immunised camel [J]. Vet Immunol Immunop, 2011, 142: 49-56.
[40]Steyaert J, Kobila K. Nanobody stabilization of G protein-coupled receptor conformational states [J]. Curr Opin Struc Biol, 2011, 21: 567-572.
[41]Roux S. New treatment targets in osteoporosis [J]. Joint Bone Spine,2010, 77 (3): 222-228.
[42]Bone H G, McClung M R, Roux C, et al. Odanacatib, a cathepsin-K inhibitor for osteoporosis: a two-year study in postmenopausal women with low bone density [J]. J Bone Miner Res, 2010, 25 (5): 937-947.
[43]生物谷. 默沙东骨质疏松症药物odanacatib凯旋归来,全球最大预后研究成功[EB/OL]. (2014-09-19) [2015-02-13]. http://news.bioon. com/article/6659037.html.
[44]Eric O. Randomized controlled trial to assess the safety and effcacy of odanacatib in the treatment of men with osteoporosis [J]. ASBMR, 2014:1149.
[45]Eastell R, Nagase S, Ohyama M, et al. Safety and efficacy of the cathepsin K inhibitor ONO-5334 in postmenopausal osteoporosis: the OCEAN study [J]. J Bone Miner Res, 2011, 26 (6): 1303-1312.
[46]Chattopadhyay N, Quinn S J, Kifor O, et al. The calcium-sensing receptor (CaR) is involved in strontium ranelate-induced osteoblast proliferation [J]. Biochem Pharmacol, 2007, 74 (3): 438-447.
[47]Schwartzberg P L, Xing L, Hoffmann O, et al. Rescue of osteoclast function by transgenic expression of kinase-defcient Src in src-/-mutant mice [J]. Genes Dev, 1997, 11 (21): 2835-2844.
[48]Shakespeare W C, Wang Y, Bohacek R, et al. SAR of carbon-linked,2-substituted purines: synthesis and characterization of AP23451 as a novel bone-targeted inhibitor of Src tyrosine kinase with in vivo antiresorptive activity [J]. Chem Biol Drug Des, 2008, 71 (2): 97-105.
[49]Hannon R A, Clack G, Rimmer M, et al. Effects of the Src kinase inhibitor saracatinib (AZD0530) on bone turnover in healthy men: a randomized, double-blind, placebo-controlled, multiple-ascending-dose phase I trial [J]. J Bone Miner Res, 2010, 25 (3) : 463-471.
[50]丁香园. 癌症试验药物 Saracatinib 显示对阿尔茨海默病有效[EB/OL]. (2015-04-07)[2015-07-03]. http://yao.dxy.cn/article/104715?trace=drugs.
[51]Brownlow N, Mol C, Hayford C, et al. Dasatinib is a potent inhibitor of tumour-associated macrophages, osteoclasts and the FMS receptor. [J]. Leukemia, 2009, 23 (3): 590-594.
Advances in Research on Therapeutics for Osteoporosis
WANG Fang, LIU Wei, YAN Liying, YU Baohui, WANG Haisheng
(Beijing Haiyan Pharmaceutical Co., Ltd., Yangtze River Pharmaceutical Group, Beijing 102206, China)
Osteoporosis is a systemic metabolic bone disease which is characterized by decreased bone mass, regression of bone microarchitecture and subsequent fragile fracture. Osteoporosis has gradually become a global public health problem due to its high incidence, morbidity, and mortality. Recently, great efforts have been made to develop more effective and safer anti-osteoporosis treatments. Advances in research on anti-osteoporosis drugs have been reviewed in this article, so as to provide
for drug prescription by healthcare practitioners and development of related drugs.
osteoporosis; bone-forming drug; antibody; c-Src kinase inhibitor
R681
A
1001-5094(2015)09-0683-07
接受日期:2015-06-01
*通讯作者:王海盛,博士,高级工程师;
研究方向:药物化学,新药研发;
Tel:010-80728999-6555;E-mail:haishengwang@outlook.com

