低氧诱导因子-1α作为肝癌治疗靶点的研究进展
李晴宇,李杨玲,张博,严伟,林能明*
(1.南京医科大学附属杭州医院临床药学研究室,浙江 杭州 310006; 2.杭州市第一人民医院转化医学研究中心临床药理研究室,浙江 杭州 310006)
低氧诱导因子-1α作为肝癌治疗靶点的研究进展
李晴宇1,李杨玲1,2,张博1,2,严伟1,林能明1,2*
(1.南京医科大学附属杭州医院临床药学研究室,浙江 杭州 310006; 2.杭州市第一人民医院转化医学研究中心临床药理研究室,浙江 杭州 310006)
低氧在实体瘤中常有发生,实体瘤的低氧能刺激低氧诱导因子(HIF-1α)的过度表达。HIF-1α的高表达能够进一步促进癌细胞的增殖、浸润能力,甚至能够降低癌细胞对放化疗的敏感性。以HIF-1α为靶点的肝癌药物治疗方案已经越来越受到临床及相关研究者的关注,抑制HIF-1α的表达可抑制肝癌转移、克服多药耐药、诱导肝癌细胞增殖和凋亡,因此通过直接或间接的手段靶向HIF-1α将成为治疗肝癌的有效手段。
HIF-1α;肝癌;耐药
肝癌在全球的发病率呈上升趋势,尤其在我国,肝癌的新增病例和死亡人数均居世界首位。作为一种高代谢的肿瘤,肝癌耗氧量高于正常组织;此外,肝脏内兼具有肝动脉和肝门静脉这一独特的血管结构,可致部分区域的肝癌细胞氧供进一步减少,加剧缺氧状况。低氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)是缺氧效应调控中最为关键的核转录调控因子,HIF-1α的表达与肝癌发生发展、复发转移、癌细胞凋亡和耐药性均有紧密的联系。本文对近年来HIF-1α在肝癌发生发展中的作用以及针对HIF-1α作为潜在治疗靶点的研究进展作一综述,旨在为开发靶向HIF-1α的肝癌治疗药物研究提供更多的理论基础和实践支持。
1 低氧诱导因子
低氧是实体瘤的常见特征,肿瘤由于血管微环境异常造成血液供应不足而导致缺氧。低氧最先刺激低氧诱导因子(hypoxia inducible factors,HIFs)的过度表达,通过信号转导通路诱导下游基因的表达,使细胞适应低氧环境,继续增殖,并具有高侵袭与转移能力以及对放化疗法的耐受性[1]。
1.1 低氧诱导因子家族
HIFs是细胞应对氧气水平降低时的主要调节因子,广泛表达于哺乳动物的各种组织细胞。HIF是由一个不稳定的α亚基(HIF-α)和一个稳定的β亚基(HIF-β)组成的二聚体,具有结合靶基因的低氧反应元件(hypoxia response elements,HREs)的能力,从而发挥调控作用。目前认为HIF-α亚基在人体中有3种:HIF-1α、HIF-2α和HIF-3α[2]。与HIF-1α亚基相比,目前对HIF-2α和HIF-3α的研究相对匮乏。HIF-1α在低氧条件下表达上调,并与HIF-1β结合成异质二聚体,HIF-1β在细胞内持续表达,而HIF-1α被认为是HIF-1发挥功能的限速因子[3]。常氧状态下,HIF-1α虽然可以表达,但其氧依赖降解区(oxygen degradation domain,ODD)被脯氨酸羟化酶修饰,随后迅速被希佩尔林道病肿瘤抑制蛋白(Von Hippel Lindau protein, pVHL)以及E3泛素化连接酶介导的蛋白酶体降解[4],图1显示HIF-1α在常氧下容易被降解,而在低氧下高表达,最终引起大量靶基因的表达。
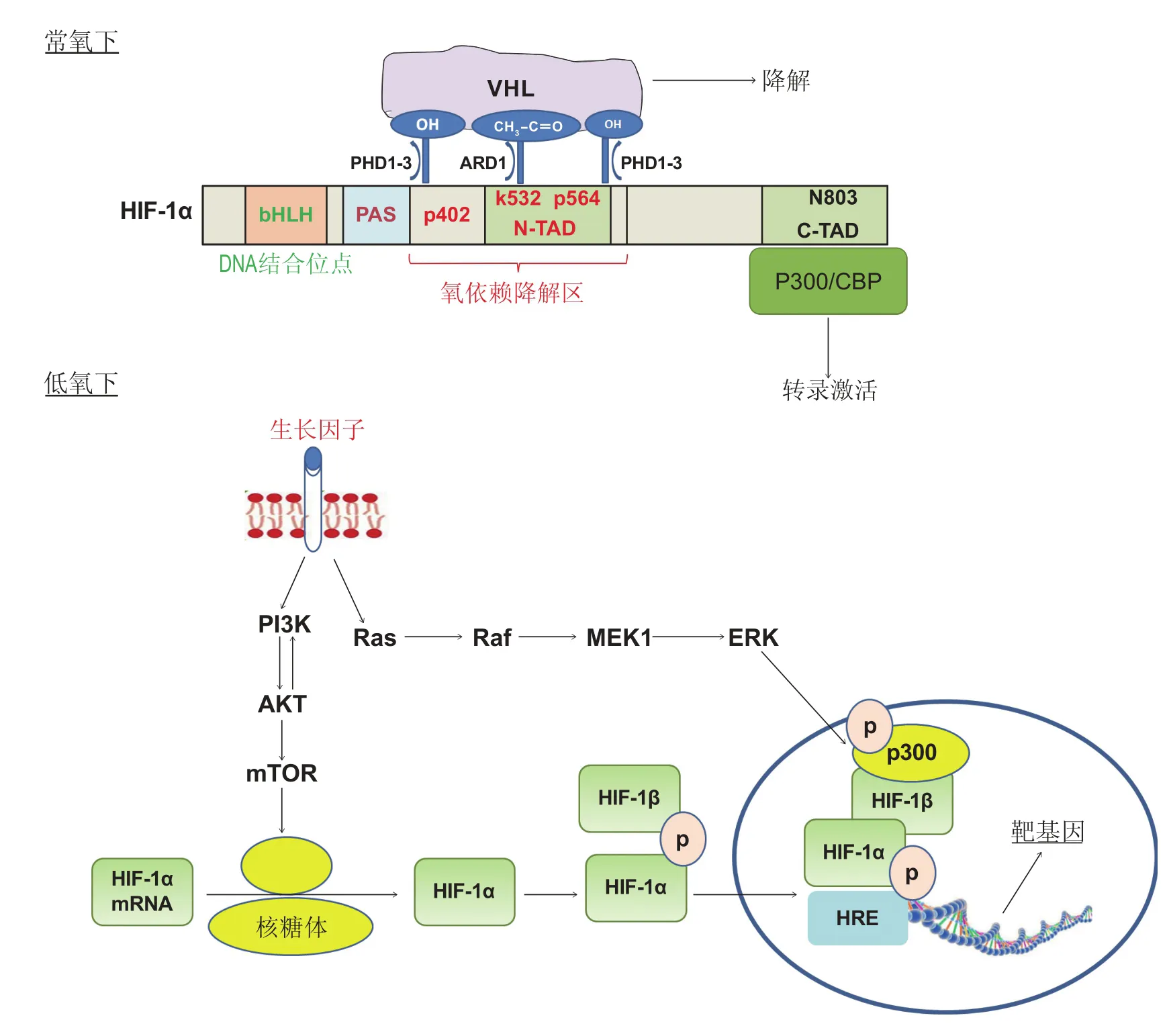
图1 HIF-1α活性的氧依赖性调节Figure 1 Oxygen-dependent regulation of HIF-1α activity
除了已知的泛素蛋白酶体通路外,自噬是否参与降解HIF-1α蛋白这一问题也引起了研究者们的注意。Hubbi等[5]利用小分子化合物和分子克隆技术特异性改变细胞内溶酶体的含量,发现HIF-1α 蛋白水平随着溶酶体数目的增加而降低。进一步的分子机制研究结果显示,HIF-1α 蛋白可以与标志性蛋白HSC70和LAMP2A相互结合,HSP70和LAMP2A蛋白含量的多少能够影响HIF-1α 蛋白水平,证实分子伴侣蛋白介导的自噬参与调控HIF-1α 蛋白降解。另外,Liu等[6]在研究新型化合物Q6(1)的抗肝癌作用中发现,Q6通过引起HIF-1α发生自噬性降解,从而抑制肝癌细胞的增殖,间接表明HIF-1α蛋白亦可以通过自噬途径进行降解。
1.2 HIF-1α与肿瘤的关系
肿瘤组织内部细胞缺氧是恶性肿瘤的重要生物学特征,临床和动物模型已证实约90%的实体瘤内存在低氧微环境。HIF-1α是低氧微环境关键调控因子,可通过调控下游多种蛋白和信号转导通路影响肿瘤的发生发展[7]。通过对大量的临床肿瘤病理组织样本进行分析,研究人员发现HIF-1α在肝癌、乳腺癌、卵巢癌、肺癌等多种肿瘤组织中过度表达;另外,多种转移性肿瘤中HIF-1α的表达显著高于原发瘤;而乳腺、子宫等良性病变和邻近的正常组织中HIF-1α处于正常水平,以上种种迹象均提示HIF-1α的表达在肿瘤的转移和侵袭过程中起着关键作用[8-10]。HIF-1α在实体肿瘤组织内选择性持续高表达,下游关键调控靶基因在细胞异常增殖、存活、维持干细胞特性,代谢重组,血管生成,上皮间质转化,转移与侵袭中起重要作用[11](见表1)。最新研究发现,TAZ可作为HIF-1α的靶基因参与调控乳腺癌的肿瘤干细胞特性[12];HIF-1α可与PD-L1启动子区域的HRE直接结合,激活PD-L1蛋白的转录,增加该蛋白的表达从而介导肿瘤免疫逃逸[13];FTCD作为受HIF-1α的新调控靶蛋白参与促进肝癌的转移、增殖和化疗耐药[14]。

表1 HIF-1α的靶基因调控肿瘤发生与演进Table 1 HIF-1αtarget genes involved in crucial aspects of cancer progression
2 HIF-1α与肝癌的关系
在肝癌形成的早期,HIF-1α在转录水平和蛋白水平上均呈现过表达,表现为肝细胞变性、癌前和癌变组织HIF-1α在基因和蛋白表达上呈动态梯度增高,且外周血中亦可检测到HIF-1α的表达变化[15],这些现象均提示,与大多数的实体瘤类似,HIF-1α在缺氧微环境下的肝癌发生和恶性演进中可能扮演重要的角色,而后续的研究也表明HIF-1α可以通过调控多种下游靶基因和信号通路参与肝癌发生发展、复发转移、癌细胞凋亡、耐药性的获得,因此靶向HIF-1α也将可能成为治疗肝癌的有效手段之一[16]。
2.1 HIF-1α与肝癌细胞能量代谢
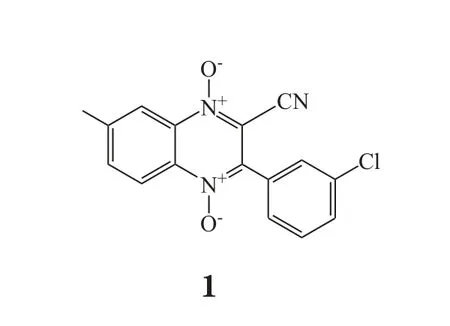
低氧微环境下,肿瘤发生从有氧代谢到无氧代谢的转变,HIF-1α被报道是能量代谢的关键调控因子。已有文献报道HIF-1α通过激活下游与糖酵解相关因子例如GLUT1、GLUT3、HK1和HK2等实现无氧糖酵解,从而为肿瘤细胞的发生发展提供能量[8]。最新研究显示,HIF-1α能够通过降低脂质代谢相关因子MCAD和LCAD的表达水平,抑制脂肪酸的β氧化,促进肝癌细胞的增殖和肿瘤生长[17]。此外,值得关注的是,HIF-1α还可以通过调节钙离子的稳态来促进低氧下肝癌的生长,Li等[18]在探究HIF-1α如何驱动肝癌生成的问题中发现,HIF-1α能够通过影响钙离子动员来促进肝癌生成:一方面,HIF-1α直接控制了STIM1转录,并促进了钙库操纵性钙离子内流(SOCE);另一方面,STIM1介导的SOCE通过激活CaMKII和p300,增加HIF-1α于低氧条件下在肝癌细胞中的累积,给予HIF-1α抑制剂YC-1(2)或特异性敲除HIF-1α蛋白均能够显著降低STIM1蛋白表达并有效抑制肝癌的发生,阐明HIF1-STIM1交互作用参与肝癌的生成。
2.2 HIF-1α与肝癌血管生成
肝癌的发展需要新生毛细血管的形成以提供营养和运输代谢产物,维持肿瘤生长发育的适宜环境,而肿瘤血管的形成与某些血管生成素和生长因子如血管内皮生长因子(VEGF)、表皮生长因子(EGF)和纤维生长因子(FGF)等有关,其中VEGF在肿瘤血管形成过程中起关键作用。研究表明:在缺氧时HIF-1α能调节VEGF的信号传导,HIF-1α不仅可以增加VEGF的mRNA稳定性,而且能提高VEGF的转录活性,从而促进肿瘤血管的形成[3,19]。Li等[20]最近发现,低氧条件下,肝癌细胞内Cbx4蛋白能够促进HIF-1α的K391和K477位点的sumo化修饰,稳定HIF-1α蛋白,从而增强其下游靶蛋白VEGF的表达,实现促进肝癌的血管生成作用,该研究不仅为发现新的抗肿瘤血管生成提供作用靶点,同时也说明VEGF受HIF-1α所调控。
2.3 HIF-1α与肝癌复发转移
肿瘤组织内HIF-1α的表达和肝癌的转移复发密切相关,表现为上皮细胞间质转化(epithelial-mesenchymal transition,EMT)的发生、肿瘤细胞黏附性的改变、侵袭性的增强等,因此,肝癌组织内如果HIF-1α表达高,则预示着术后生存率下降,复发的可能性增加[21]。有研究显示,低氧微环境下,肝癌细胞内累积的HIF-1α蛋白通过转录激活Snail,从而诱导EMT的发生[22]。其他一些E-cadherin抑制因子,例如TCF3、ZEB1和ZEB2被报道均可以通过HIF-1α上调,为肿瘤细胞的转移提供分子基础[23-25]。另外,HIF-1α还可以通过调节趋化因子来促进细胞的转移能力,例如Tian等[26]的研究结果显示,HIF-1α能够通过上调趋化因子CXCL6的表达水平促进肝癌的转移侵袭能力。除此之外,研究人员也发现了一些新的蛋白参与HIF-1α所介导的肿瘤转移,例如最近的研究发现Rab11-FIP4在肝癌组织中的表达显著高于癌旁组织,是促进肝癌转移的重要因子,其自身高表达常指示着肝癌患者的预后不良,机制研究揭示该因子受HIF-1α蛋白所调控,是HIF-1α的靶基因[27]。在探讨肝癌转移的分子机制中,Liu等[28]发现PROX1蛋白能够促进肝癌细胞的转移侵袭能力,这种作用通过促进HIF-1α蛋白的表达而实现,进一步证明HIF-1α在调控肝癌转移中的作用。
2.4 HIF-1α与肝癌细胞凋亡
HIF-1α可以抑制肝癌细胞的凋亡,Piret等[29]研究发现缺氧或氯化钴可以诱导HIF-1α的表达,进而抑制叔丁基过氧化氢或去血清引起的肝癌细胞HepG2的凋亡。目前,应用于肝癌治疗的靶向抑制剂索拉非尼,被报道通过抑制HIF-1α/VEGFA信号通路,诱导肝癌细胞凋亡[30];另外,体内动物实验表明,应用反义核苷酸特异性沉默HIF-1α蛋白,能够明显增强化疗药物多柔比星诱导肝癌细胞的凋亡作用,这些结果均表明HIF-1α的表达对细胞具有保护作用[31]。不过,也有个别文献报道HIF-1α既可促进凋亡又可抑制凋亡,具体取决于细胞类型和实验条件,其机制仍有待进一步研究[32]。
2.5 HIF-1α与肝癌治疗抵抗
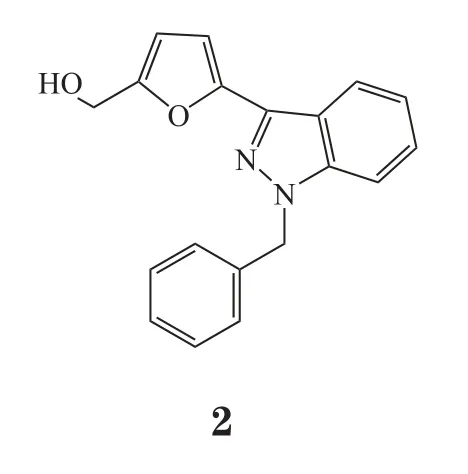
放疗是目前治疗肝癌的重要手段,Xiang等[33]对原代肝癌样本进行分析,发现病人肝癌细胞内HIF-1α的高表达常预示放疗效果不佳和预后不良。另外Wang等[34]研究发现,柴胡皂苷D通过抑制HIF-1α从而增强肝癌放疗敏感性,进一步说明HIF-1α蛋白参与肝癌放疗抵抗作用。除此之外,很多文献报道HIF-1α蛋白是实体瘤在低氧微环境中产生放疗抵抗的重要因素[35]。在肝癌实体瘤中,研究人员发现HIF-1α蛋白参与肿瘤细胞对多种常用化疗药物的低氧耐药现象。例如Liang等[36]比较了索拉非尼耐药的肝癌组织与敏感型肝癌组织,发现前者的低氧程度高于后者;紧接着作者检测到耐药型的肿瘤组织中高表达HIF-1α、MDR和GLUT-1蛋白(另一个HIF-1α靶蛋白),而应用shRNA特异性沉默HIF-1α蛋白可以逆转这种药物抵抗作用,并进一步发现姜黄素类似物EF24通过促进HIF-1α蛋白降解而增强索拉非尼的药效。类似地,Cai等[37]的实验研究发现HIF-1α蛋白的累积会明显降低TopoⅠ抑制剂拓扑替康、SN-38(3)和10-羟基喜树碱等的药效,而沉默HIF-1α蛋白能够显著提高它们的抗肿瘤活性,更加说明HIF-1α蛋白参与介导肝癌的治疗抵抗。针对HIF-1α如何影响肝癌细胞的耐药性问题,有实验研究表明低氧主要是通过累积激活HIF-1α蛋白,启动下游MDR1转录,从而产生P-糖蛋白,将药物由细胞内泵出,进而降低细胞内药物浓度诱发MDR[38];另外,Tong等[39]研究发现,WSB-1蛋白能够作为HIF-1α蛋白的靶基因参与降低肝癌细胞对药物依托泊苷的敏感性,特异性敲低WSB-1蛋白的表达能够增强该药的抗肿瘤作用;此外,Wang等[40]发现HIF-1α还可以通过调控ADAM17蛋白的表达水平,影响EGFR/PI3K/Akt等信号通路使肝癌细胞产生低氧耐药特性。
3 HIF-1α抑制剂治疗肝癌的研究
鉴于HIF-1α在促进肿瘤的发生发展中具有重要的作用,因而寻找和设计靶向HIF-1α的化合物将成为近期的研究热点。目前,已有不少药物或化合物被发现具有抑制HIF-1α的作用,如表2所示。根据作用特点不同将HIF-1α抑制剂分为以下几类:1)作用于HIF-1α上游相关信号通路,如mTOR、PI3K抑制剂等;2)抑制HIF-1α的mRNA表达,如EZN-2968[41]、PX-478;3)抑制HIF-1α蛋白合成,如喜树碱类TopoⅠ抑制剂拓扑替康等[42],HDAC抑制剂vorinostat[43];4)促进HIF-1α蛋白降解,包括YC-1、HSP90抑制剂等;5)抑制HIF-1α异二聚体的形成,例如丫啶黄[44-45];6)阻断HIF-1α与靶基因的结合,如阿霉素等;7)抑制HIF-1α介导的转录激活,如chetomin、硼替佐米等[46]。
目前关于以HIF-1α为靶点治疗肝癌的研究进展如下:一方面,研究人员将以上被报道具有抑制HIF-1α活性的化合物应用于肝癌,例如Ma等[47]将HIF-1α抑制剂2-methoxyestradiol(4)与索拉非尼联合应用,发现其可以明显增强后者的抗肝癌药效。Choi 等[48]应用shRNA靶向沉默HIF-1α后,发现肝癌的血管生成和肿瘤生长受到明显抑制。另一方面,以肝癌为模型,不断发现新的化合物通过抑制HIF-1α活性从而发挥抗肿瘤作用,例如,Weng等[49]的研究结果显示化合物Q39(5)通过减少HIF-1α透膜转位,促进HIF-1α蛋白泛素化降解,从而发挥低氧环境中Q39诱导肝癌细胞凋亡的作用。Cai等[37]研究发现低氧选择性化合物替莫唑胺通过降低HIF-1α蛋白表达,从而增强伊立替康等TopoⅠ抑制剂的抗肝癌作用。此外,越来越多的中药成分也被发现具有抑制HIF-1α的作用,例如姜黄素被发现可以抑制肝癌的HIF-1α活性从而逆转EMT的发生[50];Lu等[51]研究发现藤黄酸通过增加脯氨酸羟化酶PHD2的表达,提高HIF-1α的羟基化水平进而促进其降解,从而降低下游VEGF的表达,抑制肝癌的血管生成。

表2 HIF-1α的代表性抑制剂及其作用机制Table 2 Representative chemical inhibitors targeting HIF-1α
4 结语
HIF-1α在肝癌细胞中的表达明显高于正常组织细胞。HIF-1α作为肝癌细胞适应低氧微环境的重要调节因子,可以通过调控下游多个靶基因,影响肝癌的生长繁殖、侵袭和转移、新生血管生成、凋亡、耐药等过程。目前各项研究均不同程度地支持将HIF-1α作为治疗靶点是可行的,因而通过直接或者间接的手段靶向HIF-1α将可能成为治疗肝癌的有效手段。尽管目前针对于HIF-1α的研究越来越多,HIF-1α抑制剂也被大量的发现,但均处在临床前研究阶段。在将这些抑制剂推向临床应用的过程中,仍有不少问题亟待解决,如HIF-1α抑制剂特异性不强,对肿瘤的杀伤作用不明显等,因此,目前尚无上市的HIF-1α 抑制剂,所以寻找和研发特异性更强的抑制剂刻不容缓。
[1]Balamurugan K. HIF-1 at the crossroads of hypoxia, inflammation, and cancer[J]. Int J Cancer, 2015,1(1): 1-9.
[2]Sakamoto T, Weng J S, Hara T, et al. Hypoxia-inducible factor 1 regulation through cross talk between mTOR and MT1-MMP[J]. Mol Cell Biol, 2014, 34(1): 30-42.
[3]Ahluwalia A, Tarnawski A S. Critical role of hypoxia sensor - HIF-1 alpha in VEGF gene activation. Implications for angiogenesis and tissue injury healing[J]. Curr Med Chem, 2012, 19(1): 90-97.
[4]Buckley D L, Van Molle I, Gareiss P C, et al. Targeting the Von Hippel-Lindau E3 ubiquitin ligase using small molecules to disrupt the VHL/ HIF-1 alpha interaction[J]. J Am Chem Soc, 2012, 134(10): 4465-4468.
[5]Hubbi M E, Hu H, Kshitiz, et al. Chaperone-mediated autophagy targets hypoxia-inducible factor-1alpha (HIF-1alpha) for lysosomal degradation[J]. J Biol Chem, 2013, 288(15): 10703-10714.
[6]Liu X W, Cai T Y, Zhu H, et al. Q6, a novel hypoxia-targeted drug,regulates hypoxia-inducible factor signaling via an autophagy-dependent mechanism in hepatocellular carcinoma[J]. Autophagy, 2014, 10(1): 111-122.
[7]Hu Y, Liu J, Huang H. Recent agents targeting HIF-1alpha for cancer therapy[J]. J Cell Biochem, 2013, 114(3): 498-509.
[8]Semenza G L. Hypoxia-inducible factors: mediators of cancer progression and targets for cancer therapy[J]. Trends Pharmacol Sci,2012, 33(4): 207-214.
[9]Saponaro C, Malfettone A, Ranieri G, et al. VEGF, HIF-1 alpha expression and MVD as an angiogenic network in familial breast cancer[J]. PLoS One, 2013, 8(1): e40597.
[10]Sun W, Shen Z Y, Zhang H, et al. Overexpression of HIF-1 alpha in primary gallbladder carcinoma and its relation to vasculogenic mimicry and unfavourable prognosis[J]. Oncol Rep, 2012, 27(6): 1990-2002.
[11]Semenza G L. Hypoxia-inducible factors in physiology and medicine[J]. Cell, 2012, 148(3): 399-408.
[12]Xiang L S, Gilkes D M, Hu H X, et al. Hypoxia-inducible factor 1 mediates TAZ expression and nuclear localization to induce the breast cancer stem cell phenotype[J]. Oncotarget, 2014, 5(24): 12509-12527.
[13]Noman M Z, Desantis G, Janji B, et al. PD-L1 is a novel direct target of HIF-1 alpha, and its blockade under hypoxia enhanced MDSC-mediated T cell activation[J]. J Exp Med, 2014, 211(5): 781-790.
[14]Yu Z H, Ge Y Y, Xie L, et al. Using a yeast two-hybrid system to identify FTCD as a new regulator for HIF-1 alpha in HepG2 cells[J]. Cell Signal, 2014, 26(7): 1560-1566.
[15]Yao D F, Jiang H, Yao M, et al. Quantitative analysis of hepatic hypoxiainducible factor-1alpha and its abnormal gene expression during the formation of hepatocellular carcinoma[J]. Hepatobiliary Pancreat Dis Int, 2009, 8(4): 407-413.
[16]Zheng S S, Chen X H, Yin X, et al. Prognostic significance of HIF-1 alpha expression in hepatocellular carcinoma: A meta-analysis[J]. PLoS One, 2013, 8(6): e65753.
[17]Huang D, Li T T, Li X H, et al. HIF-1-mediated suppression of acyl-CoA dehydrogenases and fatty acid oxidation is critical for cancer progression[J]. Cell Rep, 2014, 8(6): 1930-1942.
[18]Li Y S, Guo B, Xie Q C, et al. STIM1 mediates hypoxia-driven hepatocarcinogenesis via interaction with HIF-1[J].Cell Rep, 2015, 12(3): 388-395.
[19]De Francesco E M, Lappano R, Santolla M F, et al. HIF-1 alpha/GPER signaling mediates the expression of VEGF induced by hypoxia in breast cancer associated fibroblasts (CAFs)[J]. Breast Cancer Res, 2013, 15(4): 1-18.
[20]Li J, Xu Y, Long X D, et al. Cbx4 Governs HIF-1 alpha to potentiate angiogenesis of hepatocellular carcinoma by its SUMO E3 ligase activity [J]. Cancer Cell, 2014, 25(4): 547-548.
[21]Semenza G L. Hypoxia-inducible factors: mediators of cancer progression and targets for cancer therapy[J]. Trends Pharmacol Sci,2012, 33(4): 207-214.
[22]Zhang L, Huang G, Li X, et al. Hypoxia induces epithelial-mesenchymal transition via activation of SNAI1 by hypoxia-inducible factor -1alpha in hepatocellular carcinoma[J]. BMC Cancer, 2013, 13: 108.
[23]Zhu G H, Huang C, Feng Z Z, et al. Hypoxia-induced snail expression through transcriptional regulation by HIF-1 alpha in pancreatic cancer cells[J]. Digest Dis Sci, 2013, 58(12): 3503-3515.
[24]Kumar S, Mehta K. Tissue transglutaminase constitutively activatesHIF-1 alpha promoter and nuclear factor-kappa B via a non-canonical pathway [J]. PLoS One, 2012, 7(11): e49321.
[25]Li S, Zhang J, Yang H, et al. Copper depletion inhibits CoCl2-induced aggressive phenotype of MCF-7 cells via downregulation of HIF-1 and inhibition of Snail/Twist-mediated epithelial-mesenchymal transition[J]. Sci Rep, 2015, 5(1): 1-17.
[26]Tian H, Huang P, Zhao Z, et al. HIF-1alpha plays a role in the chemotactic migration of hepatocarcinoma cells through the modulation of CXCL6 expression[J]. Cell Physiol Biochem, 2014, 34(5): 1536-1546.
[27]Hu F, Deng X, Yang X, et al. Hypoxia upregulates Rab11-family interacting protein 4 through HIF-1alpha to promote the metastasis of hepatocellular carcinoma[J]. Oncogene, 2015,1(1): 1-11.
[28]Liu Y, Zhang J B, Qin Y, et al. PROX1 promotes hepatocellular carcinoma metastasis by way of up-regulating hypoxia-inducible factor 1alpha expression and protein stability[J]. Hepatology, 2013, 58(2): 692-705.
[29]Piret J P, Mottet D, Raes M, et al. CoCl2, a chemical inducer of hypoxiainducible factor-1, and hypoxia reduce apoptotic cell death in hepatoma cell line HepG2[J]. Ann Ny Acad Sci, 2002, 973: 443-447.
[30]Liu F, Wang P, Jiang X, et al. Antisense hypoxia-inducible factor 1alpha gene therapy enhances the therapeutic efficacy of doxorubicin to combat hepatocellular carcinoma[J]. Cancer Sci, 2008, 99(10): 2055-2061
[31]Xu M, Zheng Y L, Xie X Y, et al. Sorafenib blocks the HIF-1alpha/ VEGFA pathway, inhibits tumor invasion, and induces apoptosis in hepatoma cells[J]. DNA Cell Biol, 2014, 33(5): 275-281.
[32]Xu Z Q, Chen X P, Peng C, et al. Hypoxia-inducible factor-1 alpha suppressed hepatocellular carcinoma cell apoptosis through influencing on Omi/HtrA2 expression and its releasing from the mitochondrion[J]. Oncol Res, 2012, 20(5/6): 213-220.
[33]Xiang Z L, Zeng Z C, Fan J, et al. The expression of HIF-1alpha in primary hepatocellular carcinoma and its correlation with radiotherapy response and clinical outcome[J]. Mol Biol Rep, 2012, 39(2):2021-2029.
[34]Wang B F, Wang X J, Kang H F, et al. Saikosaponin-D enhances radiosensitivity of hepatoma cells under hypoxic conditions by inhibiting hypoxia-inducible factor-1 alpha[J]. Cell Physiol Biochem, 2014, 33(1): 37-51.
[35]Wu W D, Hu Z M, Shang M J, et al. Cordycepin down-regulates multiple drug resistant (MDR)/HIF-1 alpha through regulating AMPK/ mTORC1 signaling in GBC-SD gallbladder cancer cells[J]. Int J Mol Sci, 2014, 15(7): 12778-12790.
[36]Liang Y J, Zheng T S, Song R P, et al. Hypoxia-mediated sorafenib resistance can be overcome by EF24 through Von Hippel-Lindau tumor suppressor-dependent HIF-1 alpha inhibition in hepatocellular carcinoma[J]. Hepatology, 2013, 57(5): 1847-1857.
[37]Cai T Y, Liu X W, Zhu H, et al. Tirapazamine sensitizes hepatocellular carcinoma cells to topoisomerase I inhibitors via cooperative modulation of hypoxia-inducible factor-1 alpha[J]. Mol Cancer Ther, 2014, 13(3): 630-642.
[38]Wartenberg M, Ling F C, Muschen M, et al. Regulation of the multidrug resistance transporter P-glycoprotein in multicellular tumor spheroids by hypoxiainducible factor-1 and reactive oxygen species[J]. FASEB J,2003,17(1): 503-505.
[39]Tong Y, Li Q G, Xing T Y, et al. HIF1 regulates WSB-1 expression to promote hypoxia-induced chemoresistance in hepatocellular carcinoma cells[J]. FEBS Lett, 2013, 587(16): 2530-2535.
[40]Wang X J, Feng C W, Li M. ADAM17 mediates hypoxia-induced drug resistance in hepatocellular carcinoma cells through activation of EGFR/ PI3K/Akt pathway[J]. Mol Cell Biochem, 2013, 380(1): 57-66.
[41]Minegishi H, Fukashiro S, Ban H S, et al. Discovery of indenopyrazoles as a new class of hypoxia inducible factor (HIF)-1 inhibitors[J]. ACS Med Chem Lett, 2013, 4(2): 297-301.
[42]Wang Y, Li J X, Wang Y Q, et al. Tanshinone I inhibits tumor angiogenesis by reducing STAT3 phosphorylation at TYR705 and hypoxia-induced HIF-1a accumulation in both endothelial and tumor cells[J]. Oncotarget, 2015, 6(18): 16031-16042.
[43]Hutt D M, Roth D M, Vignaud H, et al. The histone deacetylase inhibitor, vorinostat, represses hypoxia inducible factor 1 alpha expression through translational inhibition[J]. PLoS One, 2014, 9(8): e106224.
[44]Lee K, Zhang H, Qian D Z, et al. Acriflavine inhibits HIF-1 dimerization, tumor growth, and vascularization[J]. Proc Natl Acad Sci USA, 2009, 106(42): 17910-17915.
[45]Shay J E, Imtiyaz H Z, Sivanand S, et al. Inhibition of hypoxia-induciblefactors limits tumor progression in a mouse model of colorectal cancer[J]. Carcinogenesis, 2014, 35(5): 1067-1077.
[46]Xia Y, Choi H K, Lee K. Recent advances in hypoxia-inducible factor(HIF)-1 inhibitors[J]. Eur J Med Chem, 2012, 49: 24-40.
[47]Ma L, Li G, Zhu H, et al. 2-Methoxyestradiol synergizes with sorafenib to suppress hepatocellular carcinoma by simultaneously dysregulating hypoxia-inducible factor-1 and -2[J]. Cancer Lett, 2014, 355(1): 96-105.
[48]Choi S H, Kwon O J, Park J Y, et al. Inhibition of tumour angiogenesis and growth by small hairpin HIF-1alpha and IL-8 in hepatocellular carcinoma[J]. Liver Int, 2014, 34(4): 632-642.
[49]Weng Q J, Wang D D, Guo P, et al. Q39, a novel synthetic quinoxaline 1,4-di-N-oxide compound with anti-cancer activity in hypoxia[J]. Eur J Pharmacol, 2008, 581(3): 262-269.
[50]Duan W, Chang Y, Li R, et al. Curcumin inhibits hypoxia inducible factor1alpha induced epithelial-mesenchymal transition in HepG2 hepatocellular carcinoma cells[J]. Mol Med Rep, 2014, 10(5): 2505-2510.
[51]Lu N, Hui H, Yang H, et al. Gambogic acid inhibits angiogenesis through inhibiting PHD2-VHL-HIF-1 alpha pathway[J].Eur J Pharm Sci, 2013, 49(2): 220-226.

[专家介绍] 林能明 :医学博士,教授/主任药师,博士生导师。现为杭州市第一人民医院副院长。2010年入选浙江省卫生高层次创新人才培养对象,2011年获首届浙江省药学会医药科技奖。目前担任中国抗癌协会抗癌药物专业委员会委员,中国药理学会肿瘤药理专业委员会委员,浙江省抗癌协会抗癌药物专业委员会主任委员,浙江省抗癌协会理事、癌痛专业委员会副主任委员,浙江省医院协会药事管理专业委员会副主任委员,浙江省中西医结合学会中药学专业委员会副主任委员,杭州市药事质控中心主任。主要从事临床药理学、肿瘤药理与肿瘤个性化药物治疗方案筛选方面的研究。目前主持国家自然科学基金面上项目及省部级课题5项,科研经费500余万元,发表论文80余篇, SCI论文20多篇,出版专著4部。科研成果获浙江省科技进步二、三等奖各1项。
Advances in Hypoxia-inducible Factor-1alpha: Moleculartargeted Therapy for Hepatocellular Carcinoma
LI Qingyu1, LI Yangling1,2, ZHANG Bo1,2, YAN Wei1, LING Nengming1,2
(1.Department of Clinical Pharmacy, Affiliated Hangzhou Hospital, Nanjing Medical University, Hangzhou 310006, China; 2. Department of Clinical Pharmacology, Hangzhou Translational Medicine Research Center, Hangzhou First People’s Hospital, Hangzhou, 310006, China)
Hypoxia has long been recognized as a common feature of solid tumors. Intratumoral hypoxia can lead to the overexpression of HIF-1α, which is associated with increase in tumor cell proliferation, invasion, and even resistance to radiation and chemotherapy. Thus, there has been growing interest in HIF-1α targeted therapy for hepatocellular carcinoma.The inhibition of HIF-1α expression and/or activity is an effective way to suppress tumor metastasis, reverse multi-drug resistance and induce apoptosis of hepatocellular carcinoma cells. Therefore, it is a promising strategy to treat liver cancer by directly or indirectly targeting HIF-1α.
HIF-1α; hepatocellular carcinoma; drug resistance
R966;R962
A
1001-5094(2015)10-0746-08
接受日期:2015-10-12
项目资助:浙江省公益性技术应用研究计划项目(2015C33269);杭州市科技发展计划项目(20140633B03)
*通讯作者:林能明,教授/主任药师,博士生导师;
研究方向:临床药理学,肿瘤药理与肿瘤个性化药物治疗方案筛选;
Tel:0571-56007905; E-mail:lnm1013@163.com

