烟草成熟期土壤细菌群落结构及多样性
李小林,李强,彭卫红,甘炳成,郑林用,张小平
1 四川省农业科学院/土壤肥料研究所,成都 610066;2 四川大学/生命科学学院,成都 610065;3 四川农业大学,资源环境学院微生物系,四川成都 611130
烟草成熟期土壤细菌群落结构及多样性
李小林1,李强2,彭卫红1,甘炳成1,郑林用1,张小平3
1 四川省农业科学院/土壤肥料研究所,成都 610066;2 四川大学/生命科学学院,成都 610065;3 四川农业大学,资源环境学院微生物系,四川成都 611130
为研究烟草成熟期(下部叶采收期)根际及非根际土壤细菌群落结构和多样性,利用PCR-DGGE技术对攀枝花市盐边县主要烟区采集的5个烟草根际土样和5个非根际土样进行分析。结果表明,非根际与根际土壤细菌群落结构差异显著,非根际土壤的细菌多样性甚至超越根际, 表明烟草成熟期根际效应没有显现,并且有减弱甚至负向效应出现,这可能与烟草成熟期根系分泌物的影响有关。条带克隆测序表明,根际土壤中优势细菌的群落结构更为丰富,而非根际土壤中则相对较弱。Steroidobacter菌是烟田土壤中的优势细菌;硝化螺菌属(Nitrospira)细菌、Rhizobiales目下未定类细菌等为烟草根际土壤中优势细菌;放线菌目(Actinomycetales)未定类放线菌和Chitinophagaceae科未定类细菌为非根际土壤中优势细菌。研究证明成熟期的烟草根际效应出现一定程度减弱。
烟草;成熟期;细菌;群落结构;根际效应;DGGE
烟草成熟期土壤微生物尤其是土壤细菌群落结构变化对烟草的品质有着重要的影响[1]。研究了解烟草土壤的细菌群落结构变化可以为指导烟草生产提供基础理论支持。并为改良土壤生态,提高烟草产量及品质提供研究思路。目前对烟草周围环境微生物的研究主要集中在研究其内生菌[2-5],探索其内生菌的抗菌及促生作用,对其土壤微生物尤其是细菌群落结构的研究还有待加强。林凤敏等[6]运用纯培养法和基于16S rRNA 基因序列的系统发育分析对烟草根际与非根际土壤中可培养细菌多样性进行了研究,发现烟草根际与非根际土壤中含有较为丰富的微生物资源。但是这种可培养技术仅能分离出1%~10%的土壤微生物。PCR-DGGE 技术为不可培养微生物的分析提供了有利的手段,具有检测极限低、灵敏度高等优势,已经广泛应用于环境微生物研究中[7-11]。吴凤芝等[12]将 DGGE 方法应用于研究黄瓜轮作及套作对土壤细菌种群的影响,发现轮套作对黄瓜根际土壤细菌种群的种类、数量和黄瓜产量具有一定的影响,提高了土壤细菌种群多样性指数、均匀度指数和黄瓜产量。李坤等[13]利用该技术研究葡萄连作对土壤细菌和真菌种群结构及多样性的影响,发现葡萄连作后土壤细菌和真菌的多样性增加,且根围土壤的微生物多样性高于非根围土壤。
本研究拟通过 PCR-DGGE技术对烟草成熟期(下部叶采收期)的根际及非根际土壤细菌群落结构和多样性进行研究,以期对科学评价烟田生态系统的健康程度及作物生长的潜力进行预测,为烟草的科学种植提供依据和指导。
1 材料与方法
1.1 样品采集
样品采自四川省攀枝花盐边县鳡鱼乡、永兴镇、格萨拉乡及鱼门镇等主要烟草产区长势均匀的烟田。采集时间为烟草成熟期(下部叶采收期),烟草品种为云烟87,按五点法取样,每个采集点选取10~15株健康烟草植株,连根带土将其拔出,抖掉表面大块的土作为非根际土壤,用标号“B”代表,取紧贴根表附着的土样为根际土壤,用“R”代表。土壤均匀混合后,四分法去掉多余土壤,装入无菌袋中,贴上标签,并用冰袋保存,立即带回实验室。
带回实验室的土壤样品经研磨过2 mm尼龙网筛后,装入无菌塑料袋,置于4 ℃冰箱保存,以供可培养微生物分离与计数等分析;剩下的土样保存于-20℃,供土壤总DNA提取分析。
1.2 土壤总DNA的提取与纯化
样品总DNA的提取采用Fast DNA SPN Kit for Soil (Bio-Rad Co., 美国)试剂盒方法,称取0.5 g土样,按试剂盒说明书进行土壤总DNA提取。用UNIQ-10 DNA纯化试剂盒(上海生工)对土壤总DNA进行纯化,于-20℃保存备用。
1.3 细菌16S rDNA的扩增
细菌16S rDNA的扩增采用引物F338GC(5´-C G C C C G C C G C G C G C G G C G G G C G GGGCGGGGGCACGGGGGG-3´)和 R518(5´-ATTACCGCGGCTGCTGG-3´)。 反 应 体 系 (50 μL):2×PCR Mix (0.1 U Taq 酶 /μL, 500 μM dNTP each, 20 mM Tris-HCl pH 8.3, 100 mM KCl和3 mM MgCl2) 25 μL;正向引物(25 pmol L-1) 0.5 μL;反向引物(25 pmol L-1) 0.5 μL;模板DNA(30-50 ng mL-1)2.0 μL;无菌双蒸水补足至50 μL。扩增程序采用Touch-down PCR程序:94 ℃预变性5 min,94 ℃变性1 min,65-55℃退火50 (s每个循环温度降低0.5 ℃),72 ℃延伸1.5 min,共20个循环,然后在其它条件不变的情况下,在55℃的退火温度下扩增15个循环结束后,72 ℃延伸7 min,产物经1%琼脂糖凝胶电泳检测,100V电压下电泳,EB染色,用自动凝胶成像系统拍照,然后4 ℃恒温保存。
1.4 PCR产物的变性梯度凝胶电泳(DGGE)分析
取PCR扩增产物15-20 μL,加2-5 μL溴酚蓝进行DGGE分析。10%聚丙烯酰胺凝胶(100%的变性剂为尿素7 mol L-1和40%的去离子甲酰胺),变性梯度为25%~55%。使用1×TAE缓冲液,50 V 50 min进胶,再在160 V 60 ℃下电泳5 h。电泳后采用改进的硝酸银染色法对凝胶进行染色。用数码相机拍照保存。
1.5 DGGE优势及特异条带的回收分析
将优势和特异性的条带割下,用无菌去离子水清洗2次,并用15 μL去离子水浸泡过夜,用浸泡夜或者直接挑取一小块胶(<1 mm3)作DNA模板,然后用F338(去GC发夹)及R518进行PCR扩增,体系和程序同上。将扩增后的PCR产物通过凝胶回收试剂盒回收目的条带,进行克隆并挑克隆子送上海英骏生物技术公司测序。
1.6 DGGE数据分析
所有用于DGGE技术分析的样品均设置两次技术重复。DGGE指纹图谱用Bio-Rad公司的Quantity One 4.1.1分析软件进行分析,通过检测条带,匹配条带,扣除背景强度,对目的条带进行标记,根据各样品电泳条带的多少及密度对烟草土壤样品的微生物多样性进行分析。其中香农指数(Shannon-Wiener index, H)和均匀度(Evenness index, EH)根据如下公式计算:
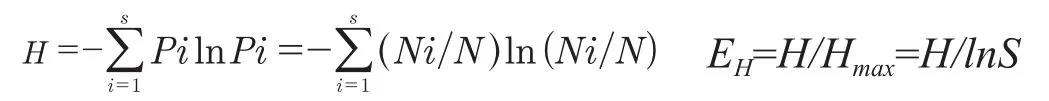
克隆所测的序列,在BLAST上去除载体序列,然后通过Blast中GenBank中核酸数据进行比对分析,选取标准菌株,采用软件MEGA 5.0中Clustal X 程序进行多序列比对,然后用Neighbor-Joining 方法选择Bootstrap 为1000 个重复构建系统发育进化树。由于所得序列低于500 bp,所以细菌选取GenBank和RDP(Ribosomal Database Project)两个数据库进行比对和分析。
2 结果与分析
2.1 细菌DGGE图谱群落结构
DGGE图谱直观地展现了根际与非根际土壤样品细菌群落结构之间的差异 (图1)。无论是根际与根际之间、非根际与非根际之间、同一样点之间的样品条带数目之间的差异都较为明显,显现出一定的细菌多样性。所有样品中条带数目最多的为非根际土壤B3,而条带最少的为B5。而在根际样品中,条带数目最高的为R4,最少的则为R1。根际较之非根际,其根际效应没有系统出现,并且有减弱甚至负向效应出现,如1号和3号样点非根际样品条带数目大于根际样品。可见非根际土壤的细菌多样性在所有样品中的影响力甚至超越根际。
根据泳道对比,可计算出样品间的戴斯相似性指数(表1)。所有样品间相似性均低于50%,超过40%的有5组,低于20%的有4组。其中相似性最高的为47.2%(R5与B5),相似性最低的为13.9%(B3与B5)。同时共有两个样点的根际与非根际间的相似水平超过40%(R2与B2,R5与B5),显示相对较高同源性。
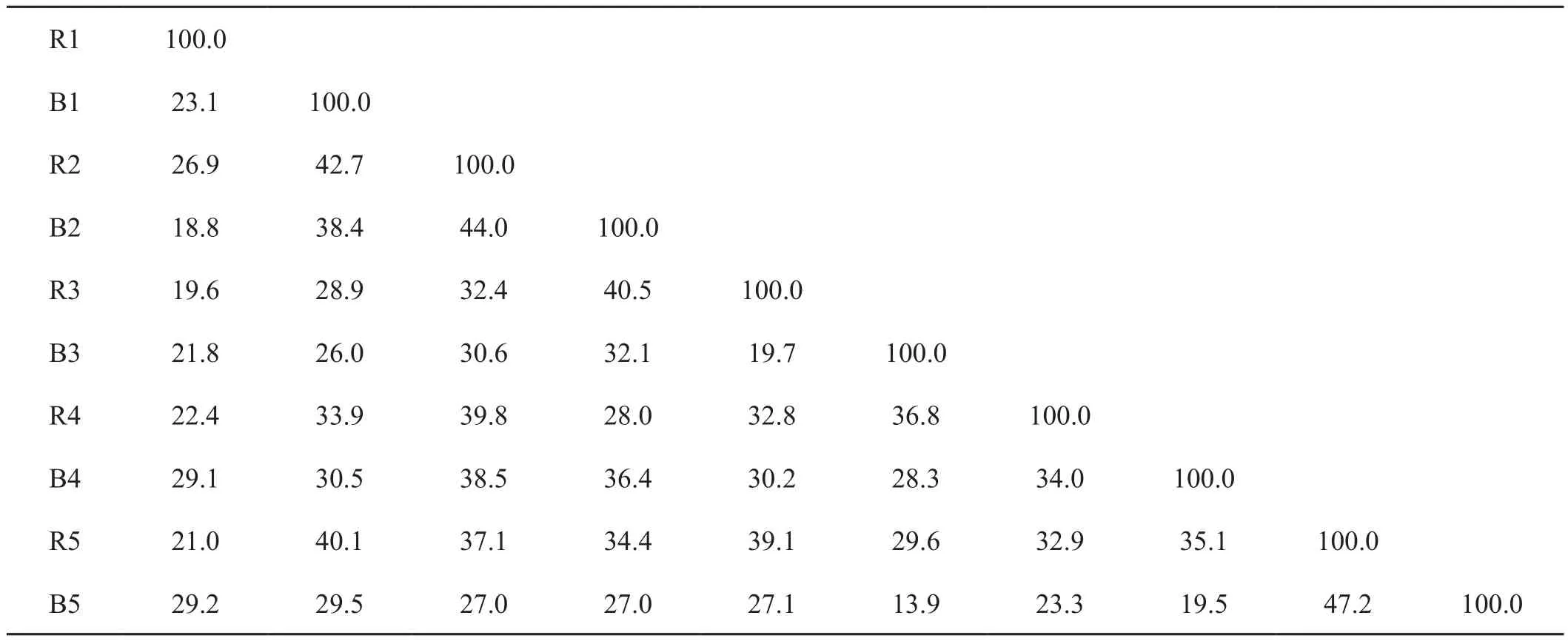
表1 细菌DGGE泳道相似矩阵Tab.1 Similarity matrix of DGGE patterns of bacteria
根据DGGE图谱数字化结果进行了其细菌群落结构组成的主成分分析,其中第一个主成分能解释总变量的18.84%,第二个主成分能解释总变量的15.93%,前两个共能解释总变量的34.76%(图2)。结果显示,B3与其它样品的细菌群落结构差异较大,其次为B5。来源于根际或是非根际的样品并没有系统聚集一起,而是相互散落其间。同一样点中,根际与非根际之间细菌群落结构有一定差异的同时又具有一定同源性,如2、4和5号样点的根际土与非根际土距离并不是很远,尤其是2号样点。
2.2 细菌DGGE图谱多样性
细菌DGGE图谱多样性指数能比较真实客观地反映烟草土壤样品中细菌多样性的信息(表2)。结果显示,烟草根际与非根际样品的细菌多样性指数之间有很大的差异,三个多样性指数均表明系统的细菌根际效应在烟草成熟期开始消失。样点1和3号中,根际香农指数(H)和丰富度(S)均明显小于非根际。同时,细菌根际效应减弱的证据也体现在均匀度(EH)中。
2.3 细菌DGGE代表条带序列分析
根据细菌DGGE图谱,选取了部分优势和特异条带进行测序分析,最后成功克隆10个条带的基因。所以选取GenBank和RDP两个数据库进行比对和分析。根据代表条带在GenBank中比对结果,选取20个可培养或免培养序列作为参比序列共同构建系统发育树(图3)。
在系统发育树中,所有序列隶属于变形菌门(Protebacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)及硝化螺旋菌门(Nitrospira)。整个发育树可分为两个大簇,其中簇I包含6个克隆条带,簇II包含4个克隆条带。
簇I可分为三个亚簇,B2C-2、B1C-4及B4C-3和4个隶属于α-变形菌(α-Proteobacteria)的可培养细菌及两个免培养细菌聚为第一个亚簇。在第二个亚簇中,B1C-1和隶属于β-变形菌(β-Proteobacteria)的Pandoraea sp. R1717 (EU090895)聚为一个小类,而B5R-4则与一株隶属拟杆菌门(Bacteroidetes)及一个免培养克隆序列聚为一个小类。B2C-4所在的第三亚簇与其它两个亚簇遗传距离较远,属于放线菌门(Actinobacteria)。

表2 烟草土壤样品DGGE图谱多样性Tab.2 Diversity of DGGE pro fi les in tobacco soil samples
簇II共两个亚簇,第一个亚簇由一株隶属于γ-变形菌(γ-Proteobacteria)及一株免培养细菌构成。第二个亚簇中,B4R-2与另两个代表条带相距较远,与隶属于酸杆菌门(Acidobacteria)的两个序列聚在一起。同时B4R-3、B4R-5和两株硝化螺旋细菌及两个免培养细菌序列为第三个亚簇。
所有细菌DGGE图谱条带的克隆序列基于RDP数据库分类定位及其在烟草土壤样品中的分布见表3。所有克隆中,只有4个克隆能分类到属,分别为 B1C-1 (Pandoraea)、B4R-3 (Nitrospira)、B4R-4(Steroidobacter)及B4R-5 (Nitrospira);有3个能分类到目,分别是B1C-4 (Rhizobiales)、B2C-2 (Rhizobiales)和B2C-4 (Actinomycetales);另外B4R-2只能分类到酸杆菌门(Acidobacteria),B4C-3只能分类到α-变形菌纲(Alphaproteobacteria),B5R-4只能分类到Chitinophagaceae科。
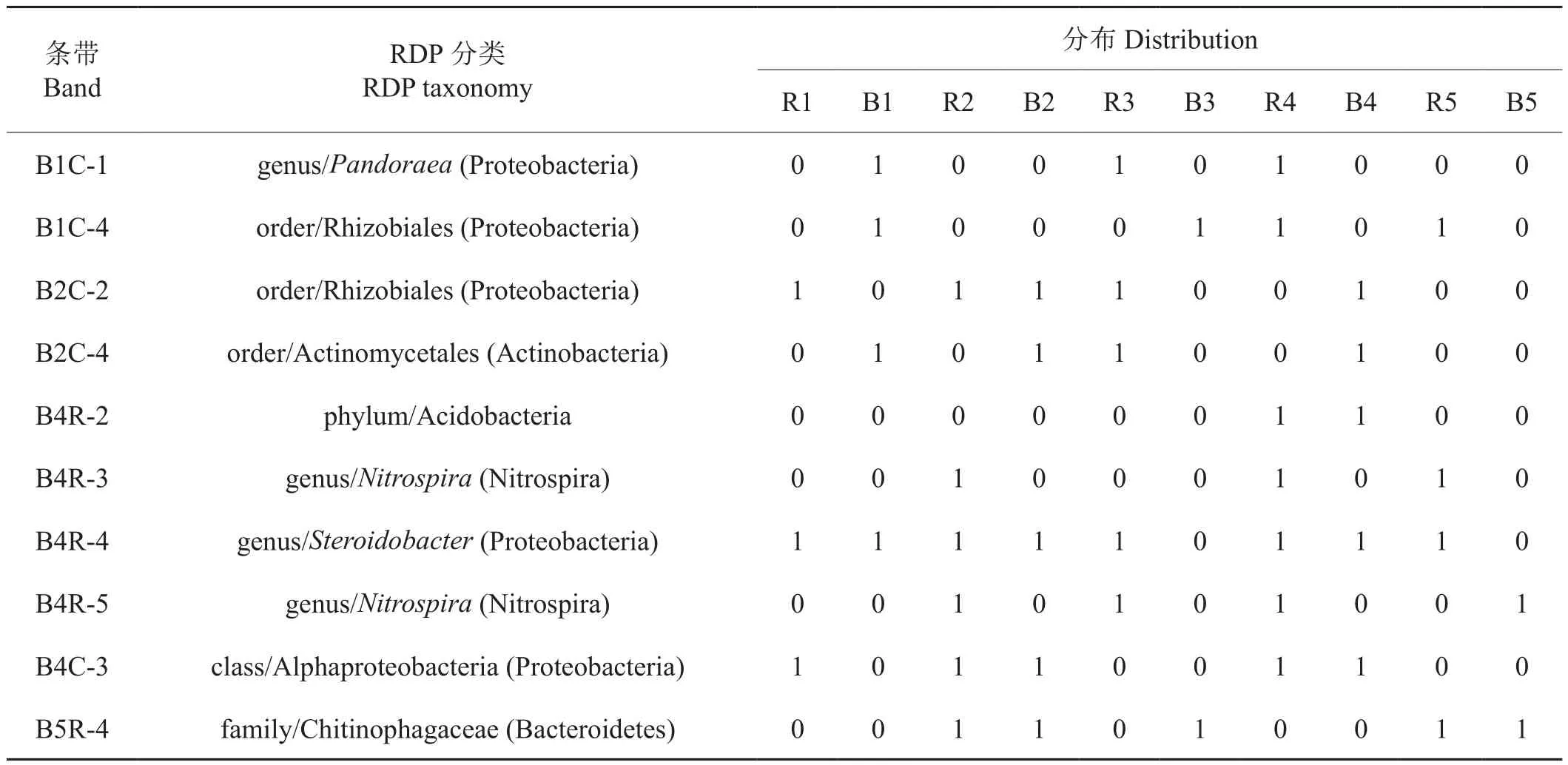
表3 条带克隆在RDP数据库中的分类及在样品中的分布Tab.3 Taxonomy of clone in RDP of clones and its distribution in samples
除克隆B4R-3只在根际土壤中存在之外,大部分条带在根际和非根际中均有分布,而同为硝化螺菌(Nitrospira)的代表条带B4R-5也主要在根际样品中出现,表明硝化螺菌属(Nitrospira)细菌是根际土壤中的优势细菌之一。同时余下的代表克隆序列B2C-2、B4R-4及B4C-3在根际样品中出现的概率超过60%,为烟草根际土壤中优势细菌。而在非根际样品中,代表克隆B2C-4、B4R-4及B5R-4出现的概率高于60%。
根际土壤中优势细菌的群落结构更为丰富,而非根际土壤中则相对较弱。无论在根际还是非根际中,Steroidobacter属细菌出现概率均较高,表明Steroidobacter菌是烟田土壤中的优势细菌。同时,硝化螺菌属细菌、Rhizobiales目下未定类细菌和α-变形菌纲(Alphaproteobacteria)下未定类细菌为烟草根际土壤中优势细菌。而放线菌目(Actinomycetales)未定类放线菌和Chitinophagaceae科未定类细菌为非根际土壤中优势细菌。
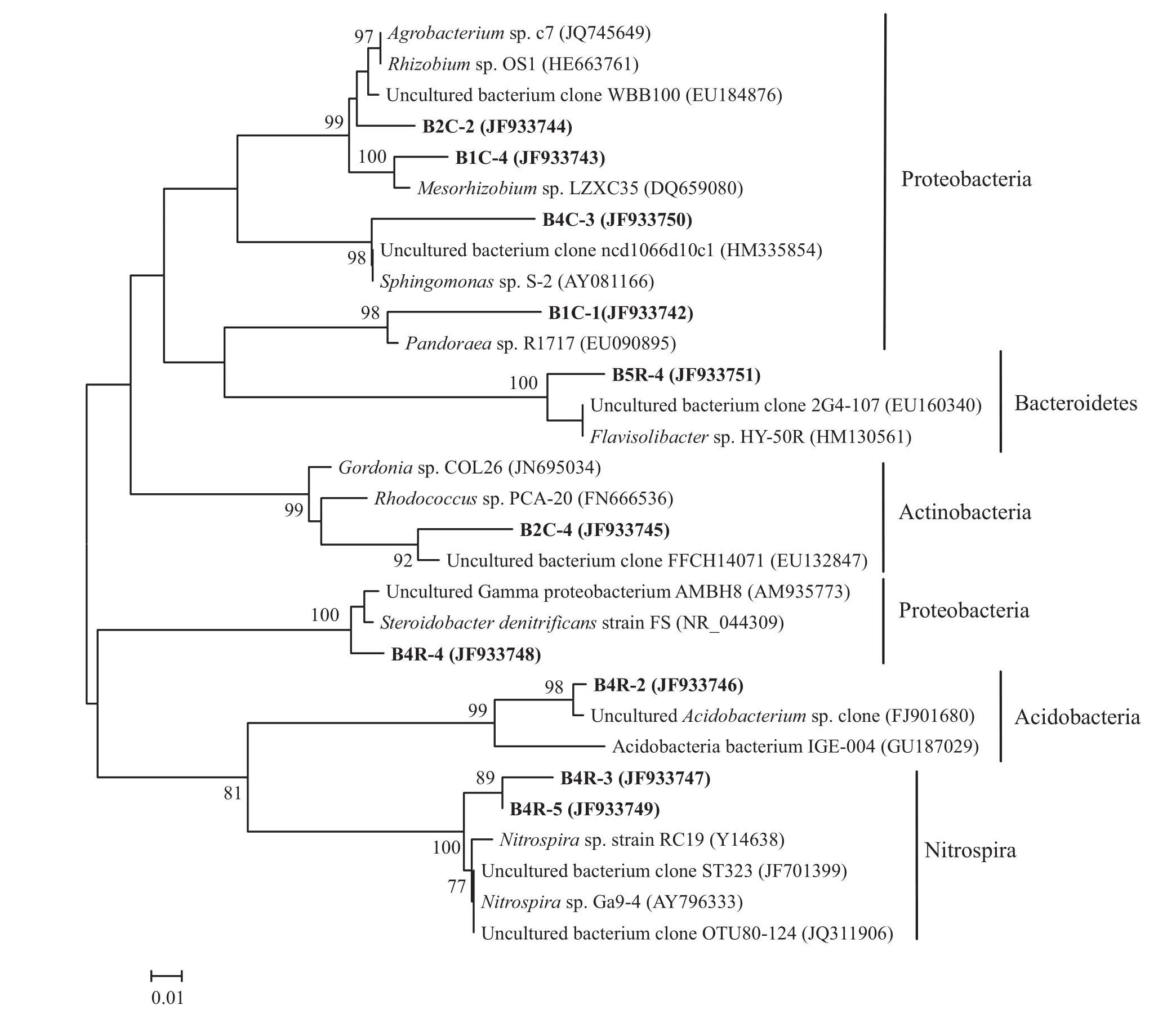
图3 DGGE条带细菌16S rRNA基因系统发育树Fig. 3 Phylogenetic analysis of 16S rRNA gene sequences of bacteria from DGGE bands
3 讨论与结论
植物根际细菌作为一类重要的微生物,植物的生长发育有着密切的关系[14-15],植物与其能够相互影响和作用,有时这种作用是互利的,有时却是偏利的,甚至有时对某一方有害。不同种类的植物根际细菌数量、种群及优势细菌等都有较大的差异[16-17]。刘洪华[18]运用PCR-DGGE分析烟草根际土壤细菌群落结构及多样性时发现,细菌的种类变化随着土壤类型及植物生长发育时期而变化,在大部分土壤中烟叶采收期细菌多样性指数要小于旺长期。烟草生长后期根际细菌多样性小于生长旺期是否与根分泌物的多少及种类有关?答案是肯定的,植物通过其根分泌物影响土壤而影响土壤微生物群落结构及其多样性[19]。陈冬梅等[20-21]在对盆栽烟草外源添加不同浓度植烟土壤提取物质时发现,外源添加物质处理后,烟草根际土壤细菌群落减少,多样性水平下降。在本研究中,通过DGGE分析结果也表明烟草的种植对免培养细菌群落结构及多样性有比较明显的影响。结果显示,系统的根际效应在烟草土壤细菌多样性中均无法体现,甚至有的样点出现了负根际效应现象。这与我们前期对硝化细菌和nifH基因的研究较为类似,虽然烟草成熟期(下部叶采收期)的根际硝化细菌和nifH基因多样性程度总体优于非根际土壤,但系统的根际效应已无法体现[22-23]。
结果表明,相对于非根际土壤样品,根际土壤中优势细菌的菌群种类更为丰富。由于DGGE成功克隆的条带数量有限,所获得的免培养细菌种群信息也较为有限,但通过分析仍可以清晰的发现,烟草根际土壤中优势免培养细菌为Steroidobacter属、硝化螺旋菌属、根瘤菌目(Rhizobiales)和α-变形菌;烟草非根际土壤中优势免培养细菌为Steroidobacter属、放线菌目(Actinomycetales)和Chitinophagaceae科。
总体上看,烟草根际土壤和非根际土壤中优势免培养微生物的物种丰富度比较接近,但是非根际土壤中微生物表现出更强的特异性。相对于非根际样品,免培养微生物群落结构在根际样品中的同源性表现出更强的趋势,印证了烟草生长后期根际环境的恶化。只出现在根际土壤样品中的微生物只有栓菌属(Trametes);非根际特有微生物包括假诺卡氏菌(Pseudonocardia)、厄氏菌(Oerskovia)、小单孢菌(Promicromonospora)、蜡蚧菌属(Lecanicillium)、假单孢菌属(Pseudomonas)。
[1]雷丽萍, 郭荣君, 缪作清, 等. 微生物在烟草生产中应用研究进展[J]. 中国烟草学报, 2006, 12(04): 47-51.
[2]杨友才, 黄晓辉, 龚理, 等. 烟草内生菌对烟草根结线虫病的防治效果[J]. 生态学杂志, 2009, 28(11): 2269-2272.
[3]雷丽萍, 夏振远, 郭荣君, 等. 非硝酸盐还原细菌K18降低TSNA机理的初步研究[J]. 中国烟草科学, 2009,30(05): 54-57.
[4]黄晓辉, 杨友才, 谭周进, 等. 四个品种烟草内生微生物的分布特征[J]. 生态学报, 2009, 29(12): 6827-6833.
[5]彭细桥, 刘红艳, 罗宽, 等. 烟草内生青枯病拮抗细菌的筛选和初步鉴定[J]. 中国烟草科学, 2007, 28(02): 38-40.
[6]林凤敏, 姬文秀, 李虎林. 烟草根际与非根际细菌的系统发育多样性研究[J]. 湖北农业科学, 2011, 50(05):1058-1062.
[7]Zhao Zhiqi ng, Feng Yijian, Feng Huajun. Anaerobic biotransformation of fluoronitrobenzenes and microbial communities in methanogenic systems[J]. J Environ Sci Hea, 2014, 49(10): 1187-1197.
[8]Paula V A C, Carvalho F D, Cavalcante F S, et al. Clinical signs and bacterial communities of deciduous necrotic root canals detected by PCR-DGGE analysis: Research association[J]. Arch Oral Biol, 2014, 59(8): 848-854.
[9]Junier P, Alfaro M, Guevara R. Genetic diversity of Rhizobium present in nodules ofPhaseolus vulgarisL.cultivated in two soils of the central region in Chile[J].Appl Soil Ecol, 80: 60-66.
[10]Reichel R, Patzelt D, Barleben C. Soil microbial community responses to sulfadiazine-contaminated manure in different soil microhabitats[J]. Appl Soil Ecol, 2014, 80: 15-25.
[11]Li Pan, Li Sha, Cheng Lili. Analyzing the relation between the microbial diversity of DaQu and the turbidity spoilage of traditional Chinese vinegar[J]. Appl Microbiol Biot,98(13): 6073-6084.
[12]吴凤芝, 王澍, 杨阳. 轮套作对黄瓜根际土壤细菌种群的影响[J]. 应用生态学报, 2008, 19(12): 2717-2722.
[13]李坤, 郭修武, 孙英妮, 等. 葡萄连作对土壤细菌和真菌种群的影响[J]. 应用生态学报, 2009, 20(12): 3109-3114.
[14]胡智勇, 陆开宏, 梁晶晶. 根际微生物在污染水体植物修复中的作用[J]. 环境科学与技术, 2010, 33(05): 75-80.
[15]王树和, 王晓娟, 王茜, 等. 丛枝菌根及其宿主植物对根际微生物作用的响应[J]. 草业学报, 2007, 16(03): 108-113.
[16]祝明亮, 夏振远, 张克勤, 等. 淡紫拟青霉在烤烟根际定殖能力分析[J]. 中国烟草学报, 2004, 10(01): 29-32.
[17]彭智良, 黄元炯, 刘国顺, 等. 不同有机肥对烟田土壤微生物以及烟叶品质和产量的影响[J]. 中国烟草学报,2009, 15(02): 41-45.
[18]刘洪华. 烤烟根际土壤养分、酶活性和微生物动态变化研究[D]. 河南:河南农业大学出版社, 2011.
[19]蒋婧, 宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用[J]. 植物生态学报, 2010, 34(08): 979-988.
[20]陈冬梅, 黄锦文, 柯文辉, 等. 连作烟草根际土壤化感潜力评价及化感物质鉴定[J]. 中国烟草学报, 2012, 18(01):46-52.
[21]陈冬梅, 吴文祥, 王海斌, 等. 植烟土壤提取物质对烟株生长及根际土壤细菌多样性的影响[J]. 中国生态农业学报, 2012, 20(12): 1614-1620.
[22]李小林, 辜运富, 张小平, 等. 烟草成熟期根际硝化细菌种群的结构及其多样性[J]. 中国农业科学, 2011, 44(12):3462-2468.
[23]Li Xiaolin, Penttinen P, Gu Yunfu, et al. Diversity of nifH gene in rhizosphere and non-rhizosphere soil of tobacco in Panzhihua, China. Ann Microbiol. 2012, 62: 995-1001.
Study on diversity and community structure of bacteria in soils at tobacco maturing stage
LI Xiaolin1,LI Qiang2,PENG Weihong1,GAN Bingcheng1,ZHENG Linyong1,ZHANG Xiaoping3
1 Soil and Fertilizer Institute, Sichuan Academy of Agricultural Sciences, Chengdu 610066, China;2 College of Life Science, Sichuan University, Chengdu 610065, China;3 Department of Microbiology, College of Resource and Environment, Sichuan Agricultural University, Chengdu 610031, China
Five tobacco rhizosphere soil samples and fi ve non-rhizosphere soil samples were collected from main tobacco-growing areas of Yanbian County and analyzed by PCR-DGGE technology. Results showed that the bacteria community structure and diversity showed signi fi cant difference among different soils, and the bacteria diversity of non-rhizosphere soil was even higher than that of rhizosphere soil, which indicated that rhizosphere effect weakened at tobacco maturing stage due to rhizosphere secretion. Moreover, the dominant bacteria community structures of rhizosphere soil were more abundant than those in non-rhizosphere soils. Steroidobacter was a dominant bacteria group in tobacco soil.Nitrospira and Rhizobialeswere the dominant bacteria in tobacco rhizosphere soil andActinomycetales and Chitinophagaceaewere dominant in non-rhizosphere soil. This study showed that tobacco rhizosphere effect weakened at maturing stage.
tobacco; mature stage; bacteria; community structure; rhizosphere effect; DGGE
李小林,李强,彭卫红,等. 烟草成熟期土壤细菌群落结构及多样性[J]. 中国烟草学报,2015,21(4)
国家863计划项目(2013AA102802)
李小林(1985—),博士,助理研究员,主要研究方向为微生物多样性,Email:kerrylee_tw@sina.com
张小平(1962—),博士,教授,主要研究方向为土壤微生物多样性及固氮生物,Email:zhangxiaopingphd@126.com
2014-06-22
:LI Xiaolin,LI Qiang,PENG Weihong, et al. Study on diversity and community structure of bacteria in soils at tobacco maturing stage [J]. Acta Tabacaria Sinica, 2015, 21(4)

