短乳杆菌发酵液中γ-氨基丁酸的脱色和纯化工艺探讨
吴巧玉,谢祥聪,高爱同,蒋冬花
(浙江师范大学化学与生命科学学院,浙江金华321004)
短乳杆菌发酵液中γ-氨基丁酸的脱色和纯化工艺探讨
吴巧玉,谢祥聪,高爱同,蒋冬花
(浙江师范大学化学与生命科学学院,浙江金华321004)
探讨了短乳杆菌(Lactobacillus brevis)L2菌株利用麦麸为培养基原料发酵生产γ-氨基丁酸(GABA),并对GABA的分离纯化工艺进行了研究。对6种大孔树脂和活性炭进行脱色效果筛选,ADS-7树脂对L2菌株发酵液具有最高的脱色率和GABA得率;优化了ADS-7大孔树脂脱色条件:在pH 5.0,脱色温度25℃,脱色时间1 h时,脱色效率大于95%,GABA得率达93%。优化了阳离子交换树脂D001分离纯化GABA的工艺条件:在25℃、上样脱色发酵液pH 5.0,流速为1 BV/h下,用去离子水和1 mol/L氨水分步洗脱效果最好。通过收集、浓缩及结晶等工艺得到针状GABA晶体,氢核磁共振(1H NMR)分析氢谱图与GABA标准品一致。
短乳杆菌;γ-氨基丁酸;脱色;分离纯化;结晶
γ-氨基丁酸(γ-aminobutyric acid,简称GABA)广泛存在于自然界,是一种非蛋白质组成的天然氨基酸[1],在哺乳动物的中枢神经系统中是最重要的抑制性神经递质,对机体的多种功能具有调节作用,如具有降低血压、治疗癫痫病、抗衰老、增进脑活力、营养神经细胞、改善更年期综合症等多种生理功能[2]。所以GABA正逐渐被广泛用于医药、食品保健、化工及农业等行业,具有广阔的应用范围和市场前景[3-4]。
目前国内外主要采用化学合成和生物转化法制备γ-氨基丁酸[5]。结晶法是获得氨基酸固体的一种常用的方法,结晶所得到的产品纯度高,产品吸湿程度相对小,比表面积也小,因此适合制备高纯度的产品。
乳酸菌是一种存在于人类体内,能够将碳水化合物发酵生成乳酸的益生菌,能帮助消化、有助于人体肠道的健康,因此常被视为健康食品。麦麸和小米糠是麦子和小米加工过程的副产品,含有丰富的蛋白质、脂肪、矿物质等营养素以及生育酚、亚油酸、γ-谷维醇等生理活性物质,被誉为“天赐营养源”[6-7],但在我国,绝大多数被用作低附加值的禽兽饲料,其所具有的营养价值和资源效益未得到充分发挥。利用乳酸菌发酵生产GABA通常使用MRS培养基[8],其配方为:酪蛋白胨、酵母膏、牛肉膏、葡萄糖、乙酸钠、磷酸氢二钾、柠檬酸二胺、吐温-80、硫酸镁及硫酸锰。相对于麦麸和小米糠培养基,MRS成分复杂,导致下游GABA分离纯化操作复杂,并且原料价格较高。钟环宇等[9]通过利用一定的手段及方法对发酵生产GABA的培养基进行优化,GABA产量将近达到了4 g/L。李秀凉等[10]对乳酸片球菌进行紫外诱变,并对发酵生产GABA的参数进行优化,GABA产量超过了5 g/L。目前,已有发酵稻米糠生产GABA的研究报道[11-12],但以小米糠为培养基原料,通过乳酸菌发酵合成GABA的研究尚未见报道。
本研究利用实验室前期从酸菜中筛选的高产GABA的短乳杆菌(L.brevis)L2菌株作为发酵菌株,以麦麸和小米糠等农副产品作为培养基主要成分发酵合成GABA[13],探讨发酵液脱色和GABA的分离纯化结晶工艺,旨在高产高效生产食药用级的GABA,并为工业化大规模生产提供参考依据,具有广泛的应用前景。
1 材料与方法
1.1材料
1.1.1供试菌株
短乳杆菌(L.brevis)L2菌株,由浙江师范大学微生物实验室前期从酸菜[14]中筛选得到,具有高产γ-氨基丁酸的特点,在麦麸和小米糠培养基中静止培养72 h,GABA产量可达25~30 g/L,保藏于中国典型培养物保藏中心,保藏号为:CCTCC NO:M 209132。
1.1.2主要试剂
活性炭:购买自浙江省金华市医药公司;ADS-7、XDA-6、HPD-500、HPD-600、HPD-826、LX-68等大孔吸附树脂,D001阳离子交换树脂购买自西安蓝晓科技有限公司;GABA标准品购买自Sigama公司。
1.1.3培养基
1)试管斜面培养基
葡萄糖15 g,酵母膏10 g,碳酸钙15 g,琼脂15 g,蒸馏水1000 mL,pH 6.5,用于L2菌株保藏。
2)MRS平板培养基
葡萄糖10 g,酵母膏10 g,蛋白胨5 g,乙酸钠2 g,硫酸镁20 mg,硫酸锰1 mg,氯化钠1 mg,硫酸亚铁1 mg,琼脂20 g,蒸馏水1 000 mL,pH 6.5,用于L2菌株菌种的活化。
3)GYP种子培养液
胰蛋白胨5 g,葡萄糖10 g,酵母膏5 g,丁二酸钠5 g,蒸馏水1 000 mL,pH 6.5,用于L2菌株种子培养液的制备。
4)麦麸发酵培养液
麦麸70 g/L,L-谷氨酸钠(L-MSG)60 g/L,蒸馏水1 000 mL,pH 4.0,用于L2菌株的发酵合成GABA。
1.2实验方法
1.2.1GABA发酵液的制备
冰箱中取出L2菌株试管斜面保存菌种,经MRS培养平板活化24 h后,取2环菌体接入50 mL GYP种子培养液中,30℃静止活化培养16 h作为发酵种子;以2%接种量接入麦麸发酵培养液中,30℃静置发酵培养72 h,可得GABA产量达25~30 g/L的乳酸菌发酵液。
1.2.2GABA发酵液的预处理
收集上述含GABA的乳酸菌发酵液,90℃水浴5 min后8 000 r/min离心10 min,收集上清。将上清液与75%乙醇混合(V/V=1∶1),搅拌均匀,4℃静止24 h,5 000 r/min离心10 min,取上清液,65℃旋转蒸发除去乙醇,用去离子水定容至原L2菌株发酵液体积。再经30 Kd超滤管超滤即得到GABA预处理液。此GABA预处理液将用于GABA的脱色、分离、纯化。
1.2.3GABA预处理液的脱色
大孔吸附树脂和活性炭经预处理后,用去离子水浸泡12 h,再用抽滤泵反复抽滤3次,放入50℃烘箱直至完全干燥。按5%(W/V)的量加入各种树脂与活性炭于预处理液中,150 r/min脱色摇床振荡1~2 h,最后计算GABA浓度及色价。
1.2.4GABA预处理液脱色效果的测定
以去离子水作对照,在420 nm波长下,分别测定粗提液、预处理液、洗脱液A420[15],平行测定3次。

1.2.5D001离子交换树脂纯化GABA工艺的优化
1)静态动态吸附实验
将一定初始浓度的GABA加入250 mL的锥形瓶中,再各加入一定量的树脂,用NaOH或HCl调节发酵上清液pH值,恒温振荡至平衡。D001树脂吸附平衡后,液相浓度由HPLC法确定,吸附相浓度由下式计算[16]:
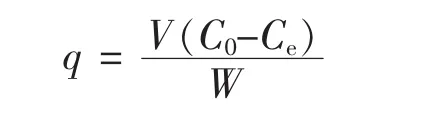
式中:q为每克湿树脂中可平衡GABA的吸附量;V为溶液体积,单位为L;C0为GABA初始质量浓度,单位为g/L;Ce为GABA平衡时的质量浓度,单位为g/L;W为离子交换树脂质量,单位为g。
2)发酵液动态穿透能力
将已经过预处理的发酵液,调至一定的pH值,用蠕动泵控制一定的流速上样,同时用分部收集器分部收集流出液,HPLC测定其中的GABA含量。以流出液体积为横坐标,C/C0为纵坐标,绘制穿透曲线(C0为GABA初始质量浓度,单位为g/L;C为不同的流出液体积对应的GABA质量浓度,单位为g/L)。
3)上样流速对D001树脂吸附GABA的影响
用D001离子交换树脂吸附,将标准GABA溶液分别以0.5、1.0、2.0 BV/h的流速上样,流出液用分部收集器收集,以HPLC法检测其中的GABA含量,绘制不同流速下的穿透曲线。
流速bv/h:单位时间水(液体)中一个质点移动的距离。单位BV=bed volume指装在树脂床中的树脂体积大小。
1.2.6GABA的结晶与鉴定
1)GABA洗脱液的收集和结晶
由分部收集器收集经洗脱剂洗脱离子交换柱流出的液体,对收集到的液体进行浓缩,将一定体积的无水乙醇与收集、浓缩的洗脱液混合。然后进行结晶,通过逐步降温系统,控制晶体的形成,最后过滤得GABA晶体。
2)GABA检测和鉴定
将GABA晶体溶解于氘代水(CDH2O),用傅立叶核磁共振波谱仪测定GABA晶体的1H NMR谱,对GABA晶体进行纯度和结构鉴定。
2 结果与分析
2.1大孔脱色树脂的筛选和脱色条件的优化
2.1.1脱色树脂的选择和脱色时间的确定
25℃中性环境下,加入5%(W/V)的6种大孔树脂和活性炭吸附1 h,对GABA预处理液的脱色效果见图1。其中ADS-7和活性炭脱色效果最好,脱色率达90%以上,其余的大孔树脂脱色率均在75%以下。
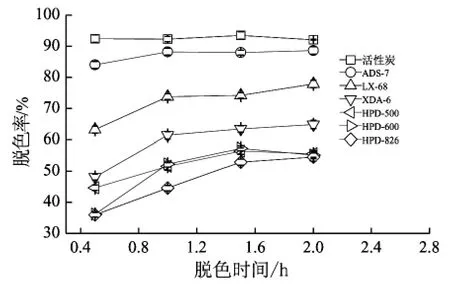
图1 6种大孔树脂和活性炭对GABA预处理液脱色效果的影响
6种大孔树脂和活性炭随时间的增加对GABA吸附效果见图2。ADS-7和LX-68在脱色1 h时GABA的得率分别高达95%和90%,1 h后GABA得率明显下降。其余树脂处理液中GABA得率均比较低,其中活性炭处理的发酵液GABA得率最低,1 h时仅为75%左右。
综合分析脱色效果和GABA得率,脱色树脂选用ADS-7,脱色时间定为1 h。

图2 6种大孔树脂和活性炭对GABA得率的影响
2.1.2温度对ADS-7脱色效果和GABA得率的影响
在不同温度(4、25、37、50℃)条件下,ADS-7对GABA预处理液的脱色效果和GABA吸附情况见图3。随温度的升高ADS-7的脱色效果显著提高,对GABA吸附率也有所提高,但平衡后吸附率逐渐下降。故ADS-7适宜的脱色温度为25℃。
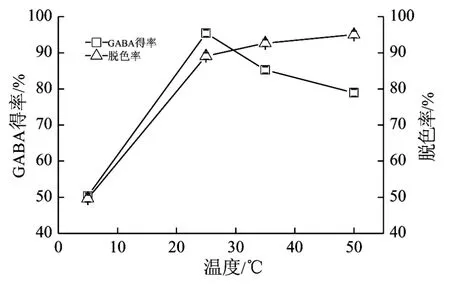
图3 温度对ADS-7脱色率和GABA得率的影响
2.1.3pH对ADS-7脱色效果及GABA得率的影响
在25℃下,将GABA预处理液调至到不同的pH,加入5%(W/V)的ADS-7吸附1 h,pH对ADS-7脱色效果及GABA得率的影响见图4。ADS-7在酸性或者偏酸性环境中脱色比较完全,当pH大于7时脱色效果快速变差。当预处理液pH为5.0时,GABA得率最高。故ADS-7适宜的脱色pH为5.0。
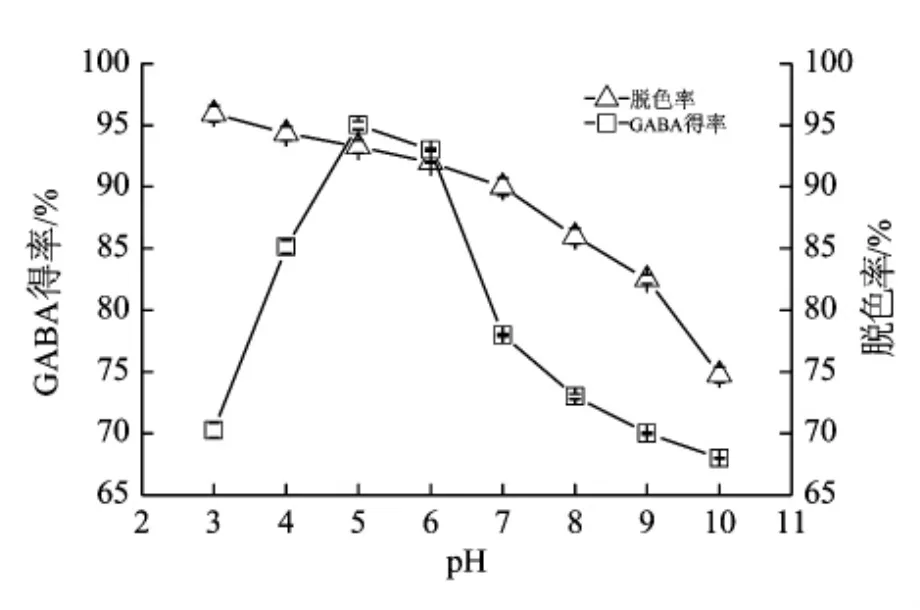
图4 pH对ADS-7脱色率和GABA得率的影响
2.1.4脱色过程中GABA得率和脱色率
利用上述优化的ADS-7脱色条件,在25℃下,GABA预处理液(pH 5.0)加入5%ADS-7大孔树脂脱色1 h,HPLC法检测GABA得率可达93%,脱色液的脱色率达96.5%。
2.2D001离子交换树脂分离纯化GABA条件优化
2.2.1pH对D001静态交换容量的影响
取10 mL标准GABA溶液,调至不同pH值,加入一定量的D001离子交换树脂,恒温振荡至平衡,测定最终pH。吸附平衡后,液相中GABA浓度由HPLC法确定,再计算各种pH下的静态交换容量。结果如图5,在pH 3.5~6.5之间,树脂有最好交换效果存在点,对GABA吸附容量较大。经脱色处理的发酵液pH为5.0,因此发酵液上样时不必调节pH,可以直接上柱。
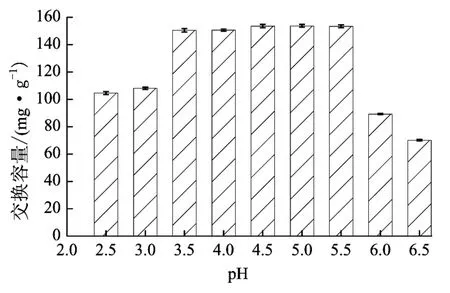
图5 pH对D001静态交换容量的影响
2.2.2GABA浓度对D001静态交换容量的影响
在25℃下,GABA浓度对D001静态交换容量的影响如图6,D001对GABA最大交换容量为6 g/L。
2.2.3上样流速对D001树脂吸附GABA的影响
将标准GABA溶液分别以0.5、1.0、2.0 BV/h的流速上样,不同流速下的穿透曲线如图7所示,流速降为0.5 BV/h穿透点变化不大,且导致上柱时间延长;流速为2 BV/h时,穿透路径相对缩短,交换不充分,导致GABA损失。分析实验数据得理想的流速为1 BV/h。

图7 不同上样流速下的穿透曲线
2.3GABA的洗脱、浓缩与结晶

图8 L2菌株发酵液中提取的GABA透明针状结晶
用大量去离子水冲洗D001树脂以洗去解离状态的谷氨酸,然后以1 BV/h的流速,用1 mol/ L氨水作为洗脱剂,对D001饱和树脂柱进行洗脱。分部收集流出的液体,65℃旋转蒸发浓缩收集的液体。一般的结晶方法有冷却结晶、蒸发结晶及反应结晶3种工艺[17],氨基酸结晶工业中常向氨基酸水溶液中加入适量有机溶剂来降低其饱和浓度达到结晶的目的。为了获得GABA结晶,将6倍体积的无水乙醇与收集、浓缩的洗脱液混合,然后通过逐步降温系统控制晶体的形成。最后,过滤得GABA晶体。图8为GABA针状结晶,晶粒较粗大,无色透明,宏观形态呈柱状平行六面体。
2.4GABA晶体结构和纯度分析
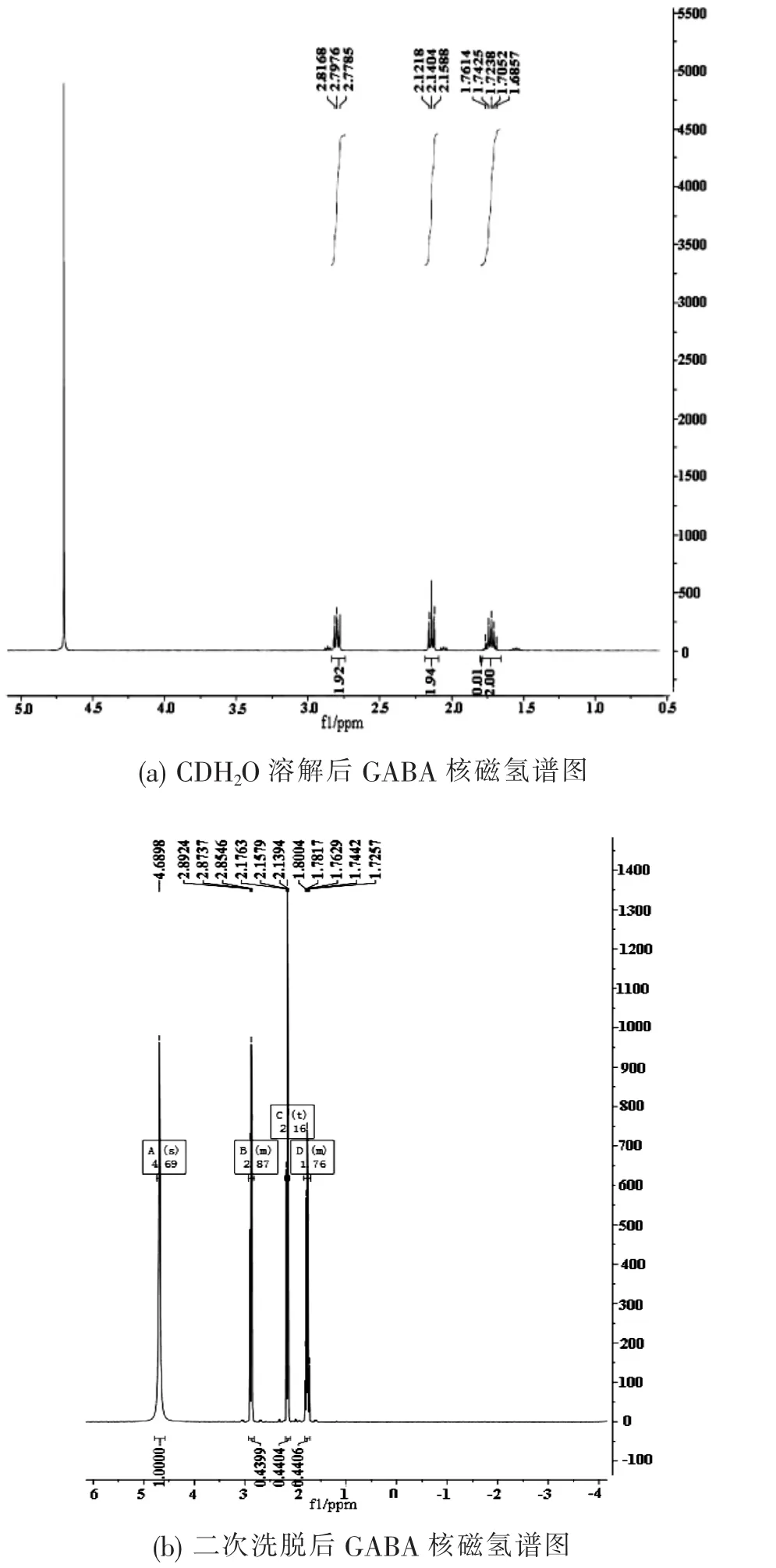
图9 L2菌株发酵液中提取的GABA晶体核磁氢谱图
将上述所得的GABA针状结晶,用CDH2O溶解后进行氢核磁共振(1H NMR)分析,氢谱图如图9(a)所示,图谱有杂峰,说明有一定的杂质存在。在此基础上,晶体溶解液再次经过ADS-7脱色、离心、吸附、洗脱后,收集二次洗脱液。氢谱图9(b)所示,图谱整齐无异质杂峰出现,且与GABA标准品的吸收峰一致,结果证明从短乳杆菌L2菌株发酵液中提取的GABA纯度很高,结构准确。γ-氨基丁酸的1H NMR图解析结果为:1H NMR(400 MHz,D2O)δ 4.69(s,1H),2.93(m,1H),2.16(t,J=7.4 Hz,1H),1.83(m,1H).13C NMR(101 MHz,D2O)δ 23.55,34.32,39.22,181.47。
3 讨论
γ-氨基丁酸(GABA)在哺乳动物的中枢神经系统中是最重要的抑制性神经递质,本实验利用从酸菜中筛选的短乳杆菌L2菌株,发酵廉价农副产品麦麸培养基生产GABA。GABA的乳酸菌发酵液上清与75%乙醇混合(V/V=1∶1),经离心取上清液于65°C旋转蒸发除去乙醇获得GABA预处理液。分别利用6种大孔树脂和活性炭吸附GABA预处理液,150 r/min脱色摇床振荡1~2 h后,ADS-7和活性炭脱色效果最好。马强[18]研究结果显示在pH值为5.0,脱色温度70°C,脱色时间30 min的优化脱色条件下,GABA的脱色率为90%~94%,文章中采用优化的结晶工艺,GABA晶体得率为72.2%,损失率为6%~8%,所得晶体纯度达到96%以上。而本实验在pH 5.0,脱色温度25°C,脱色时间1 h的优化脱色条件下,GABA的脱色率有所提高,大孔树脂ADS-7在此优化条件下脱色率达到95%以上。用HPLC检测GABA回收率,GABA得率有所提高达到93%,而损失率仅为7%。最后,本实验通过收集、浓缩及结晶等工艺得到针状晶体及白色粉末,用GABA纯品做对照,通过氢核磁共振(1H NMR)分析发现氢谱图中几乎无杂质峰并且与GABA标准品的出峰一致,表明从L2菌株发酵液中提取的GABA纯度很高,接近100%。
[1]KOMATSUZAKI N,SHIMA J,KAWAMOTO S,et,al.Production of γ-aminobutyric acid(GABA)by Lactobacillus paracasei isolated from tradition fermented food[J].Food Microbiology,2005,22(6):497-504.
[2]HAYAKAWA K,KIMURA M,KASAHA K,et al.Effect of a γaminobutyric acid-enriched dairy product on the blood pressure of spontaneously hypertensive and normotensive Wistar-Kyoto rats[J].British Journal of Nutrition,2004,92(3):411-417.
[3]KIM J Y,LEE M Y,JI G E,et al.Production of γ-aminobutyric acidinblackraspberryjuiceduringfermentationby Lactobacillus brevis GABA100[J].International Journal of Food Microbiology,2009,130(1):12-16.
[4]YOKOYAMA S,HIRAMATSU J I,HAYAKAWA K.Production of γ-aminobutyric acid from alcohol distillery lees by Lactobacillus brevis IFO-12005[J].Journal of Bioscience and Bioengineering,2002,93(1):95-97.
[5]白松,林向阳,阮榕生,等.γ-氨基丁酸的分布和制备[J].现代食品科技,2005,21(2):202-205.
[6]LIANG Shaohua,YANG Guolong,MA Yuxiang.Chemical characteristics and fatty acid profile of foxtail millet bran oil[J]. Journal of the American Oil Chemists Society,2010,87(1):63-67.
[7]张超,张晖,李冀新.小米的营养以及应用研究进展[J].中国粮油学报,2007,22(1):51-55.
[8]YANG S Y,LU F X,LU Z X,et al.Production of γ-aminobutyric acid by Streptococcus salivarius subsp.thermophilus Y2 under submerged fermentation[J].Amino Acids,2008,34(3):473-478.
[9]钟环宇,许建军,江波.利用响应面分析法优化γ-氨基丁酸发酵培养基[J].无锡轻工大学学报,2004,23(3):19-22.
[10]李秀凉,孙晓宇,韩晓云,等.产γ-氨基丁酸的乳酸菌株的诱变选育[J].食品科技,2012,37(9):16-19.
[11]杨丽丽,赵城彬,吴非.乳酸菌发酵米糠产γ-氨基丁酸最适条件的研究[J].食品工业科技,2012,33(16):217-220.
[12]严聃.发酵法从米糠中提取高浓度γ-氨基丁酸粉末的工艺研究[J].湖南科技学院学报,2009,30(4):89-90.
[13]蒋冬花,高爱同,毕珂,等.乳酸菌发酵小米糠生产γ-氨基丁酸的配方和条件优化[J].浙江师范大学学报(自然科学版). 2013,36(1):6-10.
[14]缪存影,蒋冬花,徐晓波,等.酸菜中高产γ-氨基丁酸乳酸菌的筛选和鉴定[J].微生物学杂志,2010,30(2):28-32.
[15]BUEDO A P,ELUSTONDO M P,URBICAIN M J.Amino acid loss in peach juice concentrate during storage[J].Innovative Food Science and Emerging Technologies,2000,1(4):281-288.
[16]付勇,吴国光,彭奇均.D001型阳离子交换树脂吸附L-苏氨酸[J].化工进展,2007,26(3):422-425.
[17]冯容保.氨基酸的结晶工艺[J].发酵科技通讯.2002,31(4):11-12.
[18]马强,张涛,江波,等.γ-氨基丁酸结晶热力学的研究[J].食品工业科技,2010,31(2):77-79.
(责任编辑:朱小惠)
Decolorization and purification of GABA from Lactobacillus brevis fermentation broth
WU Qiaoyu,XIE Xiangcong,GAO Aitong,JIANG Donghua
(College of Chemistry and Life Science,Zhejiang Normal University,Jinhua 321004,China)
Fermentative production of γ-aminobutyric acid(GABA)by Lactobacillus brevis using wheat bran as raw material and purification of GABA from fermentation broth were studied.Six kinds of macroporous resins and activated carbon were screened and the results indicated that resin ADS-7 had the highest decolorization ability and GABA yield.The optimal ADS-7 decolorization conditions were as follows:pH 5.0,decolorization temperature 25℃,decolorization time 1 h.Under these conditions,the decolorizing efficiency was more than 95%,and the GABA yield reached up to 93%.The purification conditions of GABA by D001 cation exchange resin were optimized as follows:temperature 25℃,fermentation broth pH 5.0,flow rate 1 BV/h,elution with deionized water and 1 mol/L ammonia.Needle GABA crystal was obtained through concentration and crystallization,and confirmed by1H NMR analysis.
Lactobacillus brevis;GABA;decolorization;separation and purification;crystallization
TQ922
A
1674-2214(2015)03-0012-06
2015-04-09
国家自然科学基金资助项目(31270061)
吴巧玉(1990—),女,河南信阳人,硕士,研究方向为应用微生物学,E-mail:18757699901@163.com.通信作者:蒋冬花教授,E-mail:jdh@zjnu.cn.