气浮-·OH强氧化组合工艺处理高藻水的研究
洪伟辰,白敏冬*,满化林,黄孟斌,李 芳,张芝涛(.厦门大学海洋生物资源开发利用协同创新中心,厦门大学环境与生态学院,福建 厦门 36005;.大连海事大学环境工程研究所,辽宁 大连 606)
气浮-·OH强氧化组合工艺处理高藻水的研究
洪伟辰1,白敏冬1*,满化林1,黄孟斌1,李 芳1,张芝涛2(1.厦门大学海洋生物资源开发利用协同创新中心,厦门大学环境与生态学院,福建 厦门 361005;2.大连海事大学环境工程研究所,辽宁 大连 116026)
以库区天然水培养的二形栅藻(Scenedesmus dimorphus)为研究对象,利用大气压强电场电离放电产生羟基自由基(·OH),结合压力溶气气浮前处理工艺处理高藻水.实验结果表明,对于藻密度为65.6×104cells/mL,浊度为10.8NTU, CODMn为6.74mg/L的高藻水,在总氧化剂TRO浓度为1.03mg/L时,藻类去除效率达到100%;总细菌,总大肠菌群和大肠埃希氏菌均未检出;出水CODMn由1.43mg/L降至1.25mg/L,降低了10%;浊度由0.66NTU降至0.54NTU,降低了12.59在排放高藻水的主管路中·OH杀藻的接触反应时间仅为6s.因此,气浮-·OH强氧化组合工艺可高效快速地处理高藻水,为保障水源水的供水安全探索了一种新的思路.
高藻水;组合工艺;羟基自由基;杀藻;净化水体
随着人类工业化的发展,富营养化问题已经成为一个全球性的难题[1-2],水华事件严重威胁着城市供水安全[3-5].水源地高藻爆发,常规水处理工艺絮凝沉淀-砂滤-消毒已不能适应[6],出水水质普遍超标,且活藻絮凝沉淀效果差,出水藻密度高,堵塞滤池和穿透滤池,使水厂产能下降.同时藻死亡释放的藻毒素,致嗅物质等代谢产物严重威胁人体的健康[4,7-8].
对此,国内外很多学者对化学法处理高藻水进行了研究.如Zamyadi等[7]用氯法处理铜绿微囊藻的研究表明,10mg/L的氯气处理藻密度为5×104cells/mL的铜绿微囊藻,反应60min后能达到70%的藻类致死率.Daly等[8]用氯气处理铜绿微囊藻的实验也显示了相似的结果,藻密度为3.78×104cells/mL的铜绿微囊藻在5mg/L的氯气作用下,反应30min后,能达到100%的致死效果. Miao等[9]用5mg/L的臭氧处理叶绿素a浓度为440μg/L左右的铜绿微囊藻时, 经过30min的处理,叶绿素a降低了84%左右;Coral等[10]用4mg/L的臭氧处理用纯水配制的藻密度为2 4 ×104cells/mL的水华鱼腥藻,经过10min的接触时间后,致死率达到了100%.如Li等[11-12]用60mg/L的高锰酸酸钾处理藻密度为640× 104cells/mL的铜绿微囊藻时,经过270min的处理后,光合活性Fv/Fm降低了93.3%.但这些化学法都存在一定问题:氯法投加的剂量大,处理时间长,氯消毒副产物增加[7,10];臭氧法处理时间10~ 30min,产生溴酸盐等消毒副产物;高锰酸钾法不仅投加剂量大,处理时间长,且易出现锰含量超标,出水色度大.因此,目前急需研发一种安全,快速,高效的高藻水处理技术应对日益严重的藻类爆发问题.
羟基自由基(·OH)作为高级氧化技术的核心,其氧化还原电位E0=2.80V与氟相当,是强氧化剂;具有非常高的反应速率常数[109mol/(L·s)],是其它氧化剂的107倍以上;反应后生成H2O和O2,无残余药剂,与其他高藻水处理方法相比具有不可比拟的优势[10,13-14].本研究以大气压强电场电离放电高效产生羟基自由基为核心[13],建立气浮-强氧化杀藻组合工艺,对高藻水进行处理研究.
1 材料与方法
1.1 高藻水的制备
以厦门饮用水源地汀溪水库水为背景水,添加的藻种为二形栅藻Scenedesmus dimorphus(FACHB-1248,购于中国科学院水生生物研究所淡水藻种库),培养成为以二形栅藻为优势藻的高藻水.
1.2 实验系统
气浮-·OH组合工艺处理流程如图1所示,实验采用了平流式压力溶气气浮设备,投加的混凝剂为聚合氯化铝(PAC),进水流量为1t/h,分离室水力停留时间约为18min.气浮处理能去除水中大部分的悬浮颗粒,降低水体浊度.但对于高藻水,气浮处理后仍残留有大量的藻类.气浮处理后水样通入到·OH处理单元中,通过射流器的充分混合和水力空化作用,制备高浓度的·OH混合液,在管路中完成对水中藻类和细菌的杀灭,并同时降解水中有机物,净化水体水质.A为原水取样点;B为气浮处理后取样点;C为·OH处理后取样点,其中氧等离子体注入点到取样点的反应时间为6s.
·OH处理单元采用的是大气压强电场电离放电高效产生羟基自由基的技术.在氧等离子体发生源中,窄间隙放电电场强度E≥100kV/cm,电子平均能量≥10eV,电子密度≥1014/cm,电离占空比≥2%,大量电子具有将O2电离(12.5eV)、离解(8.6eV)的高能量,可生成高浓度的氧等离子体O2+, O(1D), O(3P), O3等,在射流器的高速射流和水力空化作用下与水分子的迅速反应生成大量的·OH、H2O2等[15],进而生成羟基自由基引发剂H,再与氧等离子体反应生成大量的·OH,及H2O2, O3, HO2¯, O2·¯, O3·¯, HO3·和H2O氧自由基溶液[14],其浓度用总氧化剂TRO来表示.

图1 气浮-羟基自由基杀藻组合工艺流程示意Fig.1 Dissolved air flotation combined with advanced oxidation technology
1.3 实验方法
1.3.1 六联搅拌实验 在气浮处理前首先进行六联搅拌实验,通过六联搅拌实验(梅宇MY3000-6G,中国)确定絮凝剂聚合氯化铝(PAC)的最佳投加量.实验过程为:向6个实验烧杯中分别加入1L水样和不同的PAC剂量,经过300r/min的快速搅拌1min和80r/min的慢速搅拌8min,静置沉淀30min后,测定上清液浊度.
1.3.2 组合工艺实验 采用图1所示的气浮-·OH组合工艺对高藻水进行处理.其中原水藻密度为65.6×104cells/mL,其优势藻为二形栅藻,占95%,浊度为10.8NTU,其中气浮单元PAC投加量6.0mg/L,羟基处理单元TRO注入量为1.03mg/L.分别对原水A点,气浮处理B点和·OH处理后C点水样中藻类,细菌和常规水质指标进行检测.
1.4 检测方法
1.4.1 总氧化剂TRO的检测 TRO是以·OH为主,包括H2O2, H,¯, HO3和H2O等氧自由基的总氧化剂,使用在线监测仪(ATi Q45H,美国)对TRO浓度进行测定,同时使用DPD(N,N-二乙基对苯二胺)分光光度法对浓度进行校正,该方法是根据USEPA标准330.5建立的,使用紫外可见分光光度仪(Bioquest CE2501,英国)测定[16].
1.4.2 藻类的检测 在避光条件下,取1mL水样于2.5mL离心管中,并加入10μL浓度为的100 μmol/L的SYTOX-Green核酸染剂,孵化培育15min,然后取100 μL染色后水样于20mm× 20mm藻类计数框中,用荧光显微镜(Nikon ECLIPSE 90i)分别在绿色和蓝色激发光下观察藻细胞的荧光情况,计数死藻和活藻的数量.其中活细胞中叶绿素a在绿色激发光下发出红色荧光;死细胞由于细胞膜通透性发生改变,使SYTOX-Green核酸染剂能进入到细胞内,与DNA结合,在蓝色激发光下发出绿色荧光.
1.4.3 叶绿素a的检测 取一定量的藻液用GF/F玻璃纤维膜(Whatman)过滤,将玻璃纤维膜剪碎置于15mL离心管中,并加入90%的丙酮10mL,置于-20 ℃的冰箱里萃取12h,取出离心,用荧光分光光度计(安捷伦 Cary Eclipse)在激发波长430nm,发射波长663nm下测定叶绿素a的浓度.
1.4.4 光合活性Fv/Fm的检测[12]Fv/Fm表征细胞光合反应中心Ⅱ(PSⅡ)最大光量子产率,是细胞的光合活性的重要指标.取一定体积水样于Walz Phyto-PAM(德国)检测池中,暗反应5min后,测定其初始荧光强度和最大荧光强度,测得水样Fv/Fm.
1.4.5 细菌的检测 菌落总数的测定方法为国标(GB/T 5750.12-2006)[17]规定的平皿计数法.总大肠菌群和大肠埃希氏菌的测定方法为固定底物技术酶底物法[18].
1.4.6 水质指标的检测 CODMn,总氮(TN),总磷(TP),氨氮(NH3-N)测定方法依据的是中国环保总局编写的《水和废水监测分析方法》(第四版)[19];浊度采用HACHI 1900C便携式浊度仪测定;溶解氧(DO)采用WTW IDS3100便携式溶解氧仪测定;总有机碳(TOC)是由SHIMADZU TOC-LCPH测定.
2 结果与讨论
2.1 混凝搅拌实验
如图2所示,原水浊度为10.8NTU,随着PAC投加量增加,上清液浊度呈下降趋势.在PAC投加量超过6.0mg/L时,浊度逐渐保持平稳,说明用PAC对原水进行絮凝时,使原水脱稳所需的PAC剂量约为6.0mg/L.

图2 絮凝剂投加量与水样沉淀后浊度变化曲线Fig.2 Effect of coagulant dosage on sedimentation
2.2 组合工艺对高藻水的处理效果
组合工艺各阶段实验结果如表1所示.
从处理前后藻细胞密度,叶绿素a和光合活性Fv/Fm可以看出:气浮后二形栅藻藻密度为5.9×104cells/mL,去除率为91%,叶绿素a降低了87.7%,因为水中藻类,胶体等悬浮颗粒在PAC的絮凝作用下,形成更大颗粒的悬浮物质,在气浮池中能使大量的微气泡粘附在其表面,通过浮力将藻类带到水面,利用刮渣机将其去除.光合活性Fv/Fm在气浮前后并无明显变化,降低了7.35%,因为气浮工艺对藻类光合活性影响不大,细胞保持了较好的完整性.因此,采用气浮单元预处理,可以去除原水中大量的藻并降低浊度,为羟基自由基杀灭打下良好的基础.
气浮后的高藻水仍含有5.9×104cells/mL的藻类,在管路中经过TRO为1.03mg/L的·OH处理后,荧光染色后显示,二形栅藻全部致死,杀灭率为100%;叶绿素a从29.84μg/L降低到18.72μg/L;脱色率为37.26%,光合活性Fv/Fm从0.63降到0.3,变化率为52.38%,有明显的降低.因为羟基自由基是强氧化剂,对高藻水中的藻类具有快速的致死特性,氧化降解细胞中叶绿素和破坏细胞光合活性,本实验从三个方面证明了·OH对藻类的快速高效的致死效果.

表1 组合工艺对高藻水的处理效果Table 1 Effect of algae-laden water treated by dissolved air flotation combined with advanced oxidation technology
原水中总细菌为20300CFU/mL,气浮后剩余2200CFU/mL,去除率达到了89.16%;总大肠菌群由1650CFU/100mL降至286CFU/100mL,去除率为82.67%;大肠埃希氏菌的去除率为72.86%.大部分细菌在PAC的絮凝作用下,能与藻类,胶体等悬浮颗粒聚集成较大颗粒,通过微气泡的气浮作用将其去除.再经过·OH处理后,总细菌,总大肠菌群,大肠埃希氏菌均未检出.实验结果表明,·OH杀灭全部藻类的同时,能杀灭所有细菌.
原水浊度为10.8NTU,气浮处理后为0.66NTU,降低了93.89%; CODMn和TOC去除率分别为78.78%和86.36%;氨氮,总氮和总磷的去除率也分别达到了60.61%,54.75%和59.03%.因为在PAC的混凝作用下,气浮能去除水中大部分悬浮颗粒,使浊度降低;同时还能去除水中大分子有机物和颗粒态有机物,使CODMn和TOC降低;对总氮和总磷的去除是由于气浮对水中胶体和颗粒态氮和磷元素的去除;氨氮的降低则是由于气浮的吹脱作用. DO升高了7.69%是由于气浮过程中溶解了大量的空气.说明气浮在处理高藻水时对水质也有很好的改善作用,是一种可行的高藻水预处理工艺.
再经·OH处理后,水体浊度由0.66NTU降至0.54NTU,降低了12.59%;由于氧等离子体的注入,使得水体DO又升高了8.33%;CODMn和TOC也分别降低了10.0%和18.19%,显示了·OH的强氧化作用能降解水中的有机物,去除氯消毒副产物前驱物,使水质得到进一步改善;但是·OH对氨氮,总氮和总磷并无明显去除效果.总体而言,·OH处理对水质有进一步的改善作用.
综上所述,气浮-·OH强氧化组合工艺能快速、高效地去除水中藻类和细菌,净化水体水质,是一种有效的高藻水处理方法.
2.3 荧光染色法确定·OH杀藻效果
使用SYTOX- Green核酸染剂,对二形栅藻致死情况进行了统计,研究了不同·OH剂量对二形栅藻的杀灭效果.如图3所示,其中图3(a)中二形栅藻呈红色,叶绿素荧光较强,活性较好,为活细胞;图3(b)中二形栅藻呈绿色,是染色剂与DNA结合发出的荧光,为死细胞.
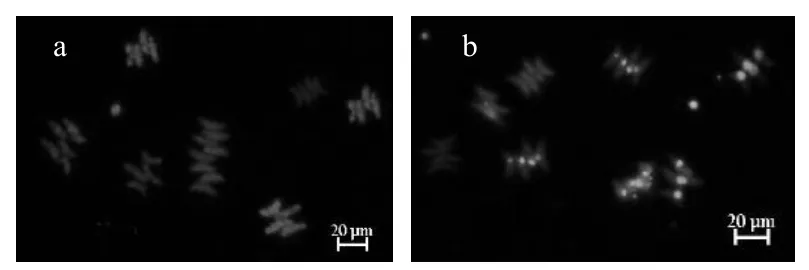
图3 二形栅藻细胞荧光染色照片Fig.3 Fluorescence microscope photos of Scenedesmusdimorphus
本实验使用的藻液是气浮预处理后的高藻水,优势藻为二形栅藻,藻密度为5.90× 104cells/mL.通过调节注入射流器中氧等离子体的流量来调节·OH处理单元TRO剂量,分别在5个不同的TRO剂量对藻液进行了·OH处理,·OH处理后取样点同样为图1中C点.
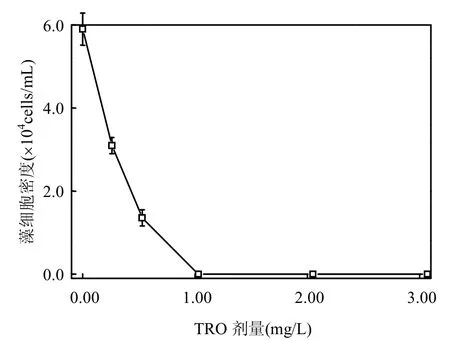
图4 ·OH处理后藻液中藻细胞密度的变化Fig.4 Effect of TRO dosage on algae inactivation
结果如图4所示,·OH处理后,藻密度随着TRO剂量的升高而降低,在TRO剂量为1.03mg/L时,藻细胞全部死亡,说明该水样的TRO阈值浓度为1.03mg/L.与Coral等[12]做的用4mg/L的臭氧处理纯水配制的藻密度为24× 104cells/mL的水华鱼腥藻,经过10min的接触时间后,达到了100%的致死效果相比[12],本实验在氧化剂剂量和反应时间上都有明显的减少,显示·OH强氧化系统产生的大量·OH能快速高效地致死藻细胞,具有反应时间短,氧化剂剂量低的特点.
2.4 叶绿素a法确定·OH杀藻效果
·OH处理前藻液的叶绿素a为29.84μg/L,经不同的·OH浓度处理后Chl-a的变化如图5所示.叶绿素a浓度随TRO剂量的升高而降低,在藻类杀灭阈值TRO为1.03mg/L时,叶绿素a降至18.72μg/L,其脱色率为37.27%;TRO增加至2.05mg/L时,叶绿素a降至14.39μg/L; 继续增加TRO至3.07mg/L时,叶绿素a降至11.40μg/L,脱色率达到65.15%.实验结果表明,·OH具有极强的氧化脱色特性,能够氧化降解藻细胞中的叶绿素,使细胞失去了光合作用能力,导致细胞死亡

图5 ·OH处理后叶绿素a的变化Fig.5 Effect of TRO dosage on Chl-a
2.5 光合活性法确定·OH杀藻效果

图6 ·OH处理后Fv/Fm的变化Fig.6 Effect of TRO dosage on Fv/Fm
·OH处理前藻液的光合活性Fv/Fm为0.63,经不同的·OH浓度处理后光合活性Fv/Fm的变化如图6所示.光合活性Fv/Fm随着TRO剂量的升高而降低.其中在TRO剂量为1.03mg/L时,藻细胞全部死亡,Fv/Fm降至0.3,降低了52.38%;在TRO增加为2.05mg/L时,Fv/Fm降至0.2,降低了68.25%;继续增加TRO至3.07mg/L时,Fv/Fm降至0.07,降低了88.89%,几乎失去光合活性.说明在·OH等氧化剂的作用下,藻细胞受到损伤,光合系统遭到破坏,使Fv/Fm降低.与叶绿素a和藻密度的变化较为一致.同样说明了强氧化性·OH对藻细胞的灭活作用.
对比分析图4,图5和图6可知,叶绿素a和Fv/Fm的变化率要滞后于藻的致死率.是因为·OH等氧化剂在作用于藻细胞时,首先与细胞膜反应,使细胞受到损伤,膜通透性发生改变,进而才能氧化叶绿素,破坏细胞光合系统,使叶绿素a和Fv/Fm降低.
3 结论
3.1 通过建立气浮-·OH强氧化组合工艺对高藻水进行处理,原水藻密度为65.69×104cells/mL.优势藻为二形栅藻 Scenedesmus dimorphus.气浮处理后,藻密度降至5.9×104cells/mL,降低了91.0%;总细菌降低了89.16%,浊度降低了93.89%,CODMn和TOC分别降低了78.78%和86.36%;氨氮,总氮,总磷等均有60%左右的去除效率.说明气浮能去除水中大量的藻并降低浊度. 3.2 气浮出水经TRO为1.03mg/L的·OH处理后,即达到了藻类全部致死;总细菌,总大肠菌群和大肠埃希氏菌均未检出;浊度,CODMn和TOC等水质指标有明显改善的效果.说明·OH能快速致死藻类,杀灭细菌,同时改善水质方面.
3.3 通过荧光染色法,叶绿素a法和光合活性法对·OH杀藻剂量和效果进行了研究.实验用TRO为1.03mg/L的·OH溶液处理藻密度为5.9×104cells/ mL,以二形栅藻为优势藻的高藻水时,处理6s后,即达到了藻类全部致死的效果,叶绿素a和光合活性Fv/Fm分别降低37.26%和52.38%.证明·OH具有极强的氧化脱色特性,能够氧化降解藻细胞中叶绿素,使细胞失去了光合作用的能力,导致细胞死亡.
因此,气浮-·OH强氧化组合工艺可高效快速地处理高藻水,为保障水源水的供水安全探索了一种新的思路.
Chen J J, Yeh H H, Tseng I C. Effect of ozone and permanganate on algae coagulation removal--pilot and bench scale tests [J]. Chemosphere, 2009,74(6):840-846.
Ma J, Liu W. Effectiveness and mechanism of potassium ferrate (VI) preoxidation for algae removal by coagulation [J]. Water Research, 2002,36(4):871-878.
Shen Q, Zhu J, Cheng L, et al. Enhanced algae removal by drinking water treatment of chlorination coupled with coagulation [J]. Desalination, 2011,271(1-3):236-240.
Chow C W K, Drikas M, House J, et al. The impact of conventional water treatment processes on cells of the cyanobacterium Microcystis aeruginosa [J]. Water Research,1999,33(15):3253-3262.
许 海,秦伯强,朱广伟.太湖不同湖区夏季蓝藻生长的营养盐限制研究 [J]. 中国环境科学, 2012,32(12):2230-2236.
李明玉,孙玉君,刘丽娟,等.PAFC-PDM复合混凝剂强化混凝去除水库源水中的藻类 [J]. 中国环境科学, 2014,34(7):1763-1768.
Zamyadi A, Fan Y, Daly R I, et al. Chlorination of Microcystis aeruginosa: toxin release and oxidation, cellular chlorine demand and disinfection by-products formation [J]. Water Res., 2013,47(3):1080- 1090.
Daly R I, Ho L, Brookes J D. Effect of chlorination on Microcystis aeruginosa cell integrity and subsequent microcystin release and degradation [J]. Environmental Science and Technology,2007,41(12):4447-4453.
Miao H, Tao W. The mechanisms of ozonation on cyanobacteria and its toxins removal [J]. Separation and Purification Technology,2009,66(1):187-193.
Coral L A, Zamyadi A, Barbeau B, et al. Oxidation of Microcystis aeruginosa and Anabaena flos-aquae by ozone: impacts on cell integrity and chlorination by-product formation [J]. Water Res.,2013,47(9):2983-2994.
Chen J J, Yeh H H. The mechanisms of potassium permanganate on algae removal [J]. Water Res., 2005,39(18):4420-4428.
Li L, Shao C, Lin TF, et al. Kinetics of cell inactivation, toxin release, and degradation during permanganation of Microcystis aeruginosa [J]. Environmental Science and Technology, 2014,48(5):2885-2892.
薛晓红,张芝涛,白敏冬,等.船舶压载水中海洋微生物的羟基自由基致死特性研究 [J]. 环境科学学报, 2013,33(3):749-753.
白敏冬,张拿慧,张芝涛,等.羟基自由基致死船舶压载水海洋有害生物研究 [J]. 环境科学, 2012,33(2):454-458.
Li P, Song Y, Yu S. Removal of Microcystis aeruginosa using hydrodynamic cavitation: Performance and mechanisms [J]. Water Research, 2014,62(0):241-248.
E.P.A., METHOD: 330.5 Chlorine, Total residual (Spectrophotometric, DPD)[S].
GB/75750.12-2006 生活饮用水标准检验方法 微生物指标 [S].
高瑞坤,汤 琳,付 强.水中粪大肠菌群快速检测方法-固定底物酶底物法与多管发酵法的比较 [J]. 中国环境监测,2008,(4):39-41.
国家环境保护总局.水和废水监测分析方法 [M]. 4版.北京:中国环境科学出版社, 2009:200-284.
Algae-laden water treatment using air flotation combined with advanced oxidation technology.
HONG Wei-chen1,BAI Min-dong1*, MAN Hua-lin1, HUANG Mengbin1, LI Fang1, ZHANG Zhi-tao2(1.Collaborative Innovation Center for Development and Utilization of Marine Biological Resources, Xiamen University, College of Environment and Ecology,Xiamen University, Xiamen 361005, China;2.Environmental Engineering Institute, Dalian Maritime University, Dalian 116026, China). China Environmental Science, 2015,35(12):3634~3639
In this study, an integrated air flotation and advanced oxidation process (AOP) facilitated by ·OH, resulting from strong ionization discharge, was applied to address this problem. For this purpose, natural reservoir water was used to culture Scenedesmus dimorphus to prepare synthetic water laden with algae cells concentration of 65.6×104cells/mL, turbidity of 10.8NTU and CODMnof 6.74mg/L, and the applied TRO dosage of 1.03mg/L. Almost complete removal of algae and bacteria(total bacteria, coli bacteria and E.coli) was achieved within 6s, while the CODMnof treated water decreased by 10% from 1.43mg/L to 1.25mg/L, its turbidity decreased by 12.59% from 0.66NTU to 0.54NTU. This suggest that this integrated treatment was effective for treatment of algae-laden wastewater, thus ensuring the safety of water supply.
algae-laden water;integrated treatment;hydroxyl radical;algae inactivation;water treatment
X524
A
1000-6923(2015)12-3634-06
洪伟辰(1989-),男,江西南康人,厦门大学环境与生态学院硕士研究生,主要从事高藻水中藻类控制与处理相关研究.
2015-04-30
国家科技支撑计划(2013BAC06B01,2013BAC06B02);国家重大科研仪器研制项目(61427804);国家高技术研究发展计划(863计划)(2012AA062609);国家杰出青年科学基金(61025001)
* 责任作者, 教授, mindong-bai@163.com

