疟疾感染过程中Tregs对DCs免疫功能的抑制作用与机理
陈 光,刘 蕾,王芳芳,罗 兰,苏菊香,蔡连顺,代 月
2.佳木斯大学附属第一医院,佳木斯 154000;Email:misschenguang75@163.com
疟疾是一种严重危害人类健康的全球感染性疾病。据2013年WHO报告,约34亿人受到疟疾威胁,每年约2.07亿例疟疾病例,造成大约62.7万例疟疾死亡[1]。疟疾已成为世界广泛关注的重要公共卫生问题之一,给全球尤其是发展中国家带来了严重的健康危害和经济负担[2-3]。然而关于疟疾发病的免疫学机制尚不清楚,探索疟疾发生的免疫、细胞和分子机制仍具有重要的实际意义。
前炎性/抗炎性免疫应答之间的平衡是清除疟原虫而不引起宿主严重病理损伤的关键。不同类型免疫应答的启动和强度又是决定感染结局的关键。免疫调节平衡作用关键的调节因素之一与调节性T细胞(Treg)/树突细胞(dendritic cells,DC)之间的相互作用密切相关。相关文献报道,Tregs细胞能够调控DCs的细胞表型和细胞因子表达谱,改变DCs的生物学活性。Tregs细胞识别和结合DCs后可抑制DCs的活化、成熟和刺激T细胞增殖的能力[4]。然而关于疟疾感染后Tregs与DCs间的相互关系无相关文献报道。为此本实验利用P.y17XL感染鼠疟模型,对比分析抗原刺激下DCs及其Tregs表型和功能的变化特点,特别是采用Tregs消除鼠观察DCs表型和功能的变化,确定Tregs对DCs的调控作用,这一研究无疑将为疟疾等感染性疾病的有效控制提供新的理论依据。
1 材料与方法
1.1 疟原虫及实验动物感染 6-8周龄、雌性BALB/c小鼠(中国医学科学院实验动物研究所提供,许可证编号:SCXK京2004-0001),经腹腔感染1×106P.y17XL(日本爱嫒大学分子寄生虫学教研室惠赠)寄生的红细胞。于感染后不同时间采小鼠尾静脉血,制备薄血膜,Giemsa染色,计数红细胞感染率。
1.2 Tregs消除小鼠模型的构建 BALB/c小鼠分别于感染前1d和感染后1d腹腔注射1mg CD25单 抗 (7D4,rat IgM;BioExpress .PC61,rat IgG1;eBioscience),腹腔注射PBS小鼠作为对照组。分别于感染0d、3d和5d常规制备脾细胞悬液,流式分析确认CD25的消除效率。
1.3 流式细胞仪检测DCs亚群数量 无菌取出小鼠脾脏,常规制备脾细胞悬液。用含10%胎牛血清(FCS)的RPMI1640调整脾细胞终浓度为1×106/mL。每份样品用抗 CD11c-FITC、CD11b-PE和CD45R/220-PerCP 单 抗进行三色分析,检 测DCs亚群数量变化,另设阴性对照管。在预先加入FcγIII/II封闭抗体的流式细胞仪专用染色管中加入脾细胞悬液0.1mL,再加入抗CD11c-FITC单抗、抗CD11b-PE单抗和抗CD45R/B220-PerCP单抗进行表面染色,离心去上清后,用0.5mL PBS重悬浮细胞,流式细胞仪进行检测。
1.4 流式细胞仪检测DCs表面分子表达 CD11c-FITC标记 DCs后,抗 CD80-PE、CD86-PE、MHCII-PE三种荧光抗体分别标记,FACS检测DCs表面共刺激分子CD80、CD86及MHC-II分子的表达水平;同时用FITC rat IgG2b作为同型对照。利用流式细胞仪(FACSCalibur,美国B&D公司),使用前向散射角(FSC)及侧向散射角(SSC)确定淋巴细胞群,应用FACSCELLQUEST软件,每个样品分析10 000个细胞,以阴性对照为参考,将对照管所示的非特异荧光的99%以上作为本底扣除,以二维点阵图显示,记录DCs表面分子表达水平的百分率。
1.5 流式细胞仪检测DCs分泌IL-10的水平 每份样本用CD11c-FITC和IL-10-PE进行双色分析,另设阴性对照管。流式细胞仪专用染色管预先加入FcγⅢ/Ⅱ封闭抗体,取新鲜制备的1×106/mL脾细胞悬液0.1mL,37。C条件下PMA和伊屋诺霉素刺激2h后加入Golgi Stop共同培养4h,3%FCS洗涤后加入FITC-anti-CD11c荧光抗体孵育30 min,3%FCS洗涤后加入固定透膜剂孵育,然后加入PE-anti-IL-10荧光抗体进行细胞内染色。同时用FITC rat IgG2b作为同型对照。
1.6 统计学处理 应用SPSS 11.5统计学分析软件,双侧t检验分析比较各组间的统计学差异。P小于或等于0.05为差异有统计学意义。
2 结 果
2.1P.y17XL感染BALB/c小鼠Tregs消除效果观察 与正常感染小鼠相比,7D4/PC61阻断组小鼠Tregs数量均出现有意义的较少,在感染后3d和5d分别减少79%、79%和84%、45%(图1)。另外,两种消除方法相比,感染后第5d差异有显著性(P<0.05)。
2.2P.y17XL感染BALB/c小鼠Tregs消除后原虫血症水平及生存率 于感染后第3d,P.y17XL感染BALB/c小鼠外周血中出现疟原虫感染的红细胞。感染后第4d,红细胞感染率约为5%~10%。随后,BALB/c小鼠原虫血症水平迅速升高,于感染后第6d红细胞感染率高达50%,小鼠于感染后第6d及次日全部死亡;而Tregs消除小鼠原虫血症水平上升缓慢,感染后第4d红细胞感染率仅为1%以下。感染后第7d/8d红细胞感染率达峰值,小鼠全部死亡(图2A,2B)。
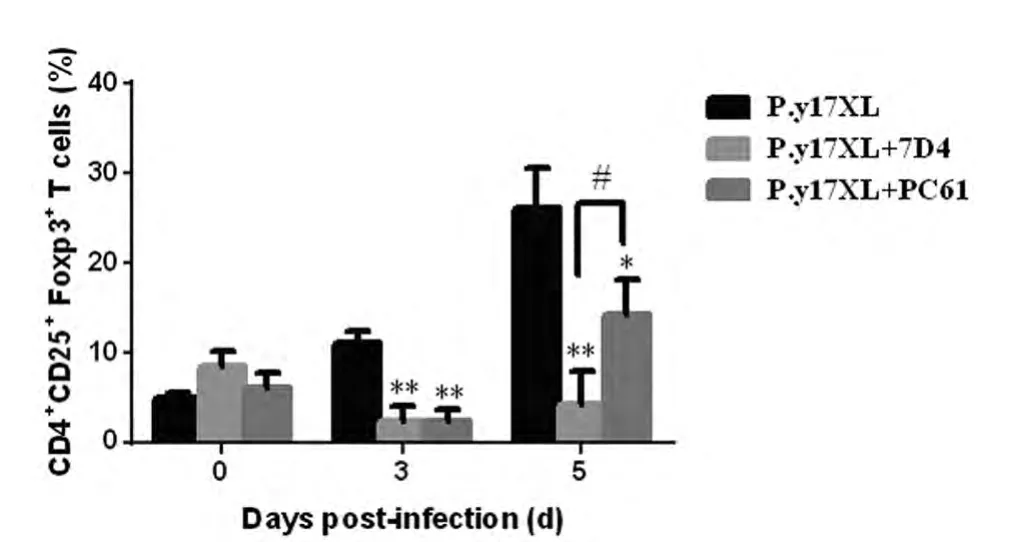
图1 P.y17XL感染BALB/c小鼠Tregs消除效果。结果以3只小鼠Tregsx±s表示。Fig.1 Effect of Tregs depletion in BALB/c mice by Flow cytometric.

图2 Tregs消除小鼠不同时间原虫血症水平及生存率Fig.2 Parasitemia and survival rate of Tregs blocked mice in different time after infection.
2.3P.y17XL感染BALB/c小鼠 Tregs消除后DCs亚群的数量 与正常感染小鼠相比,7D4/PC61阻断组小鼠在感染后3dDC1/DC2细胞数量均增加(P<0.05),然而 DC1/DC2的数量于感染后5d均减少(P<0.05)(图3A,3B)。
2.4P.y17XL感染BALB/c小鼠 Tregs消除后DCs表面分子的表达水平 与正常感染小鼠相比,7D4/PC61阻断组小鼠在感染后3dMHC-II分子、CD80和CD86的表达水平均有意义的增高,感染后5dCD86仍持续增高,而MHC-II分子和CD80的表达水平则减少(P<0.05)(图4A,4B,4C)。
2.5P.y17XL感染BALB/c小鼠Tregs消除后分泌IL-10的DCs数量 与正常感染小鼠相比,7D4/PC61阻断组小鼠在感染后3d和5d分泌IL-10的DCs数量增加有统计学意义(P<0.05);另外,两种Tregs阻断方法相比,PC61阻断后分泌IL-10的DCs数量高于7D4阻断组(P<0.01)(图5)。
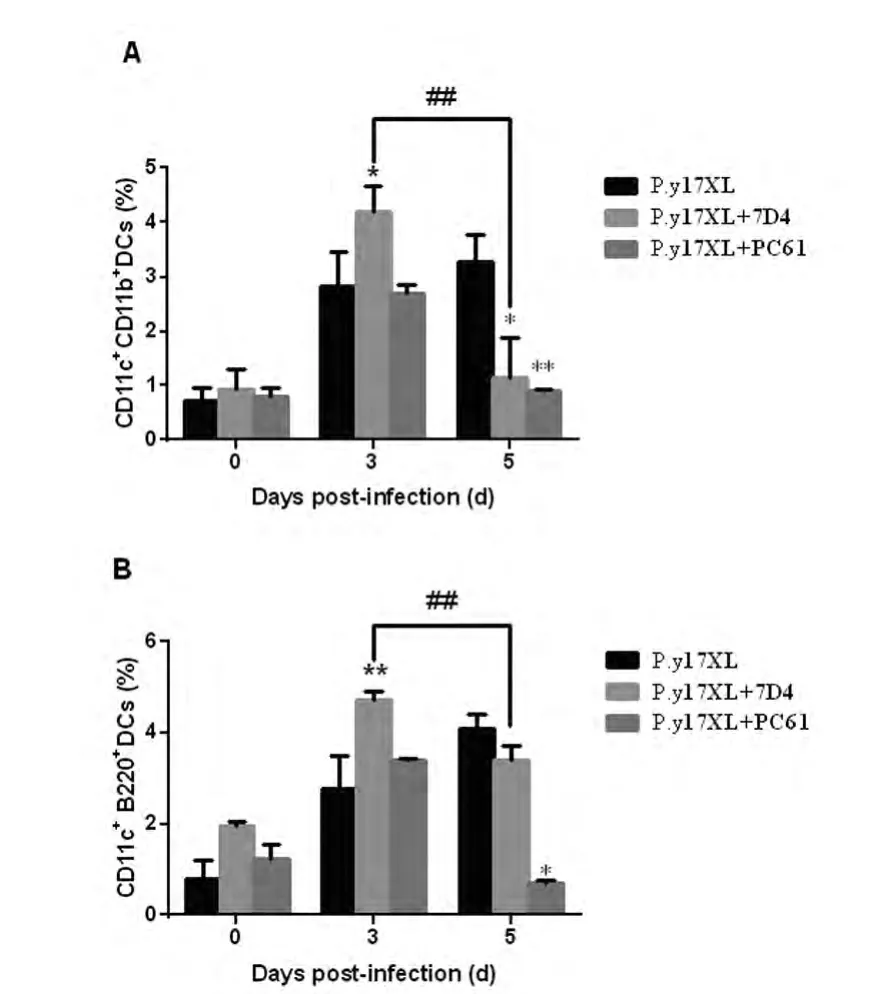
图3 Tregs消除小鼠感染后不同时间脾脏DC1/DC2的数量Fig.3 Percentage of DC1and DC2in supernatants from Tregs blocked mice in different time after infection.
3 讨 论
相关文献报道,Tregs细胞在原虫感染时具有两方面的作用:一方面是通过控制过度的免疫反应保护宿主,避免机体受到严重的免疫病理损害;另一方面却会增加寄生虫的存活机率,阻碍机体有效清除病原体。Tregs可通过表面膜分子与其它细胞直接接触或分泌抑制性细胞因子IL-10、TGF-β和IL-35等方式,抑制体内多种免疫细胞的活化和增殖[5-7],削弱炎症效应,维持免疫系统的稳定。
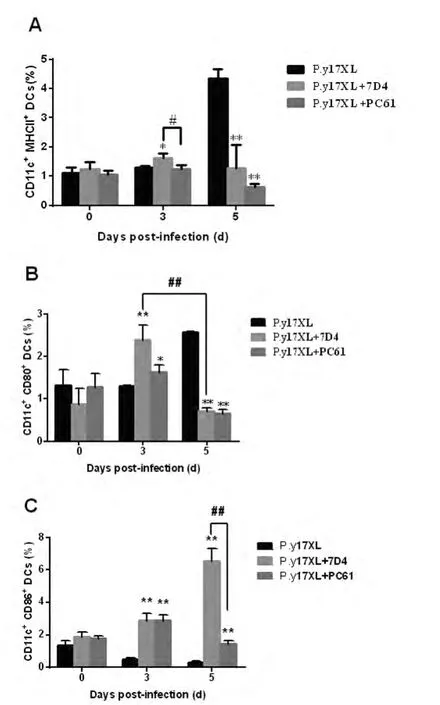
图4 Tregs消除小鼠感染后不同时间脾脏DC MHC-II、CD80和CD86分子表达水平Fig.4 Levels of MHC-II,CD80and CD86expression in DC in supernatants from Tregs blocked mice in different time after infection.
DCs在诱导固有和适应性免疫应答方面发挥着举足轻重的作用,同时作为活化初始T细胞的唯一抗原提呈细胞(APC),是决定Th细胞应答形式、强度和效应的关键[8]。疟原虫感染的红细胞(pRBC)一方面可诱导DCs刺激初始T细胞分化为分泌IFN-γ的 CD4+Th1细胞、分泌IL-4的 CD4+Th2细胞或分泌IL-10的调节性T细胞;另一方面pRBC的数量达到最高时反而抑制DCs的成熟,导致其功能受损[9],影响疟疾发展方向。相关文献报道,DCs能诱导调节性和效应性细胞产生相关细胞因子,Tregs的抑制作用又能阻断DCs的成熟[10]。

图5 Tregs消除小鼠感染后不同时间脾脏分泌IL-10的DCs数量Fig.5 Percentage of DC-secreting-IL-10in supernatants from Tregs blocked mice in different time after infection.
为了确定P.y17XL感染BALB/c小鼠DCs功能受损是否与Tregs数量增加有一定关系,本实验构建了Tregs体内消除的P.y17XL感染BALB/c小鼠模型,结果显示:与正常感染组小鼠相比,Tregs消除组小鼠于感染后第3dDCs亚群,MHC-II、CD80和CD86的表达均增加,第5dDCs亚群数量、MHC-II和CD80表面分子的表达均明显减少;然而分泌IL-10的DCs数量于感染后第5d明显增高,是同天感染鼠的1/3.5倍。由此说明,Tregs部分参与了疟原虫感染早期DCs的成熟和活化,通过降低其表面分子的表达和IL-10的分泌抑制了DCs的免疫功能而使DCs功能受损。Tregs消除组小鼠感染后第5dDCs的成熟明显被抑制,可能与pRBC数量急剧增加后抑制DCs成熟密切相关。
另外本实验发现,两种anti-CD25mAb体内阻断Tregs效果有着明显的差异。7D4能长期有效的阻断CD25的表达,而PC61仅能短期内维持CD25的低表达。相关研究发现,7D4能迅速的降低CD25hi细胞的数量,而PC61/PC61+7D4则效果不理想[11]。与本实验结果相一致,如果使用PC61单克隆抗体构建Tregs消除鼠疟模型,需要对模型鼠短期内多次注射,以保障实验期间CD25的低表达。综上所述,P.y17XL感染早期,BALB/c小鼠Tregs数量的升高与DCs功能受损具有相关性。Tregs能抑制DCs的免疫功能,这一现象可能与Tregs调控DCs的亚群、表型和细胞因子分泌模式等方面有关,但其确切的机制尚有待于进一步阐明。
[1]WHO Library Cataloguing-in-Publication Data World malaria report:2013.
[2]Murray CJ,Rosenfeld LC,Lim SS,et al.Global malaria mortality between 1980and 2010:a systematic analysis[J].Lancet,2012,379(9814):413-431.DOI:10.1016/S0140-6736(12)60034-8.
[3]Vogel G.The forgotten malaria[J].Science,2013,342(6159):684-687.DOI:10.1126/science.342.6159.684.
[4]Larmonier N,Marron M,Zeng Y,et al.Tumor-derived CD4+CD25+regulatory T cell suppression of dendritic cell function involves TGF-beta and IL-10[J].Cancer Immunol Immunother,2007,56(1):48-59.DOI:10.1007/s00262-006-0160-8
[5]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic selftolerance maintained by activated T cells expressing IL-2receptor α-chains(CD25)Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases.J Immunol.1995,155(3):1151-1164.
[6]Fontenot JD,Gavin MA,Runensky AY.Foxp3programs the development and function of CD4+CD25+regulatory T cell.Nat Immunol.2003,4(4):330-336..DOI:10.1038/ni904
[7]Zhang SG,Wang Jh,Stowh W,et al.TGF-beta requires CT-LA-4early after T cell activation to induce FoxP3and generate adaptive CD4+CD25+regulatory cells.J Immunol.2006,176(6):3321-3329.DOI:10.4049/jimmunol.176.6.3321
[8]Stevenson MM,Urban BC.Antigen presentation and dendritic cell biology in malaria.Parasite Immunol.2006,28(1-2):5-14.DOI:10.1111/j.1365-3024.2006.00772.x
[9]Orengo JM,Wong KA,Ocaña-Morgner C,et al.Plasmodium yoeliisoluble factor inhibits the phenotypic maturation of dendritic cells.Malar J.2008,15;7:254.DOI:10.1186/1475-2875-7-254.
[10]Wang AY,Crome SQ,Jenkins KM,et al.Adenoviral-transduced dendritic cells are susceptible to suppression by T regulatory cells and promote interleukin 17production.Cancer Immunol Immunother.2011;60(3):381-388.DOI:10.1007/s00262-010-0948-4.
[11]Couper KN,Blount DG,de Souza JB,et al.Incomplete depletion and rapid regeneration of Foxp3+regulatory T cells following anti-CD25treatment in malaria-infected mice.J Immunol,2007,1;178(7):4136-4146.DOI:10.4049/jimmunol.178.7.4136
——“零疟疾从我开始”

