mTOR和Survivin在人脑神经胶质瘤中的表达及临床意义
刘桠菲 刘献志 翟广 杨斌 毛冲冲
(1.郑州大学第一附属医院 神经外科 河南 郑州 450052;2.郑州大学第三附属医院 神经外科 河南 郑州 450052)
人脑神经胶质瘤(human gliomas)是中枢神经系统中最为常见的一种原发性恶性肿瘤,通常呈浸润性生长,手术难以完全切除,预后较差。世界卫生组织根据病理中人脑神经胶质瘤的恶性程度递增,将其划分为Ⅰ~Ⅳ级[1],临床诊治中常常将Ⅰ~Ⅱ级视为低分级神经胶质瘤,Ⅲ~Ⅳ级视为高分级神经胶质瘤。一般认为神经胶质瘤的发病机制和多个调控基因异常过度表达或者受到抑制有关。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种非典型丝氨酸/苏氨酸蛋白激酶,同时它也是一类重要的信号通路转导分子,在基因表达及细胞增殖中发挥中间桥梁作用。Survivin 又称存活蛋白,是凋亡抑制蛋白家族之一,通常只表达于恶性肿瘤或者某些胚胎组织,具有较好的特异性,表达情况多和肿瘤细胞的增殖及浸润转移密切相关。本研究通过免疫组化检测71 例胶质瘤中mTOR 及Survivin 的表达,并进行差异性和相关性统计分析,从而探讨其在人脑胶质瘤中的表达及其相互关系,为临床诊断与治疗提供帮助。
1 材料与方法
1.1 实验材料 收集2010年11月至2013年10月期间郑州大学第一附属医院神经外科行手术切除且保存完好的人脑神经胶质瘤石蜡包埋标本71 例,收集10 例该科室同期因重度颅脑外伤性内减压术的患者的脑组织作为正常脑组织(切片经病理科医师审定)。按照WHO 人脑神经胶质瘤分级,其中Ⅰ级16 例,Ⅱ级19 例,Ⅲ级17 例,Ⅳ级19 例。把Ⅰ、Ⅱ级人脑神经胶质瘤标本合并为低分级胶质瘤组,把Ⅲ、Ⅳ级人脑神经胶质瘤标本合并为高分级胶质瘤组。选取标准:所有患者术前均完善了相关检查,未进行过化疗、生物免疫治疗和放疗等,且患者为第1 次手术治疗,无糖尿病、痛风等代谢性疾病或冠心病、慢性阻塞性肺疾病等心肺疾病以及其他严重并发症。所有标本在手术切除后去除出血、坏死、烧灼的组织,用生理盐水反复冲洗后去除血污,1 h 内用10%福尔马林溶液浸泡固定,5 d内进行石蜡包埋,留以备用。
1.2 实验试剂与仪器
1.2.1 实验试剂 即用型免疫组化EliVisionTMplus试剂盒,兔抗人mTOR 单克隆抗体购于美国EPITOMICS 公司,兔抗人Survivin 蛋白多克隆抗体购于福州迈新生物技术有限公司,DAB 显色增强试剂及S-P9001试剂盒均购于北京市中杉金桥有限公司。
1.2.2 实验仪器 成像系统:LE-5 显微数码照像系统(德国Leica 公司)、图片分析系统:PLS-MZ0021 全智能病理图片分析系统(北京普利生仪器公司)。
1.3 实验方法 用半定量免疫组化(Envision 法)检测mTOR 和Survivin 的表达强度,操作严格按照EliVisionTMplus 试剂盒说明进行。兔抗人mTOR 单克隆抗体1∶100,兔抗人Survivin 蛋白多克隆抗体1∶100,PBS缓冲试剂代替一抗作为阴性对照,采用已知表达的胶质瘤标本作为阳性对照。
1.4 免疫组织化学结果判定方法 mTOR 和Survivin进行的免疫组化均采用了PBS 代替一抗作对照。采用PLS-MZ0021 全智能病理图片分析系统在统一光强,统一放大倍数(10 ×40)下测量表达情况,以染色最淡的视野为起点。任选5 个视野,将其染色强度(淡黄色<棕黄色<棕褐色)以及阳性细胞的百分比作为mTOR 及Survivin 阳性表达的量化指标。实验采取配对设计的方法,将mTOR 和Survivin 按照编号进行配对,并排除其他可能影响因素,从而便于相关性分析。
1.5 统计学方法 实验数据采用SPSS 16.0 分析软件进行统计学处理,阳性表达情况的比较采用统计方法采用χ2检验和Spearman 秩相关法统计方法行相关性分析,P <0.05 为差异具有统计学意义。
2 结果
2.1 mTOR 在人脑神经胶质瘤中的表达 在正常脑组织标本中,mTOR 未见到有阳性表达。在低级别胶质瘤组中,mTOR 阳性表达后被染色的细胞所占的百分比相对较低,阳性表达率为37.14%,而在高级别胶质瘤组中染色较深,其所占比率亦较高,阳性表达率为69.44%。方差分析显示,差异有统计学意义(F =7.444,P=0.009 <0.05)。对病理级别与表达水平再行Spearman 秩相关法分析,秩相关系数有统计学意义(r=0.470,P =0.000 <0.05),说明随着神经胶质瘤病理级别和恶性程度的增加,mTOR 的表达增强。
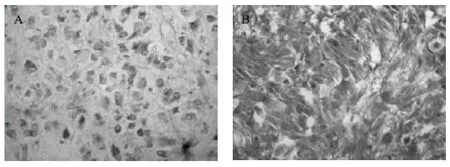
图1 mTOR 在不同级别胶质瘤组织中的表达(×400)
2.2 Survivin 在人脑神经胶质瘤中的表达 在正常脑组织标本中,Survivin 未见到有阳性表达。在低级别胶质瘤组中,Survivin 阳性表达后被染色的细胞所占的百分比相对较低,阳性表达率为40.00%,而在高级别胶质瘤组中染色较深,其所占比率亦较高,阳性表达率为66.67%。行方差分析结果显示,差异有统计学意义(F=5.073,P=0.033 <0.05)。对病理级别与表达水平再行Spearman 秩相关法分析,秩相关系数有统计学意义(r =0.399,P =0.001 <0.05),说明随着神经胶质瘤病理级别及恶性程度的提高,Survivin 表达水平也增加。
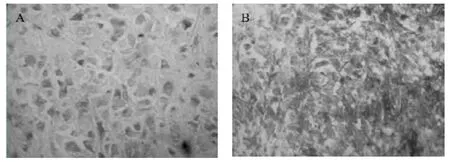
图2 Survivin 在不同级别胶质瘤组织中的表达(×400)
2.3 mTOR 与Survivin 在神经胶质瘤中表达的相关性 在71 例病例标本中,mTOR 和Survivin 在人脑神经胶质瘤中阳性表达率分别为53.52%和56.34%,其中同为阴性表达的有20 例,同为阳性表达的有25 例。mTOR 与survivin 在神经胶质瘤中的表达呈现相关性(χ2=4.947,P=0.026 <0.05),采用Spearman 秩相关检验方法可以认为mTOR 与Survivin 的表达存在正相关(r=0.264,P=0.026 <0.05)。
3 讨论
mTOR 属于磷脂酰肌醇-3-激酶复合体家族成员之一,它是TOR 信号通路分子种群的一种[1]。经过近些年学者的研究,mTOR 信号通路异常激活与多种肿瘤发生密切相关,它能够加速细胞周期、减少细胞凋亡、并促进肿瘤细胞的迁移,在脑胶质瘤、乳腺癌、卵巢癌中早已有报道[2]。本实验结果也表明随着神经胶质瘤恶性程度的增加,mTOR 的表达呈现增强的趋势。对于mTOR 信号通路在人脑神经胶质瘤的发生发展过程中可能的作用机理主要有以下3 个方面:首先,mTOR 信号通路的活性可受到多种细胞因子的调节,此途径主要通过PI3K/Akt/mTOR 信号分子传导实现对细胞生长及增殖的调控作用[3]。PI3K/Akt/mTOR信号通路的过度激活,进而导致细胞生长信号大量表达,细胞异常增殖,最终导致肿瘤的产生。其次,mTOR 信号通路具有抑制细胞凋亡、促进细胞生长的作用,其过度激活可导致细胞凋亡过度抑制,细胞增殖能力过度加强,进而促使肿瘤的发生[14-16]。最后,当细胞增殖速度过快时,可增加细胞适应低氧环境的能力,并通过大量生成的血管内皮细胞生长因子促进微血管的形成,从而促进肿瘤细胞能量供应及生长。通过对mTOR 信号通路的深入研究,探索其在人脑神经胶质瘤中的表达水平,可能会发现相关异常蛋白,分析这些蛋白在颅脑神经胶质瘤发病中所起的作用,可能会为将来对此疾病的生物靶向治疗提供依据。
Survivin 基因最早是由耶鲁大学Ambrosini 等人通过克隆的方法从人类基因库中分离出来,其基因定位于染色体17q25,Survivin 蛋白是凋亡抑制蛋白家族之一[7],也是迄今为止发现的最强的具有抑制凋亡、促进增殖的抑制因子。本实验结果也表明Survivin 的阳性表达随着神经胶质瘤恶性程度的增加而增强。根据实验结果推断,Survivin 基因及其表达产物可参与促进细胞的增殖、抑制细胞凋亡,其过度表达可出现异常增殖,从而导致肿瘤的产生。Survivin 具有促进血管内皮细胞增殖的能力,它参与了神经胶质瘤血管形成[8],这使得肿瘤的血供得以保证,为神经胶质瘤的快速生长提供充足的营养供应。通过实验我们发现,Survivin在正常组织中的表达微乎其微,因而具有高度的肿瘤特异性,针对它的靶向治疗具有良好的特异性[9]。Survivin 是一个目前较为理想可行的靶点,对人脑神经胶质瘤的研究和诊治具有很大的价值。
对于mTOR 和Survivin 的表达相关性研究,推测其机制可能为:①人脑神经胶质瘤中大多存在PI3K 表达过度的情况,而mTOR 和Survivin 的表达均受到PI3K 调节,当PI3K 表达上调,会间接通过AKT 途径而激活Survivin 和mTOR 通路,促进其表达[6];②10 号染色体上的磷酸酶基因(phosphatase and tensin homology deleted on chromosome 10,PTEN)作为PI3K/Akt/mTOR 信号通路的抑制因子,它的失活也可导致神经胶质瘤的发生。PTEN 的失活可导致对PI3K 的抑制降低而表达过度,进而激活Survivin 和mTOR 通路,促进其表达;③mTOR 可能会增强与中间蛋白结合而间接增强mRNA 的稳定性,促进其稳定表达,降低对抑制因素的敏感性,从而导致Survivin 表达上调。
综上所述,mTOR 及Survivin 都是反映人脑胶质瘤细胞增殖和侵袭活性的标志性物质,因而针对Survivin 的过度表达进行干预的同时,可以考虑运用mTOR 信号通路抑制剂联合治疗人脑神经胶质瘤,可能会产生一定的治疗效果,而且可能为人脑神经胶质瘤的联合治疗、检测以及评估等提供新的思路。
[1]Shaw R J.LKB1 and AMP-activated protein kinase control of mTOR signalling and growth[J].Acta physiol(Oxf),2009,196(1):65-80.
[2]Choe G,Horvath S,Cloughesy T F,et al.Analysis of the phosphatidylinositol 3-’kinase signaling pathyway in glioblastoma patients in Vivo[J].Cancer Res,2003,63(1):2742-2746.
[3]Su T R,Tsai F J,Lin J J,et al.Induction of apoptosis by 11-dehydrosinulariolide via mitochondrial dysregulation and ER stress pathways in human melanoma cells[J].Mar Drugs,2012,10(8):1883-1898.
[4]Guertin D A,Sabatini D M.Defining the role of mTOR in cancer[J].Cancer Cell,2007,12(1):9-22.
[5]Chen X,Liu S,Liu B,et al.The effects of age at cochlear implantation and hearing aid trail on auditory performance of Chinese infants[J].Acta Otolaryngol,2010,130(1):263-270.
[6]Presneau N,Shalaby A,Idowu B,et al.Potential therapeutic targets for chordoma:PI3K/Akt/TSC1/TSC2/mTOR pathway[J].British J Cancer,2009,100(9):1406-1414.
[7]Zhao P,Meng Q,Liu L Z,et al.Regulation of survivin by PI3K/Akt/p70S6K1 pathway[J].Biochem Biohpys Res Commun,2010,395(1):219-224.
[8]Zhao M Y,Auerbach A D,Costa A M,et al.Phospho-p70S6K/p85S6K and cdc2/cdk1 are novel targets for diffuse large B-cell lymphoma combination therapy[J].Clin Cancer Res,2009,15(15):1708-1720.
[9]Carnero A.The PKB/AKT pathway in cancer[J].Curr Pharm Des,2010,16(1):34-44.

