四肢骨巨细胞瘤的不同影像学表现对比分析
姬少绯 杨黎 牛军杰 岳瑞杰 张毅 程敬亮
(1.郑州大学第一附属医院磁共振科 河南郑州 450052;2.郑州大学第一附属医院生物细胞治疗中心 河南郑州 450052;3.郑州市骨科医院 放射科 河南 郑州 450052)
骨巨细胞瘤起源于骨髓结缔组织的间充质细胞,是一种具有局部侵袭性及复发倾向的原发性骨肿瘤[1],发病率在我国占骨肿瘤的10% ~15%,明显高于欧美国家(5% ~8%)[2]。多发于20 ~40 岁[3],无明显性别差异。发病部位多在四肢长骨的骺部[4-5]。随着MRI 及CT 的临床广泛应用,大大提高了骨巨细胞瘤的临床诊断准确性[6],尤其在肿瘤内部液-液平面征象、细微结构显示、肿瘤侵犯范围以及与邻组织结构的关系等方面显示了独特的优势,为临床诊断提供全面的影像学信息。本文通过回顾性分析经手术病理证实为四肢骨巨细胞瘤的23 例患者临床资料,对其X线、CT 及MRI 检查结果进行对比分析,为骨巨细胞瘤的诊断、鉴别诊断及治疗提供参考。
1 资料与方法
1.1 一般资料 选择郑州市骨科医院2011年7月至2013年9月经手术病理证实为四肢骨巨细胞瘤的患者23 例,其中男12 例,女11 例。年龄9 ~63 岁,平均38 岁。病史0.5 ~2 a。临床表现以患肢疼痛、功能障碍为主,局部可触及包块,局部皮肤温度升高。
1.2 影像学检查 X 线摄片装置采用西门子Axiom Aristos VX Plus,拍摄部位包括病变及邻近关的正侧位片;CT 扫描装置为东芝Aqulion 16 层螺旋CT,扫描层厚及层间距均为5 mm;MRI 装置为飞利浦Achieva 1.5 超导型,扫描层厚为5 mm,层间距为10 mm,主要SE 序列T1WI(TR 600 ms,TE 15 ms),T2WI(TR 3 000 ms,TE 100 ms),STIR(TR 3 100 ~3 200 ms,TE45 ~60 ms),TI(140 ms),分别进行横断、冠状、矢状位扫描。
2 结果
患者术前行X 线检查21 例、CT 检查17 例、MRI检查18 例,均行X 线及CT 检查17 例,均行CT 及MRI 检查12 例。术后病理示良性18 例、恶性3 例。
2.1 发病部位 左侧股骨近端2 例,左侧股骨远端6例,右侧股骨远端4 例,左侧胫骨近端3 例,左侧胫骨远端1 例,右侧胫骨近端2 例,左侧肱骨近端2 例,右侧桡骨远端3 例。
2.2 X 线影像学表现 21 例行X 线检查患者中,病灶区均可见圆形或椭圆形低密度区(占100.0%),15例见骨皮质膨胀改变(占71.4%),13 例破坏区内有骨间隔(占61.9%),11 例见溶骨性骨质破坏(占52.4%),10 例见骨皮质中断(占47.6%),10 例(占47.6%)病灶内出现“皂泡状”改变。
2.3 CT 影像学表现 17 例行CT 检查患者中,病灶区均可见圆形或椭圆形低密度区(占100.0%),13 例见骨皮质膨胀改变(占76.5%),10 例偏心性生长(占58.8%),9 例见硬化边缘(占52.9%),12 例破坏区内有骨间隔(占70.6%),6 例累及关节面(占35.3%),7例见不同程度的软组织密度影(占41.2%),8 例(占47.1%)病灶内出现“皂泡状”改变。病灶内出现液-液平面征象9 例(占52.9%)。
2.4 MRI 影像学表现 18 例行MRI 检查患者中,T1WI 呈等长信号、T2WI 呈等长信号7 例(占38.9%),T1WI 呈等短信号、T2WI 呈等长信号8 例(占44.4%),提示病灶内亚急性出血,T1WI 呈等信号、T2WI 呈等长信号1 例(占5.6%),T1WI 呈长信号、T2WI 呈等长信号2 例(占11.1%),提示病灶内出现坏死囊变。STIR 呈稍高混杂信号6 例(占33.3%),提示病灶内含有少量液性成份,其余12 例呈高信号(占66.7%),提示病灶内液性成份含量较多。病灶内出现“皂泡状”改变17 例(占94.4%)。出现液-液平面征象16 例(占88.9%)。
2.5 CT 与MRI 液-液平面征象比较 12 例均行CT、MRI 检查的患者中,8 例CT 显示出现液-液平面征象,其中良性肿瘤6 例,恶性肿瘤2 例。但是,MRI检查表明12 例均出现液-液平面征象,其中良性肿瘤9 例,恶性肿瘤3 例。
根据液平占病灶比例的不同分为4 组,1 组:液平比<1/3;2 组:液平比处于1/3 ~2/3;3 组:液平比处于2/3 ~100%;4 组:100%,完全为液平,未见明显实性成份。8 例CT 与MRI 均检查出液-液平面的患者各组肿瘤良恶性的分布不同。
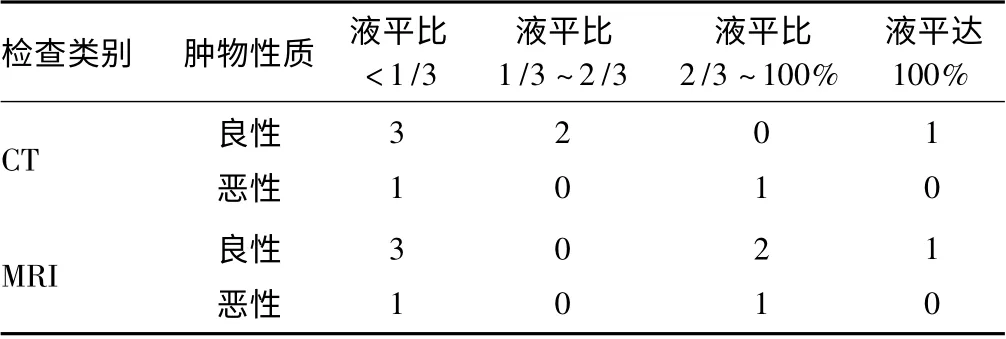
表1 8 例行CT、MRI 检查出液-液平面征象的患者肿瘤良恶性与液平比例分布表(n)
3 讨论
骨巨细胞瘤最早于1818年由Astley Cooper 提出,又称为破骨细胞瘤、髓样瘤、出血性骨髓炎。本病较常见,发病率在良性骨肿瘤中居第2 位。骨巨细胞瘤发病高峰年龄为20 ~40 岁,好发于长骨骨端,多见于股骨下端及胫骨上端。病变以单发为主,偶可多发,一般不超过骨巨细胞瘤的1%[7]。10% ~15%可以恶变,虽然骨巨细胞瘤组织学上为良性,但生物学特征具有局部侵袭性,属于一种特殊属性的肿瘤。
骨巨细胞瘤典型的X 线表现为长骨骨端偏心性生长的膨胀性溶骨破坏。本研究中15 例见骨皮质膨胀改变(占71.4%)。骨皮质变薄可残留菲薄骨壳,边缘清晰,硬化较少,不并发骨折也不出现骨膜增生。肿瘤内无钙化或骨化致密影。肿瘤一般不穿破关节软骨,但偶可发生,甚至越过关节侵犯邻近骨骼。瘤区的X 线表现有两种类型[8]:①分房型:破坏区内可有数量不等、较纤细的骨嵴,主要位于病灶的周边,X 线上可见似有分隔成大小不一的小房征;②溶骨型:破坏区内无骨嵴,表现为单一的骨质破坏[9]。本研究发现,13例破坏区内有骨间隔(占61.9%),11 例见溶骨性骨质破坏(占52.4%),以前者常见且具有特征性。X 线平片在骨髓内、骨皮质及软组织的侵犯情况的准确判断上不如CT 及MRI,因此,CT、MRI 逐渐应用于骨巨细胞瘤的诊断及术前评估[10-12]。
CT 检查能清楚显示骨巨细胞瘤病变部位的骨质破坏范围、程度及病灶内分隔的具体形态,更能发现病灶内软组织影及液-液平面等X 线平片所不能发现的征象。对于骨外软组织影的观察CT 明显优于X 线平片[1-2]。骨巨细胞瘤的分级可以根据CT 对骨壳完整性及软组织肿块的表现来判断。良性骨巨细胞瘤表现为膨胀性、溶骨性破坏,边缘骨壳完整或部分消失,病变与周围组织分界清晰;侵袭性骨巨细胞瘤则表现为虫蚀样、筛孔样骨破坏,肿瘤组织突破骨壳向周围软组织浸润,肿瘤边缘可出现骨膜反应或骨膜三角。
MRI 具有良好的组织分辨率,可行不同加权和多种方位扫描观察病变,显示肿瘤组织与周围组织的关系,更能显示肿瘤对关节软骨的破坏、关节腔以及骨髓腔的受累情况,利于早期发现转移及恶变。同时,MRI还能够显示瘤体内出血、坏死和周围组织结构特性。不足之处在于对病灶中钙化、骨化、骨嵴和骨膜反应的判断相对较差。与周围肌肉信号相比,骨巨细胞瘤在T1WI 上多呈不均匀低、等信号,T2WI 呈不均匀中等或高信号。在骨巨细胞瘤中另一个值得注意的征象是液-液平面,即T1WI 液面上层相对于下层呈低信号,T2WI 均呈高信号,但上层信号相对更高。程晓光等[13]报道称,随液-液平面所占病变比例增加,良性骨病变多见。本研究显示,12 例均行CT、MRI 检查的患者中,8 例CT 显示出现液-液平面征象,而MRI 检查表明12 例均出现液-液平面征象;同时,8 例CT 与MRI 检查均存在病灶液-液平面的患者中,MRI 显示液平比例与组织良恶性关系更准确。MRI 在液-液平面征象方面优于CT 检查。
骨巨细胞瘤须与软骨母细胞瘤、动脉瘤样骨囊肿、骨囊肿等鉴别[14]。软骨母细胞瘤好发于骨骺,肿瘤边缘有时可见骨膜反应及肿瘤内部散在斑片状钙化,可助于与骨巨细胞瘤鉴别。90%的动脉瘤样骨囊肿发生于20 岁以下的青少年,患者多有外伤史,发多于骨端的骨干部,一般不累及骨骺;虽可表现为偏心性膨胀性骨质破坏,但骨巨细胞瘤偏心性表现更为显著。骨囊肿好发于10 ~15 岁,发病部位多见于干骺端或骨干,向纵径发展为著,骨端膨胀性不如骨巨细胞瘤明显。
总之,X 线平片能够提供病变部位整体信息,大多数病例在质量良好的平片上能满足定位和部分定性诊断的要求。但是,X 线平片对骨髓内、骨皮质及软组织的侵犯情况不易做出准确判断。CT 及MRI 对肿瘤内部结构的细微显示、肿瘤侵犯范围及邻近组织结构关系有独特的优势,有助于肿瘤分期、治疗方案的确定和随访。同时,MRI 在病灶液-液平面征象的反映方面优于CT。因此,提高骨巨细胞瘤的诊断准确性需要根据患者具体病情,结合临床表现综合运用X 线平片、CT、MRI,为临床诊疗提供更全面依据。
[1]Conti A,Rodriguez G C,Chiechi A.Identification of potential biomarkers for giant cell tumor of bone using comparative proteomics analysis[J].Am J Pathol,2011,178(1):88-97.
[2]马庆军,党耕町.骨巨细胞瘤诊断与治疗研究现状[J].中华外科杂志,2005,43(12):819-821.
[3]张清,牛晓辉.骨巨细胞瘤的诊断与治疗[J].中国医刊,2011,46(1):15-19.
[4]Mogi A,Kosaka T,Yamaki E,et al.Surgical resection and reconstruction for a giant cell tumor of the anterior rib[J].Gen Thorac Cardiovasc Surg,2012,60(4):233-236.
[5]于宝海,韩奕,刘记存,等.膝关节周围骨巨细胞瘤与软骨母细胞瘤影像表现分析[J].2013,29(2):250-253.
[6]杜联军,丁晓毅,颜凌,等.骨巨细胞瘤常见和典型的CT 表现分析[J].实用放射学杂志,2007,23(8):1070-1073.
[7]Jamil O A,Lechpammer M,Prasad S,et al.Giant cell reparative granuloma of the sphenoid:Case report and review of the literature[J].Surg Neurol Int,2012,(3):140.
[8]邹月芬.骨巨细胞瘤的影像学诊断[J].医学影像学杂志,2009,19(3):319-322.
[9]Shen C C,Li H,Shi Z L,et al.Current treatment of sacral giant cell tumour of bone:a review[J].J Int Med Res,2012,40(2):415-425.
[10]Si M J,Wang C S,Ding X Y,et al.Differentiation of primary chordoma,giant cell tumor and schwannoma of the sacrum by CT and MRI[J].Eur J Radiol,2013,82(12):2309-2315.
[11]Qian Z H,Bai R J,Yan D,et al.Skeletal disease in primary hyperparathyroidism:X-ray,CT and MR imaging foundings[J].Zhonghua Yi Xue Za Zhi,2013,93(1):30-33.
[12]中爱强,朱萌,张继,等.骨巨细胞瘤的影像学诊断[J].医学影像学杂志,2012,22(6):1004-1006.
[13]程晓光,苏永彬,徐黎.CT/MR 成像中液-液平面对鉴别原发骨病变良恶性的意义[J].中国临床医学影像杂志,2012,23(10):718-721.
[14]Nahal A,Ajlan A,Alcindor T,et al.Dedifferentiated giant cell tumour of bone in the form of low-grade fibroblastic osteogenic sarcoma:case report of a unique presentation with follow-up[J].Curr Oncol,2010,17(4):71-76.

