2型糖尿病肾脏病变患者血清25羟维生素D水平与肾功能不全的相关性研究
向 茜,李万碧,张 弦,刘 华,王玉明,杨 才,白云霞,郭 燕,张永新,李勇军
(1.昆明医科大学第五附属医院/红河州滇南中心医院,云南 个旧661000;2.昆明医科大学第一附属医院,云南 昆明650032)
我国2型糖尿病(T2DM)患者糖尿病肾脏病变(DKD)患病率为30%~50%,且DKD一旦进入大量蛋白尿阶段,进展为终末期肾病(ESRD)的速度约为其他肾病的14倍[1]。因此,早期诊断、预防和延缓DKD的发生、发展,对提高患者存活率、改善生活质量具有重要意义。维生素D是人体必需的维生素,随着对其作用的深入研究,关于维生素D与2型糖尿病肾脏疾病(T2DKD)之间的关系逐渐成为国内外研究热点。目前以尿白蛋白排泄率为DKD诊断及分期标准的研究较多,但以估算肾小球滤过率(eGFR)为分期标准及关于维生素D与肾功能不全的研究较少。本研究通过分析T2DKD患者血清25羟维生素D[25(OH)D]水平及与肾功能不全的关系,探讨25(OH)D在防治T2DKD中的价值。现报道如下。
1 临床资料
1.1 一般资料 收集2012年10月—2014年12月在昆明医科大学第五附属医院内分泌科、肾内科住院的T2DKD患者133例,男70例,女63例;年龄19~85岁;诊断时糖尿病病程1个月~28年。糖尿病诊断参照1999年WHO标准。DKD诊断参照文献[1]临床诊断标准:大量蛋白尿;糖尿病视网膜病变伴任何一期慢性肾脏病。排除诊断明确的1型糖尿病者,伴有糖尿病急性并发症的T2DM者,有微量白蛋白尿但不伴有糖尿病视网膜病变的T2DM者,合并急性感染、自身免疫病、肿瘤者,近6个月内服用维生素D、钙制剂、抗癫痫药、糖皮质激素及含铝药物者。以血清25(OH)D 30 nmol/L为维生素D缺乏,25(OH)D 30~49.9 nmol/L为维生素D不足,25(OH)D 50 nmol/L为维生素 D充足,25(OH)D 50~75 nmol/L 为适宜[2]。
1.2 研究方法 按照慢性肾脏病(chronic kidney disease,CKD)诊断标准[3],根据 eGFR将133例DKD患者分为肾功能不全组[eGFR 60 mL/(min·1.73m2)]和肾功能正常组[eGFR 60 mL/(min·1.73m2)]。收集患者的临床资料,包括年龄、性别、身高、体质量、收缩压(SBP)、舒张压(DBP)。用liason化学发光法测定血清甲状旁腺素(PTH)、25(OH)D水平。用自动生化分析仪检测空腹血糖(FBG)、口服75 g无水葡萄糖或100 g馒头餐后2 h血糖(2hPG)、糖化血红蛋白(HbA1c)、血清白蛋白(ALB)、血尿素氮(BUN)、血肌酐(Cr)及尿白蛋白/肌酐(ACR)、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDLC)、血尿酸(UA)、血钙(Ca)、血磷(P)。血Ca以矫正钙为标准,用同期检查所得的血清ALB进行矫正,用改良的MDRD公式法计算 eGFR[1]。
1.3 统计学方法 应用IBM SPSS 19.0软件包进行统计学分析。计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析;偏态分布的计量资料以中位数M(P25,P75)表示,组间比较采用非参数检验。率的比较采用卡方检验;采用Pearson相关分析进行单因素相关分析,采用Logistic回归分析肾功能的影响因素。P<0.05为差异有统计学意义。
2 结 果
2.1T2DKD患者25(OH)D水平及25(OH)D缺乏、不足发生率 133例T2DKD患者25(OH)D水平为(13.07±6.62)nmol/L,25(OH)D缺乏、不足发生率分别为 45.86%(61/133)与 41.35%(55/133),25(OH)D 缺乏/不足发生率为8 7.21%(116/133)。肾功能不全组78例(58.65%),25(OH)D 水平为(11.30 ±5.81)nmol/L,25(OH)D 缺乏 46例(58.97%),25(OH)D 不足28 例(35.90%),25(OH)D 缺乏/不足74例(94.87%);肾功能正常组55例,25(OH)D水平为(15.58 ±6.94)nmol/L,25(OH)D 缺乏15 例(27.27%),25(OH)D不足27例(49.09%),25(OH)D 缺乏/不足42例(76.36%)。肾功能不全组25(OH)D水平明显低于肾功能正常组(P<0.05);2组25(OH)D不足发生率比较差异无统计学意义,但肾功能不全组25(OH)D缺乏/不足及缺乏发生率明显高于肾功能正常组(P均<0.05)。
2.2 肾功能正常组与肾功能不全组临床资料比较 2组间性别、DBP、2hPG、HDL、TC比较差异均无统计学意义(P均>0.05)。肾功能不全组患者年龄、SBP、BUN、Cr、UA、P、PTH、ACR均明显高于肾功能正常组(P均 <0.05),而 FBG、HbA1c、ALB、TG、LDL、Ca均明显低于肾功能正常组(P均 <0.05)。见表 1。
表1 肾功能正常组与肾功能不全组临床资料比较(±s)
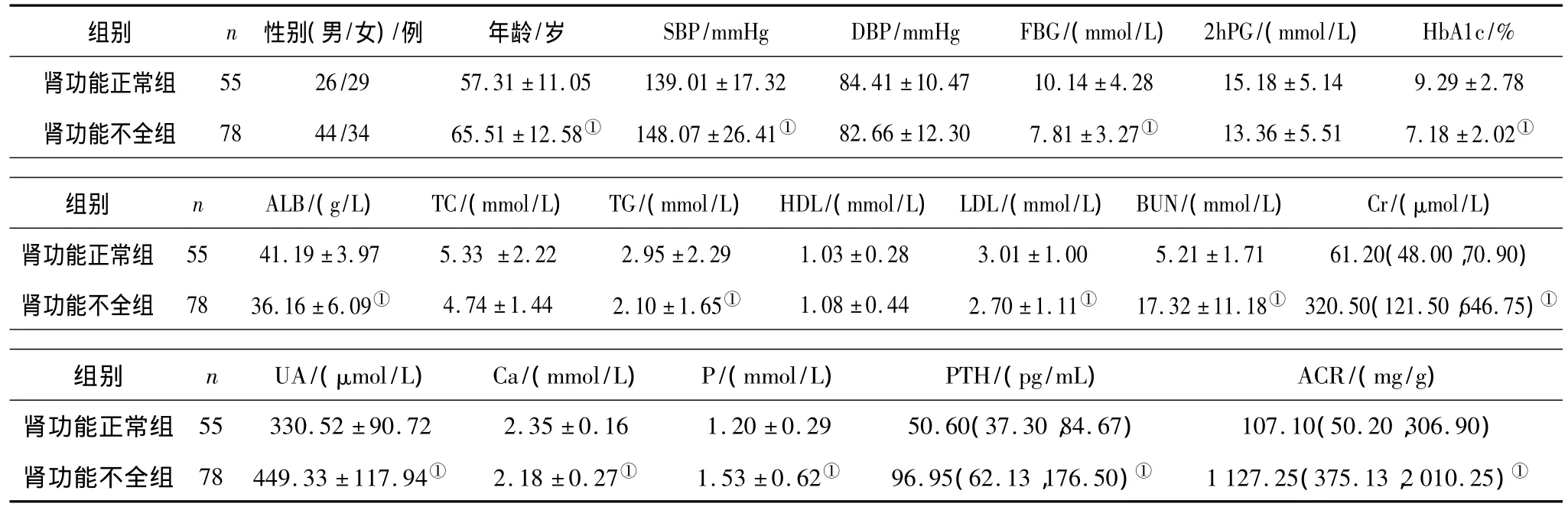
表1 肾功能正常组与肾功能不全组临床资料比较(±s)
注:①与肾功能正常组比较,P <0.05;1 mmHg=0.133 kPa。
HbA1c/%肾功能正常组 55 26/29 57.31 ±11.05 139.01 ±17.32 84.41 ±10.组别 n 性别(男/女)/例 年龄/岁 SBP/mmHg DBP/mmHg FBG/(mmol/L) 2hPG/(mmol/L)47 10.14 ±4.28 15.18 ±5.14 9.29 ±2.78肾功能不全组 78 44/34 65.51 ±12.58① 148.07 ±26.41① 82.66 ±12.30 7.81 ±3.27① 13.36 ±5.51 7.18 ±2.02①组别 n ALB/(g/L) TC/(mmol/L) TG/(mmol/L) HDL/(mmol/L)LDL/(mmol/L)BUN/(mmol/L) Cr/(μmol/L)肾功能正常组 55 41.19 ±3.97 5.33 ±2.22 2.95 ±2.29 1.03 ±0.28 3.01 ±1.00 5.21 ±1.71 61.20(48.00,70.90)肾功能不全组 78 36.16 ±6.09① 4.74 ±1.44 2.10 ±1.65① 1.08 ±0.44 2.70 ±1.11① 17.32 ±11.18① 320.50(121.50,646.75)①组别 n UA/(μmol/L) Ca/(mmol/L) P/(mmol/L) PTH/(pg/mL) ACR/(mg/g)肾功能正常组 55 330.52 ±90.72 2.35 ±0.16 1.20 ±0.29 50.60(37.30,84.67) 107.10(50.20,306.90)肾功能不全组 78 449.33 ±117.94① 2.18 ±0.27① 1.53 ±0.62① 96.95(62.13,176.50)① 1 127.25(375.13,2 010.25)①
2.3 肾功能不全的单因素相关分析 将以上临床资料与eGFR进行Pearson单因素相关分析,发现年龄、SBP、UA、P、PTH、ALB与 eGFR 呈负相关,25(OH)D 缺乏/不足、FBG、HbA1c、ACR、LDL、TG、Ca与 eGFR 呈正相关。见表2。
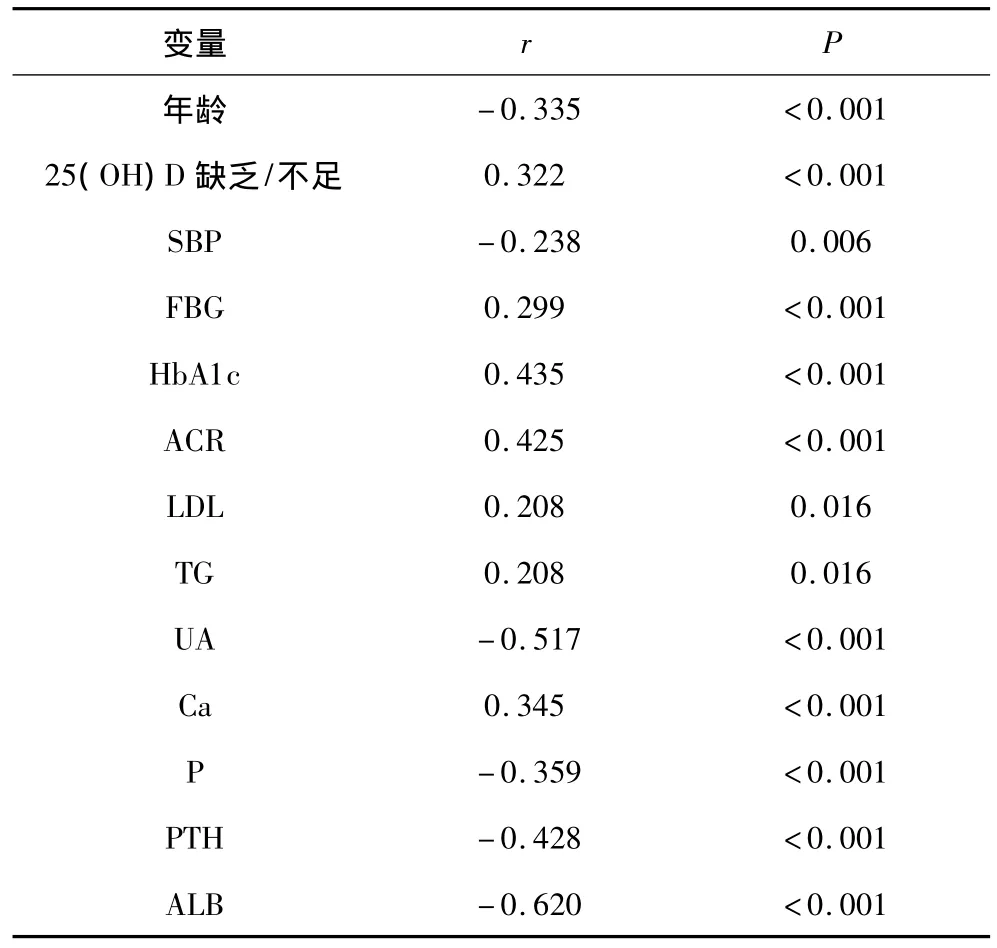
表2 肾功能不全的单因素相关分析
2.4 肾功能不全的多因素相关分析 以肾功能不全为因变量,将以上与eGFR相关的单因素代入Logistic回归方程,结果显示25(OH)D缺乏/不足及UA与肾功能不全呈正相关,年龄、HbA1c、TG与肾功能不全呈负相关。见表3。
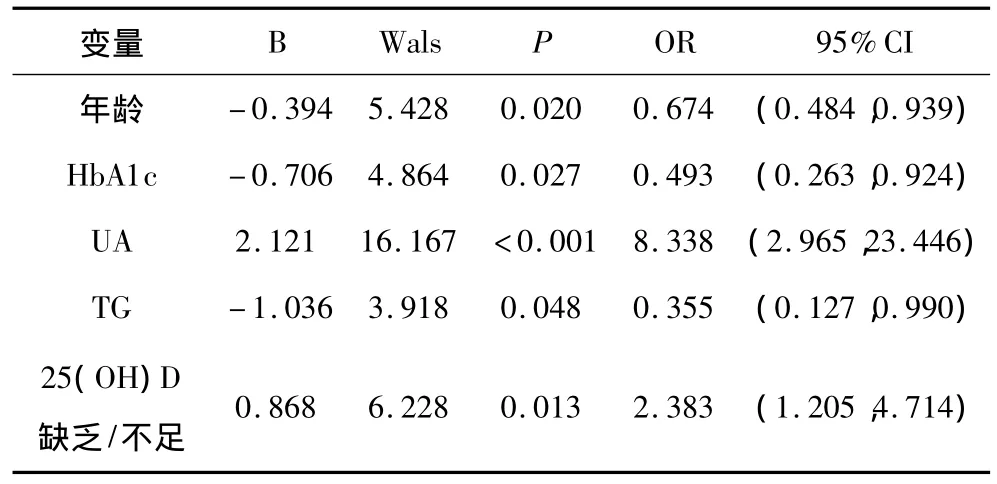
表3 肾功能不全的多因素相关分析
3 讨 论
糖尿病视网膜病变及DKD均为糖尿病常见微血管并发症。糖尿病视网膜病变对糖尿病性肾小球疾病阳性预测值灵敏度及特异度高,且常早于DKD发生,是T2DKD诊断和筛查的有用指标[1]。白蛋白尿既是DKD的临床表现,也是诊断DKD的主要依据。但仅根据尿白蛋白诊断DKD,可能会忽略eGFR的诊断价值。为避免遗漏白蛋白尿正常但eGFR下降的DKD患者,本课题采用2015年《中国成人DKD临床诊断的专家共识》[1]临床诊断标准,在T2DM患者中,除大量蛋白尿患者外,将糖尿病视网膜病变伴任何一期肾脏疾病患者纳入病例组进行研究。
T2DM患者维生素D缺乏较为常见[4-5],糖尿病患者发生维生素D缺乏的风险是非糖尿病患者的3倍以上[6]。本研究入组的133例T2DKD患者25(OH)D水平较低,25(OH)D缺乏/不足发生率高,虽组间25(OH)D不足发生率比较差异无统计学意义,但肾功能不全组较肾功能正常组25(OH)D水平更低、25(OH)D缺乏/不足发生率及缺乏发生率明显增高,提示本地区T2DKD患者中普遍存在维生素D缺乏/不足,当发生肾功能不全时,维生素D的缺乏更为突出。另外,肾功能不全组患者年龄、SBP、BUN、Cr、UA、P、PTH、ACR 均明显高于肾功能正常组,而 FBG、HbA1c、ALB、TG、Ca均明显低于肾功能正常组。考虑原因为:① T2DM患者限制进食量及高脂饮食,致脂溶性维生素D摄入不足,至DKD阶段时,其维生素D的贮备已不足。②T2DKD患者往往合并自主神经功能紊乱,引起胃肠道功能紊乱,致维生素D吸收障碍,维生素D贮备不足进一步加重。③eGFR随增龄进行性下降,当老年患者(年龄65岁以上)合并T2DM时,其eGFR的下降更明显。皮肤合成维生素D能力随年龄增高而下降[7],因肾功能不全组高龄患者较多,故维生素D缺乏更严重。④T2DKD患者发生肾功能不全时,高磷血症刺激骨细胞生成成纤维细胞生长因子-23(FGF-23),FGF-23可抑制肾脏1ɑ羟化酶基因的表达,减少肾脏活性维生素D生成[8]。⑤Megalin和cubilin蛋白分布于肾脏囊近曲小管细胞膜网格蛋白小凹内,胞吞作用重吸收肾小球滤过的包括25(OH)D3在内的多种蛋白,DKD时,这两种受体功能受损,导致活性维生素D重吸收减少,引起维生素D不足或缺乏[9]。⑥肾功能不全时肾脏排泄和代谢功能下降,水钠潴留,肾局部RAS系统活性高,致SBP增高;血UA、P等排泄障碍,继发高UA血症、高PTH血症、低钙血症。⑦肾功能不全时尿白蛋白出现并渐进性增多,引起低蛋白血症;因尿毒症毒素潴留,患者食欲不佳,摄入减少,致高TG高LDL血症改善,而低ALB血症加重;同时胰岛素在肾脏降解减少,胰岛素敏感性增加,导致肾功能不全组FBG及HbA1c均较肾功能正常组低,但因仍存在餐后胰岛素分泌缺陷,故2hPG 2组比较差异无统计学意义。
关于维生素D不足/缺乏与DKD是否相关,目前研究结论尚不统一。有研究认为维生素D缺乏/不足与DKD无相关性[10],多数研究认为维生素D缺乏与T2DKD患者尿蛋白排泄率负相关[11-14]。本研究Logistic多因素回归分析显示25(OH)D缺乏/不足及UA与肾功能不全呈正相关,年龄、HbA1c、TG与肾功能不全呈负相关,提示维生素D缺乏/不足、高UA血症的T2DKD患者易患肾功能不全,而较年轻、HbA1c及TG控制较好T2DKD患者不易发生肾功能不全。维生素D对T2DM患者的肾保护作用可能机制为:①通过核受体机制阻断cAMP刺激肾素合成作用,或通过细胞膜受体途径升高细胞中钙离子浓度来抑制肾素分泌,改善肾小球高灌注,减少蛋白尿的产生[15]。②通过抑制单核细胞趋化蛋白-1和转化生长因子-β,从而减少足细胞损害和延缓肾小球纤维化进程[16]。③通过增加维生素D受体表达发挥抗炎作用,抑制肾脏TGF-β、MCP-1、IL-1、IL-6、TNF-α等细胞因子和巨噬细胞浸润等减轻肾小管纤维化[17]。④通过促进胰岛β细胞生长,抑制胰岛β细胞凋亡,抑制甲状旁腺功能亢进等促进胰岛素第一时相分泌,改善胰岛素抵抗,通过对血糖的调控减少高血糖对肾功能的损害[18]。⑤通过维生素D受体作用于FGF-23启动子,增加成骨细胞/骨细胞 FGF-23mRNA转录,升高循环中的FGF-23水平,降低血磷,改善甲状旁腺功能亢进[19]。鉴于以上机制,对于25(OH)D缺乏或不足的T2DKD患者,补充活性维生素D可能有助于减轻肾损伤,延缓肾功能不全进展。
值得重视的是,心血管疾病(CVD)是CKD患者的第一死亡原因(50%),CKD患者心血管疾病病死率和总病死率与维生素D缺乏密切相关[20]。维生素D缺乏是血液透析患者心血管疾病、心血管死亡率和全因死亡率的危险因素[21],亦和腹膜透析患者心血管事件的风险增高相关[22]。可能机制为25(OH)D对肾素血管紧张素有负向调节作用,能直接作用于动脉血管壁,控制血管平滑肌细胞钙离子的流量,在心血管系统调节容量中起着重要的作用,缺乏可致以上调节功能减弱,引起血管硬化和钙化[23-24]。另维生素 D缺乏会导致高血压、脂代谢紊乱,间接导致动脉硬化钙化发生[25]。本研究发现T2DKD患者及合并肾功能不全时25(OH)D缺乏/不足、缺乏及不足发生率均较高,这或许是T2DKD及合并肾功能不全患者心血管疾病高发及总体病死率高的原因之一。但维生素D过高亦可引起高钙血症导致血管和组织钙化,增加CKD患者患心血管疾病的风险。故维生素D水平应在合适范围才对心血管功能有益,低于或超出这个范围均可能增加心血管疾病风险[26-27]。目前推荐成人维生素D适宜标准为50~75nmol/L,但对于CKD及DKD患者,其适宜标准尚无定论,有待更多前瞻性、多中心对照研究确定。
综上所述,T2DKD患者中维生素D缺乏/不足发生率高,维生素D缺乏/不足可能是T2DKD患者肾功能不全的易患因素。积极控制T2DM患者HbA1c、高尿酸血症、高TG血症的同时,补充活性维生素D可能有助于减轻肾损伤,延缓肾功能不全进展。
[1] 中华医学会内分泌学分会.中国成人糖尿病肾脏病临床诊断的专家共识[J].中华内分泌代谢杂志,2015,31(5):379-385
[2] Holick MF.Vitamin D deficiency[J].N Engl J Med,2007,357(3):266-281
[3] 王晓菁,陈海平.慢性肾脏病定义及分期系统修订的进展——2012-KDIGO慢性肾脏病临床管理实践指南解读[J].中华老年多器官疾病杂志,2014,13(5):396-400
[4] Hurskainen AR1,Virtanen JK,Tuomainen TP,et al.Association of serum 25-hydroxyvitamin D with type 2 diabetes and markers of insulin resistance in a general older population in Finland[J].Diabetes Metab Res Rev,2012,28(5):418 -423
[5] 郝帅,郭丽婷,高志红,等.2型糖尿病患者维生素D缺乏的调查分析[J].国际内分泌代谢杂志,2014,34(3):153-157
[6] 王宓,邵茁,王梅.慢性肾脏病229例25羟基维生素D浓度及影响因素分析[J].中国实用内科杂志,2012,32(2):138-141
[7] 周晓辉,王倩杰,朱梅生,等.新疆维吾尔族和汉族中老年人群维生素D水平的流行病学调查[J].中国骨质疏松杂志,2012,18(5):453-457
[8] Patel TV,Singh AK.Role of vitamin D in chronic kidney disease[J].Semin Nephrol,2009 ,29(2):113 -121
[9] Kaseda R,Hosojima M,Sato H,et al.Role of megalin and cubilin in the metabolism of vitamin D(3)[J].Ther Apher Dial,2011,15(Suppl 1):14-17
[10]Joergensen C,Gall MA,Schmedes A,et al.Vitamin D levels and mortality in type 2 diabetes[J].Diabetes Care,2010,33(10):2238-2243
[11]Plum LA,Zella JB.Vitamin D compounds and diabetic nephropathy[J].Arch Biochem Biophys,2012,523(1):87 -94
[12]黄健,黄韵祝,钟凯,等.血清维生素D3水平与糖尿病肾病相关性研究[J].微量元素与健康研究,2013,30(5):8-10
[13]张士荣,时照明,张晓梅,等.25-羟维生素D3水平与2型糖尿病肾病的相关性研究[J].蚌埠医学院学报,2014,(11):1470-1472
[14]李冬梅,张颖,丁波,等.血清25羟维生素D缺乏与糖尿病肾病的关系[J].中华内科杂志,2013,52(11):970-974
[15]Patel TV,Singh AK.Role of vitamin D in chronic kidney disease[J].Semin Nephrol,2009,29(2):113 -121
[16]Kuhlmann A,Haas CS,Gross ML,et al.25 - Dihydroxyvitamin D3 decreases podocyte loss and podocyte hypertrophy in the subtotally nephrectomized rat[J].Am J Physiol Renal Physiol,2004 ,286(3):F526-F533
[17]Panichi V,Migliori M,Taccola D,et al.Effects of 1,25(OH)2D3 in experimental mesangial proliferative nephritis in rats[J].Kidney Int,2001,60(1):87 -95
[18]Takiishi T,Gysemans C,Bouillon R,et al.Vitamin D and diabetes[J].Endocrinol Metab Clin North Am,2010,39(2):419 -446
[19]Martin RJ,McKnight AJ,Patterson CC,et al.A rare haplotype of the vitamin D receptor gene is protective against diabetic nephropathy[J].Nephrol Dial Transplant,2010,25(2):497 -503
[20]Ravani P,Malberti F,Tripepi G,et al.Vitamin D levels and patient outcome in chronic kidney disease[J].Kidney Int,2009,75(1):88-95
[21]Drechsler C,Pilz S,Obermayer-Pietsch B,et al.Vitamin D deficiency is associated with sudden cardiac death,combined cardiovascular events,and mortality in haemodialysis patients[J].Eur Heart J,2010,31(18):2253 -2261
[22]Wang AY,Lam CW,Sanderson JE,et al.Serum 25 - hydroxyvitamin D status and cardiovascular outcomes in chronic peritoneal dialysis patients:a 3 - y prospective cohort study[J].Am J Clin Nutr,2008,87(6):1631 -1638
[23]Arcidiacono T,Paloschi V,Rainone F,et al.Renal osteodystrophy and vascular calcification[J].J Endocrinol Invest,2009,32(4 Suppl):21-26
[24]Vaidya A,Forman JP,Hopkins PN,et al.25 - Hydroxyvitamin D is associated with plasma renin activity and the pressor response to dietary sodium intake in Caucasians[J].J Renin Angiotensin Aldosterone Syst,2011,12(3):311 -319
[25]廖琳,路建饶,王新华,等.血液透析患者钙磷代谢和血管钙化及其危险因素[J].中国综合临床,2014,30(5):453-457
[26]杨俊伟.维生素D制剂在慢性肾脏病患者中的应用[J].肾脏病与透析肾移植杂志,2011,20(2):145-146
[27]Hsu JJ,Tintut Y,Demer LL.Vitamin D and osteogenic differentiation in the artery wall[J].Clin J Am Soc Nephrol,2008,3(5):1542-1547

