调节性T细胞获得及其免疫抑制作用的实验研究
王凊,车绪春
(1.天津医科大学总医院检验科,天津 300052;2.天津医科大学免疫学系,天津 300070)
调节性T细胞获得及其免疫抑制作用的实验研究
王凊1,车绪春2
(1.天津医科大学总医院检验科,天津 300052;2.天津医科大学免疫学系,天津 300070)
目的:制备诱导性调节性T淋巴细胞(iTreg),探讨iTreg的免疫抑制功能及其作用机制。方法:免疫磁珠分选获取CD4+CD25-T淋巴细胞,TGF-β诱导法获取iTreg,流式细胞术和实时定量PCR方法检测iTreg的得率及其叉头状/翅膀状螺旋转录因子(Foxp3)mRNA水平,活性染料羧基荧光素乙酰乙酸琥珀酰亚胺酯(CFSE)染色和流式细胞术方法观察Treg细胞对CD4+T淋巴细胞体外增殖能力的影响。利用ELISA和流式细胞术方法分别检测iTreg的IL-10、TGF-β分泌以及胞内因子IL-2、IL-4、IL-17、干扰素-γ(IFN-γ)水平。结果:TGF-β诱导法iTreg得率可达42.10%,TGF-β诱导后获得的iTreg Foxp3 mRNA水平明显升高。获得的iTreg可以抑制自体CD4+T淋巴细胞增殖,IL-10和TGF-β分泌水平较原始CD4+T细胞上升(P<0.05),但几乎不分泌IL-2、IL-4、IL-17、IFN-γ。结论:利用TGF-β诱导法制备获得的iTreg具有明显的免疫抑制功能,其发挥免疫抑制功能过程可能均有IL-10和TGF-β的参与。
诱导性调节性T细胞;Foxp3;TGF-β;免疫抑制
调节性T细胞(Treg)介导的免疫调节是机体保持对自身抗原特异性免疫耐受,维持T细胞稳定状态的一个重要机制。1995年,Sakaguchi等[1]首次报道了CD4+CD25+Treg细胞。Treg细胞过继疗法已经在某些疾病的实验研究中取得重要进展[2],而外周血中无法分离出大量Treg细胞,要将Treg细胞真正应用于治疗,首先需要获得足够数量的有治疗意义的Treg细胞[3]。Hjerrild等首次报道发现叉头状/翅膀状螺旋转录因子(Forkhead/winged helix transcription factor,Foxp3)参与Treg细胞的发育及其作用发挥的过程。Wildin等和Bennett等报道人类Foxp3基因和Scurfy小鼠的Foxp3基因存在同源性(小鼠Foxp3基因编码的蛋白质也称Scurfy),Foxp3基因敲除的小鼠产生的CD4+CD25+T细胞不具备调节功能,即无Treg细胞,从而引起自身免疫性疾病的发生[4]。体外通过转基因技术将CD4+T淋巴细胞表达Foxp3,获得的Treg细胞可具有与nTreg(native Treg,天然型Treg)相同的表型和功能[5]。另外,TGF-β能够诱导外周CD4+T表达Foxp3,并成为与nTreg相似的iTreg(inducible Treg,诱导型Treg)[6]。本文通过研究体外获取Treg细胞的方法—利用TGF-β诱导初始CD4+CD25-T淋巴细胞来制备CD4+CD25+Treg细胞,观察获得Treg样细胞的得率,对方法学进行优化、鉴定,研究Treg对免疫的调控功能及其抑制作用机制。
1 材料和方法
1.1 材料尼龙毛柱(Wako chemical公司);流式细胞仪(BD公司);淋巴细胞分离液(中国医学科学院生物工程研究所);CFSE(invitrogen公司);human IL-2(PEPROTECH公司);anti-CD3(R&D公司);anti-CD28(R&D公司);CD4+CD25+Regulatory T cell isolation kit(Miltenyi公司);IL-10和TGF-β ELISA试剂盒(R&D公司)。
1.2 方法
1.2.1 CD4+CD25-淋巴细胞及CD4+CD25+T淋巴细胞的获得[6]采用免疫磁珠法(Magnetic activated cell sorting,MACS)。将正常人富含血小板白膜与PBS混合,加入淋巴细胞分离液,离心吸取单个核细胞。以抗CD8+T细胞抗体和磁珠结合方法,分离CD4+T细胞,加入抗CD25抗体,先收集的未标记细胞即为CD4+CD25-淋巴细胞,磁珠自动分选仪的磁场阳性选择CD4+CD25+淋巴细胞,检测细胞活性。流式细胞仪检测CD4+CD25+Treg细胞纯度。
1.2.2 TGF-β诱导CD4+CD25+Foxp3+调节性T细胞[7]
人外周血单个核细胞分离法获得B细胞,即刺激细胞。将5×105CD4+CD25-T淋巴细胞和刺激细胞1∶1培养,培基中加入IL-2(200 U/mL)、anti-CD3(10 μg/mL)和anti-CD28(10 μg/mL),并分别加入不同浓度TGF-β(0、1、5和10 ng/mL)。分别在第2、4、6、8、10天,流式细胞仪分析细胞表型标记(Foxp3),计数iTreg细胞,并计算获得率。
1.2.3 TGF-β诱导CD4+CD25+Foxp3+调节性T细胞Foxp3基因的表达实验分组如下,TGF-β诱导组:CD4+CD25-T淋巴细胞和相同数量的刺激细胞加入到96孔板中,并加入IL-2(200 U/mL)、anti-CD3 (10 μg/mL)和anti-CD28(10 μg/mL),加入5 ng/mL TGF-β诱导获得iTreg细胞;CD4+T淋巴细胞活化组:将CD4+CD25-T淋巴细胞和相同数量的刺激细胞混合培养,并加入IL-2(200 U/mL)、anti-CD3(10 μg/mL)和anti-CD28(10 μg/mL);CD4+T淋巴细胞未活化组:CD4+CD25-T淋巴细胞单纯培养基培养。收集3组培养细胞,细胞总RNA提取采用Trizol法,real-time PCR方法检测Foxp3 mRNA。
1.2.4 TGF-β诱导CD4+CD25+Foxp3+调节性T细胞对CD4+T淋巴细胞体外增殖影响实验分组如下:(1)TGF-β诱导iTreg细胞组;(2)nTreg组;(3)对照组为活化的CD4+T淋巴细胞即non-Treg(非Treg),未经CFSE染色。3组均以经CFSE染色的CD4+CD25-T淋巴细胞为作用细胞。具体步骤如下:CD4+CD25-T淋巴细胞计数后,加入CFSE稀释液混匀,之后中止染色,DMEM完全培养基洗涤,收集细胞,并加入IL-2、anti-CD3、anti-CD28,使其终浓度分别为200 U/mL、10 μg/mL、10 μg/mL。将培养板中的TGF-β诱导iTreg细胞、nTreg细胞、non-Treg细胞,调整浓度为2×106个/mL,分别同时加入CFSE染色CD4+CD25-T淋巴细胞,混匀。将上述细胞分别用96孔板培养于10%胎牛血清的DMEM培养基中。37℃、5%CO2条件下培养72 h,流式细胞术分别检测第1、2、3代CD4+T增殖细胞的比例。
1.2.5 TGF-β诱导CD4+CD25+Foxp3+调节性T细胞IL-10、TGF-β分泌水平的比较收集TGF-β诱导组iTreg细胞和non-Treg细胞悬液(获得步骤同前)。细胞计数并调整细胞浓度为2×106/mL,接种于96孔培养板中,37℃、5%CO2,72 h后,收集每孔上清液。IL-10和TGF-β浓度检测采用ELISA试剂盒,具体检测步骤参照说明书,450 nm波长下检测OD值。
1.2.6 TGF-β诱导CD4+CD25+Foxp3+调节性T细胞胞内细胞因子检测收集TGF-β诱导组iTreg细胞和non-Treg细胞悬液(获得步骤同前)。加入等体积的胞内因子刺激液,37℃、5%CO2条件下培养4 h。离心收集细胞,加入细胞固定液,再加入破膜液。离心弃上清。分别加入PE标记的IL-2、IL-4、IL-17、IFN-γ抗体,孵育后离心弃上清,流式细胞仪检测。1.3数据分析SPSS 19.0统计软件进行处理,数据以±s表示,多组均数间比较采用one-way ANOVA(单因素方差分析),组间多重比较应用Student-Newman-Keuls法;两组比较应用t检验,以P<0.05为有统计学差异。
2 结果
2.1 TGF-β诱导法获得iTreg细胞与对照组(0 ng/mL)比较,应用TGF-β(1、5、10 ng/mL)在第2、4、6、8、10天均能使细胞Foxp3蛋白表达升高(均P<0.05,图1)。当加入5 ng/mL TGF-β,诱导6 d后,iTreg细胞得率最高,为42.10%,为最佳诱导条件。

图1 不同浓度TGF-β及不同作用时间诱导获得iTreg细胞Fig 1iTreg acquired by different concentrations of TGF-β and induction time
2.2 iTreg细胞Foxp3 mRNA表达检测Real-time PCR结果显示,与CD4+T淋巴细胞活化组比较,TGF-β诱导后获得的iTreg Foxp3 mRNA水平明显升高,具有统计学差异(P<0.01)(图2)。

图2 iTreg细胞Foxp3 mRNA水平Fig 2Foxp3 mRNA level of iTreg
2.3 iTreg细胞对CD4+T淋巴细胞体外增殖的影响比较与对照组比较,TGF-β诱导获得的iTreg细胞组以及nTreg细胞组的第一代M1和第二代M2 CD4+T淋巴细胞的体外增殖均显著被抑制,具有统计学差异(P<0.05)(图3)。

图3 iTreg细胞对自体CD4+T淋巴细胞增殖的影响Fig 3Effect of iTreg on the proliferation of autos CD4+T lymphocytes
2.4 两种iTreg细胞IL-10和TGF-β分泌水平比较TGF-β诱导iTreg细胞的IL-10和TGF-β水平均明显上升,与non-Treg对照组比较具有统计学差异(P<0.05)(表1)。
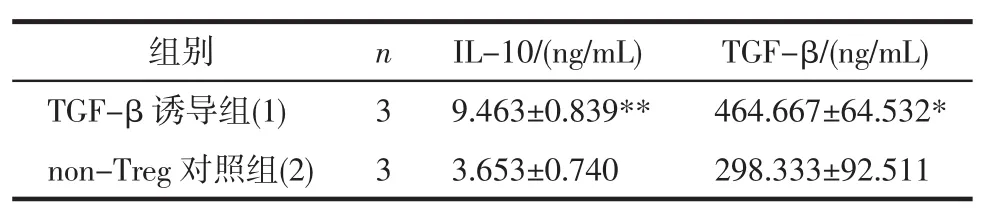
表1 iTreg的IL-10、TGF-β水平检测Tab 1The IL-10 and TGF-β levels of iTreg
2.5 两种iTreg细胞胞内细胞因子IL-2、IL-4、IL-17、IFN-γ水平比较经流式细胞仪法检测表明,TGF-β诱导的iTreg细胞均几乎不分泌IL-2、IL-4、IL-17、IFN-γ,检测值分别为(0.32±0.24)、(3.59± 2.72)、(0.39±0.22)、(1.00±0.30)ng/mL。
3 讨论
Treg细胞是目前免疫学领域研究的热点,对于维持机体免疫耐受和免疫应答稳态具有重要的作用。近年来,越来越多研究表明,Treg细胞在免疫相关性疾病的发生、发展过程中有着重要的临床意义[8-9],如多发性硬化、红斑狼疮等自身免疫病以及与移植免疫、肿瘤和感染免疫有关[10-12]。由于Treg细胞具有强大的免疫调节特性,将其作为治疗靶点,利用其在细胞和分子水平机制上发挥作用,达到自身免疫的平衡,从而达到治疗的目的。但由于Treg细胞只占正常人外周血CD4+T淋巴细胞的5%~10%,及其免疫无能特性,在体外难以培养且增殖能力较差,因而限制了其研究进展。Treg细胞的来源成为Treg细胞临床研究及其应用的首要挑战,因为大量的与受体MHC匹配Treg细胞是Treg过继疗法所必需的,从体外获得足够数量的有治疗意义的Treg细胞成为当务之急。
Foxp3属于叉头样转录因子家族,它主要在CD4+CD25+调节性T细胞中表达,是调控Treg分化和行使免疫调节功能的主控基因,可作为CD4+CD25+调节性细胞的特异性标志物以及筛选标志。重要的是,Foxp3高表达转基因小鼠的Treg细胞数目显著增加,Foxp3基因敲除的小鼠则无独立的Treg细胞,具有整体免疫失调表现,类似于将具有下调免疫应答作用的共刺激分子CTLA-4基因敲除的小鼠体征[13]。许多研究均证明Foxp3在CD4+CD25+Treg细胞发育、分化上的作用,并且其在CD4+CD25+Treg免疫抑制功能上也起着举足轻重的作用。TGF-β是一种诱导机体耐受、调节免疫反应的重要的抑制性细胞因子,它诱导初始T细胞分化为Treg细胞,并能抑制T细胞的增殖和作用,是调节性T细胞分化、功能维持的关键因子。TGF-β可诱导初始CD4+CD25-T细胞转化为CD4+CD25+T细胞并表达Foxp3[14]。最早的相关研究报道,是利用mRFP(红色荧光蛋白)标记Foxp3,转染小鼠后,发现表达Foxp3的细胞表达mRFP。胰岛瞬时表达TGF-β转基因的非肥胖性糖尿病(non-obese diabetic,NOD)小鼠,高表达Foxp3的CD4+CD25+T细胞的数目增多,糖尿病发生率低。并且,iTreg细胞过继输注入非肥胖性糖尿病小鼠,糖尿病发病也可被抑制。TGF-β诱导初始T细胞分化为Treg细胞的过程中,IL-2可通过STAT-5促进Treg细胞的分化。IL-2联合TGF-β诱导天然CD25-T细胞成为Treg细胞,在没有IL-2情况下,TGF-β诱导小鼠T细胞Foxp3的表达与nTreg相比明显减少。另外,通过混合淋巴细胞培养,还发现IL-2是TGF-β诱导的Treg细胞具有抑制功能活性所必需的,中和IL-2后会消除TGF-β诱导的Treg细胞的抑制功能。
因此,本研究采用TGF-β诱导的方法获得iTreg细胞。加入IL-2、抗CD3单克隆抗体、抗CD28单克隆抗体和B细胞使CD4+CD25-T淋巴细胞活化,观察了不同浓度TGF-β,不同诱导时间条件下,对Foxp3表达的影响及iTreg细胞的得率。结果显示,应用TGF-β在第2、4、6、8、10天均能使细胞Foxp3蛋白表达升高,最高为42.10%。iTreg细胞得率到达高峰后随时间延长而降低。这可能是由于伴随着培养时间的过度,细胞开始出现凋亡[15]。此外,CD4+T淋巴细胞的增殖可被细胞因子TGF-β所抑制,从而CD4+T淋巴细胞分化为Treg细胞过程被抑制。
最佳实验条件下,TGF-β诱导后得到iTreg,得率均达40%以上。Treg细胞的抑制作用涉及CD4+、CD8+T细胞、B细胞、树突状细胞、自然杀伤细胞和单核/巨噬细胞,以及免疫细胞之间的相互联系。本文研究了iTreg细胞对CD4+T淋巴细胞的增殖抑制作用,并对其免疫调节能力进行分析。结果发现,TGF-β诱导获得的iTreg细胞组以及nTreg细胞组的CD4+T淋巴细胞的体外增殖均显著被抑制,说明获得的Treg细胞具有免疫抑制功能,其与天然的CD4+CD25+Treg细胞的表型和功能一致。
已证实IL-10的分泌是iTreg发挥免疫抑制功能重要细胞因子,而如前述TGF-β是调节性T细胞分化、功能维持的关键因子。本研究表明,iTreg细胞IL-10和TGF-β分泌水平较原始CD4+细胞均显著上升,说明调节性T细胞的作用模式,即分泌IL-10和TGF-β作用于靶细胞,并通过细胞间接触使膜表面分子CTLA-4发挥抑制作用。另外,Treg细胞与CD4+T细胞和CD8+T细胞之间的区别在于Treg细胞不分泌IL-2、IL-4、IL-17和IFN-γ等细胞因子。通过流式细胞仪检测,iTreg细胞几乎不分泌上述各种细胞因子。
综上所述,本研究成功建立了TGF-β诱导法来获取iTreg的方法,优化了实验条件,为研究体外诱导Treg提供了有力的方法学证据;进一步研究了iTreg细胞的免疫抑制功能及发挥调节作用的初步机制,检测了iTreg的细胞因子分泌,为其在临床上应用发展提供坚实的理论基础。
[1]Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic selftolerance maintained by activated T cells expressing IL-2 receptor alpha-chains(CD25).Breakdown of a single mechanism of selftolerance causes various autoimmune diseases[J].J Immunol,1995,155(3):1151
[2]Canavan J B,Afzali B,Scottà C,et al.A rapid diagnostic test for human regulatory T-cell function to enable regulatory T-cell therapy[J].Blood,2012,119(8):e57
[3]Cao C,Ma T,Chai Y F,et al.The role of regulatory T cells in immune dysfunction during sepsis[J].World J Emerg Med,2015,6 (1):5
[4]Brunkow M E,Jeffery E W,Hjerrild K A,et al.Disruption of a new forkhead/winged-helixprotein,scurfin,resultsinthefatal lymphoproliferative disorder of the scurfy mouse[J].Nat Genet,2001,27(1):68
[5]Hori S,Nomura T,Sakaguchi S.Control of regulatory T cell development by the transcription factor Foxp3[J].Science,2003,299 (569):1057
[6]Lan Q,Zhou X,Fan H,et al.Polyclonal CD4+Foxp3+Treg cells induce TGFβ-dependent tolerogenic dendritic cells that suppress the murine lupus-like syndrome[J].J Mol Cell Biol,2012,4(6):409
[7]Okamura T,Sumitomo S,Morita K,et al.TGF-β3-expressing CD4+CD25(-)LAG3+regulatory T cells control humoral immune responses[J]. Nat Commun,2015,6(6):6329
[8]Alahgholi-Hajibehzad M,Oflazer P,Aysal F,et al.Regulatory function of CD4(+)CD25(++)T cells in patients with myasthenia gravis is associated with phenotypic changes and STAT5 signaling: 1,25-Dihydroxyvitamin D3 modulates the suppressor activity[J].J Neuroimmunol,2015,281(281):51
[9]Talaat R M,Mohamed S F,Bassyouni I H,et al.Th1/Th2/Th17/Treg cytokine imbalance in systemic lupus erythematosus(SLE)patients: Correlation with disease activity[J].Cytokine,2015,72(2):146
[10]Prinz I,Koenecke C.Therapeutic potential of induced and natural FoxP3(+)regulatory T cells for the treatment of Graft-versus-host disease[J].Arch Immunol Ther Exp(Warsz),2012,60(3):183
[11]Burrell B E,Nakayama Y,Xu J,et al.Regulatory T cell induction,migration,and function in transplantation[J].J Immunol,2012,189 (10):4705
[12]Gonçalves R M,Salmazi K C,Santos B A,et al.CD4+CD25+Foxp3+ regulatory T cells,dendritic cells,and circulating cytokines in uncomplicated malaria:do different parasite species elicit similar host responses[J].Infect Immun,2010,78(11):4763
[13]Sakaguchi S.Naturally arising Foxp3-expressing CD25+CD4+regulatory T cells in immunological tolerance to self and non-self[J]. Nat Immunol,2005,6(4):345
[14]Lu L,Ma J,Li Z,et al.All-trans retinoic acid promotes TGF-βinduced Tregs via histone modification but not DNA demethylation on Foxp3 gene locus[J].PLoS One,2011,6(9):e24590
[15]Fantini M C,Becker C,Monteleone G,et al.Cutting edge:TGF-beta induces a regulatory phenotype in CD4+CD25-T cells through Foxp3 induction and down-regulation of Smad7[J].J Immunol,2004,172 (9):5149
(2015-03-25收稿)
Study on obtaining method of iTreg cells obtaining method and its immunosuppression function
WANG Qing1,CHE Xu-chun2
(1.Department of Clinical Laboratory,General Hospital,Tianjin Medical University,Tianjin 300052,China;2.Department of Immunolgy,Tianjin Medical University,Tianjin 300070,China)
Objective:ToestablishTGF-βinducedmethodtoobtaininducedregulatoryTcells(iTreg),andtostudytheimmunosuppression function and mechanism of iTreg.Methods:CD4+CD25-T were obtained by MACS,after which the iTreg cells were obtained by TGF-β induced method.Flow cytometry and PCR were used to detect iTreg yield and Foxp3 mRNA level,CFSE staining and Flow cytometry were applied to investigate the effect of iTreg on proliferation activity of CD4+T.ELISA and Flow cytometry were adopted to detect iTreg IL-10 and TGF-β secretion levels and intracellular cytokine levels of IL-2,IL-4,IL-17 and IFN-γ.Results:The yield rate of iTreg cells was increased to 42.10%using by TGF-β induced method.The Foxp3 mRNA of the induced iTreg were higher than that of CD4+T(P<0.05). CD4+T cell proliferation and IL-10,TGF-β secretion were significantly inhibited by iTreg cells versus non-Treg cells(P<0.05).IL-2,IL-4,IL-17 and IFN-γ were hardly secreted by iTreg cells.Conclusion:TGF-β induction can be successfully used to obtain iTreg.IL-10 and TGF-β may be both involved in iTreg immunosuppression function.
induced regulatory T cells;Foxp3;TGF-β;immunosuppression
R392.12
A
1006-8147(2015)05-0393-04
王凊(1978-),女,主管技师,硕士,研究方向:免疫调节及抗肿瘤免疫;通信作者:车绪春,E-mail:chexuchun@tmu.edu.cn。

