伴随诊断
——个体化治疗助推器
汤森路透
·业界关注·
伴随诊断
——个体化治疗助推器
汤森路透
伴随诊断作为一种体外诊断技术,能够提供有关患者针对特定治疗药物的治疗反应的信息,帮助医生制定更有效的治疗方案,从而改善治疗预后并降低保健开支,真正实现患者的个体化治疗。从学术文献、发明专利、临床数据和审批监管等层面介绍伴随诊断的研究进展。
伴随诊断;个体化治疗;靶向药物;生物标志物

1 伴随诊断概述
伴随诊断(companion diagnostics,CDx)是一种与靶向药物相关的体外诊断技术,主要通过测量人体内蛋白、变异基因的表达水平,了解不同患者对特定药物的治疗反应,筛选出最合适的用药人群并有针对性地进行个体化治疗,从而改善其治疗预后和降低保健开支。美国FDA于2014年8月6日颁布了《伴随诊断指南》(以下简称《指南》)[1],全球的利益相关者对其既寄予厚望又忧心忡忡。《指南》可帮助分辨哪一种病患需要进行伴随诊断测试,从而指导企业在开发药品的同时也开发一个伴随诊断的测试方案。但也存在一些疑问,如备受关注的注册审批和医保报销方面的不确定性是否会导致企业对伴随诊断的开发热情受挫?
某些疾病可能是由特定的基因突变引起,理想状况下,伴随诊断有助于鉴定特定基因突变的患者群针对特定治疗药物的治疗反应信息,以识别最佳用药人群。伴随诊断推动了靶向药物的发现和有效递送,可为病人筛选出有效的治疗方案,节省无效治疗的时间和费用,且降低不必要的毒副作用。但在实际开发过程中,只有投入大量研究后才可能发现某一生物标志物与某一特定药物的靶点相关。这就需要对表现出疾病症状的患者群进行大量研究,以发现该生物标志物与特定患者之间的密切相关性,以及确定该生物标志物是否具有作为药物靶点的活性功能。
一篇由多名作者署名的高被引文章曾建议,开发生物标志物来替代动物模型研究。对多个研究机构所开展项目的大规模中期分析也表明,基于动物实验结果决定是否进行下一步药物研究的方式随机性大,并不是最好的选择[2]。然而,最近一项针对埃博拉病毒的研究表明,问题的本质在于我们如何看待动物模型,如果能够研究具有多样性的动物种群,将有助于发现生物标志物与疾病临床表现之间的联系[3]。
伴随诊断研究耗资巨大且需要特定的患者群或对应的替代选择(例如动物模型、细胞库或分子库),还需要对大量数据进行分析和研究统计学相关性方法。其最终目的是从大量生物标志物中筛选到能够真正攻克某种疾病的特定生物标志物。这需要药物研发人员、诊断技术公司、学术机构以及政府部门的通力合作才能实现。
基于基因与疾病之间的映射关系以及药物与基因组相互作用的机制,需要对多个生物标志物及基因多态性进行实时监控,因而伴随诊断是个体化治疗的一个非常重要的方面。伴随诊断不同于生物标记谱型检测,后者主要用于绘制每一名患者的基因缺陷图谱或药物敏感性图谱。生物标记与疾病治疗的密切关系导致对诊断检测的监管审批更为严格,同时也给耗资巨大的药物开发过程背后的整体经济决策带来更多不确定因素。
2 从3个层面看伴随诊断的研究进展
本文以Thomson Reuters Web of Science™数据库为数据源,经Thomson Innovation访问口进入,检索的论文发表时间设定为2010—2015年,检索与生物标志物相关的文献,同时锁定关键词“个体化治疗”或其近义词进一步筛选,排除基于生物标志物的用于损伤鉴定或分级以进行手术干预或放疗的诊断用药类文献。
本文从以下3个层面分析伴随诊断在个体化治疗市场的重要地位:①通过对学术文献分析,了解最值得期待的CDx研究领域和开发领域的优劣情况,且表明全球合作开发提高了生物标志物选择和新药发现的效率且降低了成本;②通过对专利分析,了解制药行业和诊断试剂行业的投资热点,更好地助力针对重大疑难疾病的新药研发管线;③通过对临床数据和研发管线数据分析,获知生物标记领域的临床试验和开发现状,以及获得审批且在不同疾病治疗领域上市的策略。
2.1 文献发表反映伴随诊断广泛的全球合作
本次调查涉及3 663篇已发表的文献,均与生物标志物在个体化治疗中的应用有关,其中大部分文献中使用了“伴随诊断”这一术语。
本次文献调查结果反映了CDx领域广泛的全球合作关系:CDx相关文献共涉及来自78个国家的作者,超过50%的文献至少具有一名美国作者,此外发文较多的国家还包括英国、德国、加拿大、中国、意大利、荷兰、法国、西班牙、澳大利亚、日本、瑞士和瑞典;22%的文献由多个国家的作者署名,其中有些文献的作者来自多达17个国家。
本次调查文献的作者分别来自不同的机构(见图1),包括约1 990所高校和医院、840个国家实验室、社会团体和非盈利性机构,以及352家公司。表1列出了在个体化治疗和伴随诊断领域发表学术论文较多的一些机构。
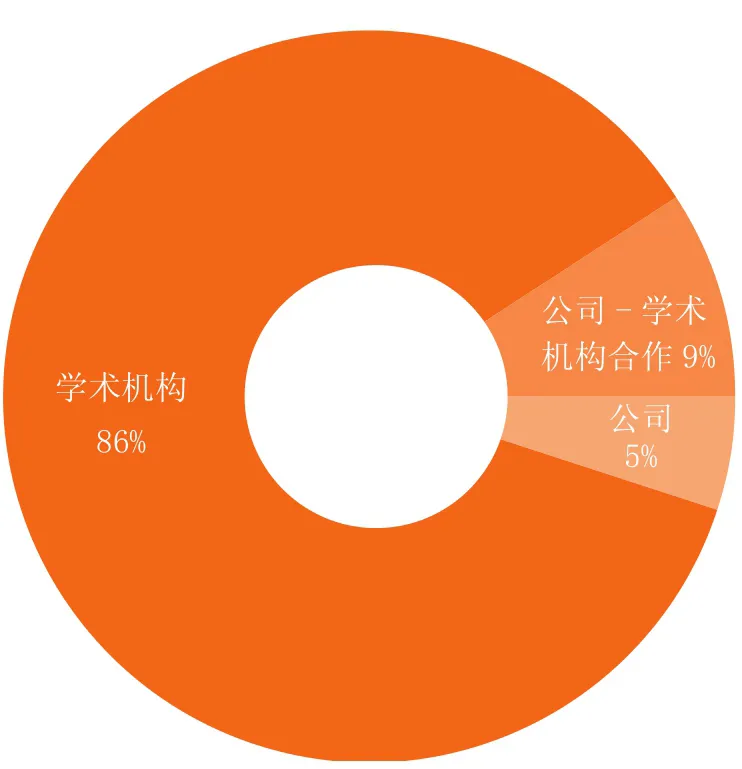
图 1 伴随诊断领域发表学术论文的机构分类Figure 1 Sectors contributing to scholarly literature about companion diagnostics

表 1 伴随诊断领域发文数量最多的机构Table 1 Entities contributing the most publications about companion diagnostics

续表1
例如,巴西Ribeirão Preto大学开展的一项针对疼痛的研究发现,纤维肌痛综合征(fibromyalgia syndrome,FS)个体对疼痛敏感性可能与儿茶酚胺氧位甲基转移酶(catechol-O-methyltransferase,COMT)基因突变相关。有研究者通过对100名FS患者COMT基因中单核苷酸多态性与疼痛的关系研究发现,COMT的多态性与疼痛敏感性相关[4]。
对调查的这3 663篇文献作特征分析发现,CDx研究涉及领域广泛,其中癌症的诊断试剂研究占主流,以及2010—2015年CDx领域的其他研究重心。表2根据技术领域对有关CDx的发文量、发文量随时间的变化情况以及文献在该领域的影响力进行了分类。表2根据相关关键词分类可能较宽泛,例如个体化治疗或药物基因组学等;有些分类可能只针对具体的方法或模式,例如基于干细胞的研究,采用某种检测方法可一次进行多个检验,或者利用已有的遗传标记序列库、细胞库、血液库或组织样品库进行大规模的谱型测定等;其他分类还涉及一些已取得进展或亟待发展的疾病领域。

表 2 有关伴随诊断的发文量、增长趋势和增长量以及对该领域的影响力分类Table 2 Publication categories with indicators of activity, direction and amount of growth, and impact on the field about companion diagnostics

续表2
由表2可见,按照与CDx相关的不同领域分类,发文量激增的4个领域分别是:①明确与伴随诊断相关;②干细胞相关研究;③疼痛控制和成瘾研究;④为酪氨酸激酶抑制剂(替尼类药物)提供用药指导的伴随诊断(已被美国FDA批准)。表2还以时间权重索引评价了已发文章在该领域的影响力,结果表明单克隆抗体类药物(药物名称后缀为mab)的影响力较大,而该类药物常需在伴随诊断的指导下使用,故诊断试剂常与该类药物一体销售。
由图2可见,本次调查涉及的大型制药公司倾向于在本公司已有上市药物和伴随诊断的相关研究领域发表文章;文章通常涉及公司使用生物标志物发现新药或者对伴随诊断进行验证以获得批准的研发过程;还有一些文章涉及其他公司未有候选药物报道的领域,反映出这些公司正与科研能力更强的学术机构之间展开合作。通过对大型制药公司发文情况的总结有助于了解更有效地评价生物标志物的方法和策略。
图2还比较了其他各类机构发文情况可见,各类机构对癌症及其他疾病领域广泛的研究热情;诊断公司更关注诊断试剂的方法学研究。学术机构发表的文献多是对现有技术或临床应用的综述,但约有50%文献报道尚未开发领域的基础研究,特别是公司与学术机构开展的一些合作。

图 2 大型制药公司及其他机构在有关伴随诊断不同技术领域发文的侧重图Figure 2 Matrices showing the publication emphasis of large pharmaceutical companies or sectors in the various technical categories about companion diagnostics
罗氏制药近期发表的一篇文章探讨了利用标记物BRAF V600E(1799T > A)对恶性黑色素瘤患者进行分层,进而鉴定出从特异性抗-BRAF治疗中更可能获益的患者,该生物标记-治疗药物组合疗法属于伴随诊断[5],该文还报道了罗氏制药对其所采用的伴随诊断进行了方法学验证。2.2 申请专利授权是保护伴随诊断开发的重要策略
本文检索的专利时间段与文献发表的时间段相似,但是考虑到文献发表时间的滞后,所以在对专利检索时间范围上前推1年。在2009—2014年期间,个体化治疗中涉及生物标志物的鉴定和使用的专利或已公开的专利申请共有2 202件;在生物标志物相关专利中,明确使用术语“伴随诊断”的情况并不常见。
相比学术论文量,专利数量可能更能展现公司的研发能力。由图3可见,55%的CDx相关专利都归属企业所有;许多学术机构例如大学、医院、政府部门以及非营利性机构也有丰硕的相关专利成果。只有发明受到了专利保护,才会有更好的诊断试剂和药物使更多患者受益。美国自1980年开始允许研发单位拥有受美国政府资助的发明权,这成为专利领域的又一激励政策。

图 3 各类机构与伴随诊断有关专利申请情况Figure 3 Sectors contributing patents about companion diagnostics
拜杜法案(35 U.S.C. § 200-212)[6]按照37 C.F.R. 401标准实施。该法案允许受美国政府资助的机构享有专利所有权,以回报这些机构在科研和技术转让过程中的付出,同时也要求在政府需要专利授权时优先授权给政府。对于政府资助的技术开发机构,该法案的实施大大提高了其申请专利的积极性。
从本次调查所涉及的专利来看,大部分(71%)专利的首次申请国为美国;其次为欧盟、日本、英国和韩国,且以这4国作为首次申请国的专利总计占20%;剩余的9%包括专利合作条约(PCT)申请或在其他国家首次申请的专利。许多发文量较多的国家其专利数量却相对较少。
由于药物生产和上市受专利保护,故大部分专利在多个国家提出了申请。学术机构大多会向1~4个国家提出同一专利申请,而公司通常会向7~8个国家提出专利申请。本次调查还发现,一些商业价值较大的发明在多达17个国家申请了专利保护。
表3将专利数量较多的申请方分为3类总结:大型制药公司、专注开发生物标志物或诊断试剂的顶级诊断公司和对诊断试剂感兴趣的顶级学术机构。

表3 有关伴随诊断专利数量最多的机构Table 3 Entities contributing the most patents about companion diagnostics

续表3
按照与文献调查中相似的技术领域(一些技术领域由于未检索到相关专利而被省略)对2 202件相关专利进行分类,分析了2009年至今的研发重点。表4从不同技术领域对专利数量、专利数量随时间的变化趋势以及申请专利的影响力进行比较,发现专利数量激增的9个领域,与发文量较多的技术领域相比有很大差异。
从公开专利来看,单克隆抗体类药物(药物名称后缀为mab)专利被引用的次数较多,影响力较大,而该类药物常需在伴随诊断的指导下使用。专利引用次数较高的疾病领域还包括糖尿病、心脏病、内分泌疾病和自身免疫/炎症。

表4 有关伴随诊断的专利数量、增长趋势和增长量以及对该领域的影响力分类Table 4 Patenting categories with indicators of activity, direction and amount of growth, and impact on the field about companion diagnostics

续表4
图4比较了本次调查涉及的大型制药公司的专利申请情况,其中多数公司为诊断试剂公司或对诊断试剂感兴趣的其他公司;多数大型制药公司侧重开发针对基因序列或蛋白质结构的生物标志物,少数公司例如武田制药专注于RNA和抗体开发;多数大型制药公司在关注癌症领域的同时也涉及个体化治疗领域的药物开发。Abbvie公司致力于自身免疫疾病/炎症,赛诺菲致力于糖尿病,强生目前关注肥胖症/代谢病领域。
本次调查中涉及的一些抑制血管形成的产品专利属于激增的糖尿病相关专利的一部分。抗endoglin(CD102)抗体不仅可用于癌症治疗,还可通过其对血管生成的抑制作用减少糖尿病并发症(如视网膜病、心血管疾病)的发生,该领域的专利有Tracon (US8221753B2 和US8609094B2) 和Serrata (US20140134630A1)。
将这些大型制药公司与诊断试剂公司相比可见,诊断试剂公司重点开发生物标志物及其相关类别产品(深色高亮区域),其在发现新的生物标志物的同时设计使用其相关伴随检测。例如,deCODE Genetics公司(现被安进公司收购)通过对SNPs数据系统的挖掘,发现其与多种疾病相关联(见图4)。
通过调查科研机构的专利申请情况(见图5)发现,多数大型院校致力于多个疾病领域的开发,但仍有部分机构(见图5末尾的一些机构)只专注于某一特定的疾病领域,甚至一些学术机构的科研中心长期仅专注于攻克某一个课题。
图6综合分析了本次调查涉及所有专利,在专利申请量变化情况和通过引用次数反映出高影响力的几个疾病领域和技术类别。由图6可见,糖尿病和肥胖症目前虽不是最大的研究领域,但其在增长速度和影响力上均不容小觑;疼痛/药物成瘾的相关专利数量较少,有待进一步开发;癌症领域一直以来是研究热点,故该领域的专利数量的增长并不足为奇,精神疾病和神经疾病领域也是如此;专利数呈负增长的炎症和心脏病领域的专利引用量却相对较高,侧面反映该领域的研发热情高但成果并不多;科研和政府机构专注于建立与遗传物质和细胞相关的数据库和样本库,为药物开发提供了重要的信息资源,该类专利的引用率也很高。

图4 大型制药公司及其他公司在有关伴随诊断不同技术领域的专利申请侧重图Figure 4 Matrices showing the patenting emphasis of large pharmaceutical companies or other companies in the various technical categories about companion diagnostics

图5 学术机构及政府部门在有关伴随诊断不同领域的专利申请情况Figure 5 Activity of academic or government entities in the different patenting categories about companion diagnostics
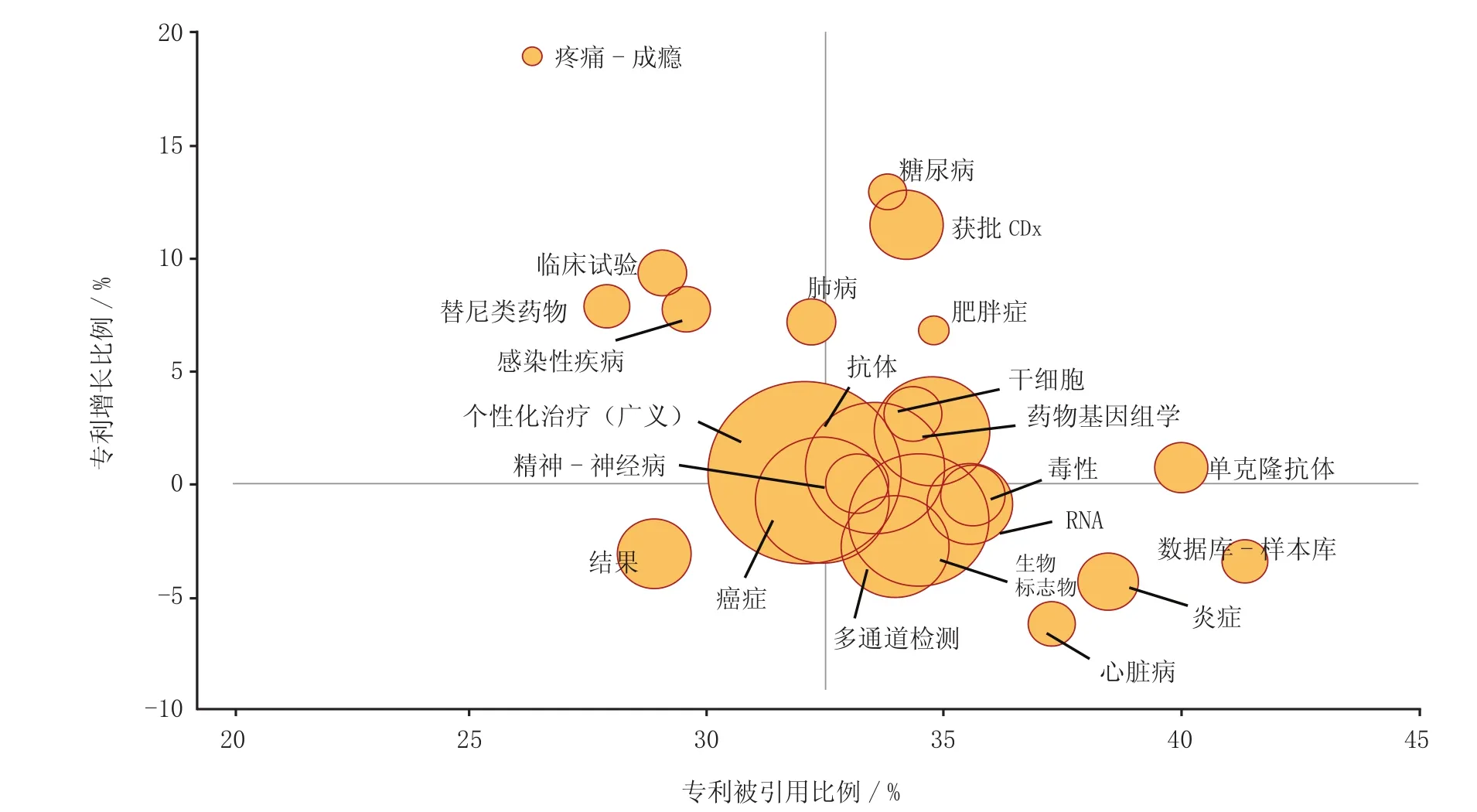
图6 有关伴随诊断不同领域专利的影响力与增长幅度比较Figure 6 Patenting categories compared by their extent of impact vs their growth about companion diagnostics
2.3 临床候选药物与伴随诊断携手并进需要监管部门的积极响应
药品监督管理部门依照法定程序,针对伴随诊断产品的安全性、有效性、质量可控性所进行的研究及其结果实施的监管审批过程是从另一个方面对其系统评价。
体外诊断试剂(in vitro diagnostics,IVD)在美国作为医疗器械管理,与药物分属完全不同的审批通道[7]。欧洲的情况也大致相似,药物由欧洲药物管理局(EMA)审批,而IVD由指定机构(EU指导下的国家政府机构)审批。从全球情况来看,目前针对IVD的监管缺乏协调性,各国正商讨是否将药物与IVD归口相同的管理机构/通道。
在美国,有3条IVD的申请通道(见图7):①由美国卫生和公众服务部的医疗保险和医疗补助服务中心(CMS)管理的实验室开发诊断测试(laboratory diagnostic test,LDT)通道。在此模式下,只要是有临床实验室改进修正案(CLIA)执照的实验室,其研发的产品和技术服务就可以合法进入临床,合理收费。实验室取得CLIA标准相关认证后,检测结果即可用于指导临床诊疗。2014年7月美国FDA在向国会提交的信函中表明,对之前仅通过LDT通道审批的高风险检测(例如伴随诊断)[8]将加强监管,同时对于目前提出的管理办法广泛听取意见。②受FDA监管的上市前通告(也称作510K)通道,主要对检测产品的有效性做验证评价。诊断试剂公司通常选择这一通道申报。③上市前批准(PMA)通道,该通道同样受FDA监管,是审批最严格同时也是申报数量最少的通道。与诊断试剂公司不同,大型制药公司对这一申请通道拥有更丰富的经验。伴随诊断产品可通过上述任何一个通道进行申报。
针对美国FDA近期颁布的《伴随诊断指南》[1]热议的一个问题,即鉴于FDA的药品监管和医疗器械监管分属不同的部门,那么药品和医疗器械审查之间应该开展何种程度的协作?制药企业也存在质疑,如果已存在上市前通告检测,那么较难申请的PMA通道是否还有必要?如果在药物获批前就已存在较多生物标志物检测,选择开发更为复杂或昂贵的检测对于药物开发公司而言就不太有吸引力了。也有人担心PMA审批可能会推迟药物获批。
美国FDA已试图消除这些顾虑,但仍需更多的实际操作经验来创造相对稳定的审批环境。药物开发企业和诊断试剂开发企业之间将开展更多合作,以应对诊断试剂需求增加且在申报通道的选择上可以更早做出决策。早期的合作有利于制定专利申请策略,将诊断试剂也包括在临床试验中且还能在申报通道的选择上做出理性判断。

图7 美国诊断试剂审批通道Figure 7 US Regulatory Pathways for Diagnostics
对患者医疗费用报销的可预测性是影响审批决策的一个重要因素。伴随诊断有助于确定最有可能针对治疗药物产生响应的患者群体,促进药物在相对有限的市场中使用,提高药物的有效性、安全性和销售额。同时也增加了药物相关的诊断检测自身销售额,因为在临床用药决策制定过程中有时需要甚至必须使用伴随诊断。复杂诊断试剂的开发和使用成本相对较高,在PMA审批通道中的投资要求也最高。此外,真正掌控治疗决策的生物标志物相对较少,因此可能会在许多阴性患者中进行检测,从而导致整体医疗成本的增加。
经Diaceutics Research召集的专家组估算,开发诊断检测的费用为20~1亿美元,具体费用取决于多种因素,例如研发成本、新旧分析对比、相关权益的获得、审批费用、GMP生产、临床评价、培训、上市等[9]。
现对一临床开发实例——辅助制定黑色素瘤治疗决策的诊断试剂作一介绍。目前已有数种获批的伴随诊断检测用于指导该疾病的治疗决策。如图8所示,在黑色素瘤中,引起不可控细胞增殖的生化步骤涉及多个生物分子,包括作用于黑色素瘤细胞的胞外信号,诱导引起细胞过度分裂的胞内黑色素瘤细胞信号通路。当因患者的遗传差异性使这些生物分子存在多样性时,其就成为生物标志物,对其进行研究有助于开发选择性靶向药物。

图8 黑色素瘤细胞3-D图像Figure 8 Melanoma Cell—3D View
B-raf生物标记的重要性在于只有一部分黑色素瘤患者中存在B-raf突变(见图9),但存在这一突变的患者亚群数量庞大。B-raf是丝氨酸-苏氨酸激酶,是MAPK信号转导通路之一MEK的激活因子,这些通路可能控制黑色素瘤和其他癌症的生长[10](见图10)。

图9 抑制剂vemurafenib位于活性中心的B-raf V600E突变体图Figure 9 Diagram of the V600E variant B-raf enzyme with vemurafenib inhibitor positioned in the active site

图10 癌前病变黑色素细胞中B-Raf激酶信号转导通路Figure 10 B-Raf kinase signaling in a pre-cancerous melanocyte
特定的B-raf突变体酶(V600E)存在于大约50%的黑色素瘤患者中,正常(野生型)酶一直处于非活化状态,但是突变体酶却能被持续激活。与正常酶的另一个不同点在于突变体酶更容易被2种已获批的药物所抑制。这2个选择性靶向B-raf的药物是分别是Plexxikon与 Genentech(现属罗氏)公司合作开发的vemurafenib和葛兰素史克开发的dabrafenib(见图11)。与此同时,还有一些公司开发了用于判断是否存在B-raf突变体的诊断检测,如罗氏公司开发的一种伴随诊断检测和bioM é rieux公司开发的另外一种伴随诊断检测已获得美国FDA批准。如果黑色素瘤患者的V600E突变检测显示为阳性,表明伴随药物(vemurafenib或dabrafenib)之一有可能作为有效治疗药物。相反,不存在B-raf突变的黑色素瘤患者对伴随药物的治疗反应不佳。

图11 抗黑色素瘤药物选择性抑制BRAF-MEK信号通路示意图Figure 11 Schematic of the BRAF-MEK signaling pathway disrupted by selective anti-melanoma drugs
通过对vemurafenib或dabrafenib抑制黑色素瘤的反复研究,目前正在同时鉴定并靶向信号转导中的一些元件,使B-raf下游通路或与B-raf诱导的信号通路相关的平行通路中的细胞分裂被再次激活[11]。
dabrafenib和另外一种药物trametinib的组合疗法(后者为葛兰素史克开发的靶向MEK的药物)已进入加速审批通道,用于携带BRAF V600E或V600K突变的不可切除性或转移性黑色素瘤患者的治疗。
用于检测V600E突变的诊断试剂除了罗氏和bioMérieux公司开发的经PMA通道获批的诊断检测之外,还包括其他诊断试剂,例如Labcorp和NeoGenomics Laboratories公司也提供相关检测,只是基于的检测方法不同,后者通过测序而不是PCR进行检测。这些检测的广泛可获得性有助于在数量庞大但相对分散的患者群中确保药物的适当使用,使患者从中获益。
个体化治疗依赖于鉴定出并充分利用患者之间的基因变异,而候选药物可选择性地干扰这些变异。就黑色素瘤而言,B-raf突变体V600E使酶活性位点发生改变,而这一改变使抑制剂药物更好地与之结合。值得注意的是,B-raf还存在大量的其他变异,但只有V600E突变已开发利用,其结果目前还难以预测,还需开展对其他突变体进行功能研究以确定其用途。
对于药物开发公司而言,伴随诊断的未来开发将步入良性循环阶段。与生物标志物相关的信息可用于指导药物开发,与药物在临床受试者中的药效相关信息可用于发现新的生物标志物。药物开发公司在早期临床检测中采集受试者的细胞样本或DNA样本可以实时追踪生物标志物,这一模式也将越来越普遍。
迄今为止作为伴随诊断通过美国FDA审批的药物/诊断试剂组合还不是很多。FDA推进了此类组合的审批或通道,但该类申请的数量仍较少[12],目前获批的项目主要与癌症相关。在癌症治疗领域,伴随诊断尤其使患者受益。Medical Device Daily[13]的编辑Mark McCarty曾指出:“研发者可利用伴随诊断评价现有药物/诊疗组合对某一新适应证是否有效。发现现有药物新的适应证对于开发企业而言是现有投资获得更大利益回报的有效途径。对于开发成本很高但仍有其他用途可寻的抗癌药也是如此。故制药行业可通过多种途径使伴随诊断的经济效益最大化。”
令人惊讶的是,这一观点很快就得到了验证。最近发现在被称作Langherhans Cell Histiocyctosis或Erdheim-Chester Disease的罕见病中,50%的患者具有B-raf V600E突变并对vemurafenib具有很好的治疗反应[14],其他癌症患者也可能携带B-raf V600E突变,但不一定产生治疗反应。初步研究结果表明,携带B-raf V600E突变的非小细胞肺癌患者可产生治疗反应,但携带B-raf V600E突变的结肠癌患者不会产生治疗反应,这说明与细胞谱系相关的突变可能会影响治疗效果。
目前研究人员和FDA正在积极探索一种“一站式”临床试验,利用生物标志物同时开发伴随诊断和伴随药物,而不针对特定疾病。在美国医学研究会最近召开的一次会议上,来自纪念斯隆-凯特琳癌症中心的David Solit表示已对这一提议进行试验尝试[15]。
除了癌症以外,其他疾病的细胞生物化学途径也具有同样的复杂性和适应性,因此也很可能被用于其他治疗目的。图12显示了阿尔茨海默病研究领域中最受关注的生物标志物在其他疾病中的潜在活性,且根据其在所列疾病中广泛适用性进行分级;针对某一种疾病(例如阿尔茨海默病)的治疗药物很可能应用于其他多个疾病领域,有神经病学领域甚至还有非神经病学领域。
制药行业、学术界以及政府已投入了大量资金用以更有效地整理和利用相关数据,这表明尽管伴随诊断的审批程序仍存在种种阻碍,但当人们认识到解决一个问题的方法实际可以有更广泛的用途时,伴随诊断的使用将大大增加。
致谢:本文涉及的专利和学术文献均来自Thomson Innovation®,也可通过Derwent World Patents Index®(DWPISM)和the Web of ScienceTM访问获得。药物审批信息通过Thomson Reuters CortellisTM,Medical Device Daily (MDD)和BioWorld,Thomson Reuters
IntegritySM,以及美国FDA等多个途径获得。Integrity编辑部制作了B-raf信号通路图,MDD的编辑Mark McCarty分享了其在诊断器械及其管理方面的个人意见,在此一并致谢。

图12 阿尔茨海默病生物标志物应用于其他相关疾病的临床试验数量Figure 12 Matrix showing the number of clinical trials linking Alzheimer’s Disease biomarkers with other diseases in addition to Alzheimer’s
[1]U. S. FDA. In vitro Companion Diagnostic Devices—Guidance for Industry and Food and Drug Administration Staff[EB/OL]. (2014-08-06)[2015-05-18]. http://www.fda.gov/downloads/medicaldevices/ deviceregulationandguidance/guidancedocuments/ucm262327.pdf.
[2]Seok J, Warren H S, Cuenca A G, et al. Genomic responses in mouse models poorly mimic human infl ammatory diseases[J]. Proc Natl Acad Sci U S A, 2013, 110 (9): 3507-3512.
[3]Rasmussen A L, Okumura A, Ferris M T, et al. Host genetic diversity enables Ebola hemorrhagic fever pathogenesis and resistance[J]. Science, 2014, 346(6212): 987-991.
[4]Barbosa F R, Matsuda J B, Mazucato M, et al. Infl uence of catechol-O-methyltransferase (COMT) gene polymorphisms in pain sensibility of Brazilian fi bromyalgia patients[J]. Rheumatol International Int, 2012,32 (2): 427-430.
[5]Halait H, Demartin K, Shah S, et al. Analytical performance of a realtime PCR-based assay for V600 mutations in the BRAF gene, used as the companion diagnostic test for the novel BRAF inhibitor vemurafenib in metastatic melanoma[J]. Diagn Mol Pathol, 2012, 21 (1): 1-8.
[6]U. S. Patent and Trademark Office. United States Code Title 35—Patents[EB/OL]. (2000-12-14)[2015-05-18]. http://www.uspto.gov/web/ offi ces/dcom/olia/aipa/PatLaws1214.pdf.
[7]U. S. FDA. Overview of IVD regulation[EB/OL]. (2015-03-19) [2015-05-18]. http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/ IVDRegulatoryAssistance/ucm123682.htm.
[8]U. S. FDA. Framework for regulatory oversight of Laboratory Developed Tests (LDTs) draft guidance[EB/OL]. (2014-10-03)[2015-05-18]. http://www.fda.gov/downloads/MedicalDevices/ DeviceRegulationandGuidance/GuidanceDocuments/UCM416685.pdf.
[9]Diaceutics Group. Mystery Solved! What is the cost to develop and launch a Diagnostic? [EB/OL]. (2015-04-03)[2015-05-18]. http:// www.diaceutics.com/mystery-solved-what-cost-develop-and-launchdiagnostic.
[10]Wan P T, Garnett M J, Roe S M, et al. Mechanism of activation of the RAF-ERK signaling pathway by oncogenic mutations of B-RAF[J]. Cell, 2004, 116(6): 855-867.
[11]Schayowitz A, Bertenshaw G, Jeffries E, et al. Functional profi ling of live melanoma samples using a novel automated platform[J]. PLoS One,2012, 7(12): e52760.
[12]U. S. FDA. List of cleared or approved companion diagnostic devices[EB/OL]. (2015-05-15)[2015-05-18]. http://www.fda.gov/ MedicalDevices/ProductsandMedicalProcedures/InVitroDiagnostics/ ucm301431.htm.
[13]Thomson Reuters. Medical Device Daily is a service of Thomson Reuters that provides business-focused intelligence on medical devices and is the fl agship publication of BioWorld’s med-tech group[EB/OL].(2014-12-30)[2015-05-18]. http://thomsonreuters.com/medical-devicedaily/.
[14]Haroche J, Cohen-Aubart F, Emile J F, et al. Dramatic efficacy of vemurafenib in both multisystemic and refractory Erdheim-Chester disease and Langerhans cell histiocytosis harboring the BRAF V600E mutation[J]. Blood, 2013, 121(9): 1495-1500.
[15]National Academy of Science. Information from “Exceptional Responders and the Implementation of Basket Trials” [EB/OL].(2015-05-10)[2015-05-18]. http://www.iom.edu/Activities/Disease/ NCPF/2013-FEB-11/Day percent201/Session percent204/17-Solit.aspx.
翻译:陈菁
Companion Diagnostic, a Booster of Individualized Treatment
Thomson Reuters
As an in vitro diagnostic technique, companion diagnostics can provide information about patients’response to specifi c therapy and help doctors to formulate more effective treatment, so as to improve treatment outcomes, reduce healthcare cost, and make individualized treatment for patients a reality. Research progress on companion diagnostics was introduced from the aspects of academic literature, invention patents, clinical data,as well as supervision and regulation, etc.
companion diagnostic; individualized treatment; targeted drug; biomarker

R446
A
1001-5094(2015)06-0463-15

