中药活性成分改善缺血缺氧所致脑微血管内皮屏障功能损伤的研究进展
陈红林,刘晗,叶心怡,寇俊萍*
(1. 中国药科大学江苏省中药评价与转化重点实验室,江苏 南京 211198;2. 中国药科大学中药复方研究室,江苏 南京 211198)
·前沿与进展·
中药活性成分改善缺血缺氧所致脑微血管内皮屏障功能损伤的研究进展
陈红林1,2,刘晗1,2,叶心怡1,2,寇俊萍1,2*
(1. 中国药科大学江苏省中药评价与转化重点实验室,江苏 南京 211198;2. 中国药科大学中药复方研究室,江苏 南京 211198)
缺血性脑卒中发生时,基质金属蛋白酶等效应分子以及炎症反应、氧化应激等会破坏血脑屏障,增加缺血区有害产物进入脑组织产生脑水肿,引起继发性脑损伤。所以,保护与维持脑微血管内皮屏障功能的完整性,是脑卒中防治的重要策略之一。从调节效应分和相关信号通路的角度出发,综述中药活性成分对模拟缺血性脑卒中的体内外脑微血管内皮屏障功能损伤模型的改善作用研究进展,期为进一步阐释中药活性成分防治缺血性脑卒中的作用机制以及新药创制提供参考和依据。
中药;活性成分;缺血缺氧;脑微血管内皮屏障;实验模型;效应分子;信号通路

缺血性脑卒中(ischemic stroke)是由血管狭窄或闭塞所致脑组织缺血缺氧、进而引起脑功能障碍甚至死亡的一种疾病,其病理机制复杂,目前仍缺乏有效的防治药物。研究表明,血脑屏障(blood brain barrier,BBB)在缺血性脑卒中的防治中起重要作用,它能阻止循环血液中有害物质进入脑组织,维持中枢神经系统稳态。当脑卒中发生时,脑组织缺血缺氧,三磷酸腺苷(ATP)耗竭,引起能量代谢障碍、离子平衡紊乱(钙超载)、氧化应激、炎症等一系列破坏性级联反应,导致BBB损害,大量有害物质进入脑组织,进一步加重脑卒中损伤[1-2]。脑微血管内皮细胞是BBB功能得以发挥的结构基础,其细胞间的紧密连接结构构成了BBB独有的解剖学特性[3],所以,改善脑缺血区微血管内皮细胞屏障功能,是防治缺血性脑卒中的重要策略之一[4]。大量研究显示,中药活性成分对脑微血管内皮屏障具有显著保护作用。本文拟从调节效应分子和相关信号通路的角度出发,综述中药活性成分对模拟缺血性脑卒中的体内外脑微血管内皮屏障功能损伤模型的改善作用研究进展,以期为进一步阐释中药活性成分防治缺血性脑卒中的作用机制以及新药创制提供参考和依据。
1 调节基质金属蛋白酶的活性及表达
基质金属蛋白酶(matrix metalloproteinases, MMP)在正常脑组织中的表达量较低,而脑缺血发生后,在炎症因子、自由基等因素刺激下,其大量表达和活化。MMP能降解细胞外基质和紧密连接蛋白,是破坏BBB的重要效应分子[5]。抑制MMP的活化和表达或者增加MMP组织抑制剂(tissue inhibitor of metalloproteinases,TIMP)的表达,均能有效减少BBB的破坏。生理状态下,小窝蛋白-1(caveolin-1)能够抑制内皮型一氧化氮合酶(eNOS)活化。在脑缺血及再灌注损伤发生时,一氧化氮(NO)累积,caveolin-1水平降低,导致MMP活性增强,同时又伴随着eNOS 活化,致使NO进一步累积,加重BBB破坏。提示,NO/ caveolin-1/MMP通路是MMP激活的重要途径[6-7]。
大量研究表明,中药活性成分可以通过抑制MMP的活性和表达来保护微血管内皮屏障功能。实验发现,大鼠大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)造模前15 min,给予腹腔注射黄芪活性成分毛蕊异黄酮葡萄糖苷(26.8 mg·kg-1),可明显增加缺血大脑皮层微血管中caveolin-1的表达,并清除过量的NO,对MMP-2和MMP-9的活化具有显著的抑制作用。提示,毛蕊异黄酮葡萄糖苷可经由NO/caveolin-1/ MMP通路来保护微血管内皮屏障的完整性[8]。而且,大鼠MCAO造模前15 min,给予腹腔注射黄芪中异黄酮类成分芒柄花素(30 mg·kg-1),也能降低脑组织中MMP-9的表达及活性,同时对诱导型一氧化氮合酶(iNOS)、肿瘤坏死因子-α(TNF-α)和白介素-1β(IL-1β)的 mRNA表达具有抑制作用[9]。人参皂苷Rg1不易透过BBB到达脑实质,但对MCAO大鼠神经损伤具有明显改善作用。实验研究发现,大鼠脑缺血前1 h及再灌注3 h时,尾静脉注射Rg1(45 mg·kg-1),能够显著减少大鼠脑组织中伊文思蓝(Evans Blue,EB)渗出。Rg1能够降低脑组织中MMP-2和MMP-9的活化和表达,并增加TIMP-2 mRNA水平,起到BBB保护作用。提示,Rg1可能通过保护BBB来减轻神经损害的发生[10]。此外,还有研究发现,白藜芦醇(50 mg·kg-1)可抑制MCAO大鼠脑组织中MMP-9活性,并提高TIMP-1的表达,从而保护BBB;而给予TIMP-1抗体后,白藜芦醇的BBB保护作用受到拮抗。提示,TIMP-1在白藜芦醇发挥BBB保护作用中扮演重要角色[11]。川芎中活性成分川芎嗪(20 mg·kg-1)在大鼠MCAO造模前15 min腹腔注射,能够减少大鼠脑组织中EB的渗出和MMP-9的表达,减轻BBB破坏程度[12];而川芎嗪(40 mg·kg-1)在造模后2 h腹腔给药,同样可以改善EB的渗出,且使紧密连接蛋白occludin的表达上调[13]。罗布麻叶提取物(500 mg·kg-1)以及小续命汤(15、30、60 g·kg-1)对MCAO大鼠BBB的保护作用均与抑制MMP-2和MMP-9的活性及表达有关,能够改善BBB超微结构,减少脑组织中EB渗出及脑含水量[14-15]。大鼠MCAO再灌注3 h后,脑组织中EB渗出增加,48 h达峰值,与MMP-9活性一致,而经清热化瘀Ⅱ号方预给药2周,则能下调MMP表达,从而减少EB渗出[16]。解毒通络注射液(2,4 mL·kg-1)可通过降低脑缺血再灌注模型大鼠脑组织中细胞间黏附分子1(ICAM-1)、血管细胞黏附分子1(VCAM-1)、E-选择素(E-selectin) 以及 MMP-9的表达,发挥脑血管内皮屏障保护作用[17]。
另有研究显示,在大鼠永久性大脑中动脉阻塞(pMCAO)造模后2和12 h时,腹腔注射黄芩苷(100 mg·kg-1),结果,24 h后,与模型组大鼠相比,给药组大鼠脑微血管内皮屏障通透性显著改善,occludin上调,MMP-9表达降低[18]。体外实验显示,人脑微血管内皮细胞(brain microvascular endothelial cells,BMVEC)氧糖剥夺6 h、再复氧24 h的模型中,白藜芦醇(50 μmol·L-1)预给药,能够减少活性氧簇(ROS)产生和氧化损伤,并显著降低MMP-2表达,保护内皮屏障功能[19]。在体外原代BMVEC模拟BBB缺血再灌注及白细胞活化损伤实验中,缺氧2 h后,于复氧期间,加入缺氧活化的白细胞条件培养液,结果,加重了屏障的破坏;而在缺氧前,加入丹参酮ⅡA(30 mg·L-1),则能改善内皮的通透性,同时丹参酮ⅡA还能减少白细胞中MMP-9、TNF-α、IL-1α、IL-2、干扰素γ(IFN-γ)和ROS的产生,且它的内皮屏障保护作用,不但能减轻白细胞的活化,还能抑制其活化产物对内皮的损伤效应[20]。
2 调节水通道蛋白4 的表达
水通道蛋白4(aquaporin 4, AQP4)主要负责脑实质间水的转运。脑缺血发生后,AQP4过量表达影响BBB的通透性,对缺血后脑组织水肿的形成起着关键作用。AQP4缺陷小鼠所形成的短暂性局部脑缺血模型,表现出脑水肿和梗死面积减少[21]。
小鼠灌胃枸杞提取物(1、10 mg·kg-1)7 d后进行MCAO实验,观察药物作用,结果发现,与模型组相比,给药组小鼠脑组织中EB和免疫球蛋白G(IgG)外渗显著减少,occludin表达上调,呈现出明显的脑微血管屏障保护效应;而且,给药组小鼠半影区血管内皮细胞中MMP-9和脑微血管周边星形胶质细胞终足上AQP4的表达均下调[22]。大鼠连续灌胃续命汤(1、2、3 g·kg-1)5 d后进行MCAO造模,并采用免疫组化法检测大鼠缺血脑组织中紧密连接蛋白ZO-1的表达分布,结果发现,续命汤能维持大鼠缺血脑组织中紧密连接复合体结构的完整性,减少ZO-1的损失,同时还能抑制AQP4 mRNA过度表达,减轻脑水肿,进而实现对BBB的保护[23]。还有研究表明,Rg1对MCAO损伤BBB的保护作用,也与降低AQP4表达有关,AQP4参与破坏BBB,其表达的变化与利用EB检测BBB渗漏时的变化一致[24]。此外,将大鼠双侧颈总动脉结扎2 h后,腹腔注射胡黄连苷Ⅱ(10 mg·kg-1),并在给药24 h后,用透射电镜观察脑缺血区超微结构,结果显示,与模型组相比,给药组大鼠神经细胞及内皮损伤明显减轻,脑含水量显著降低,同时AQP4 表达下调。提示,胡黄连苷Ⅱ通过调节AQP4 的表达,减轻脑缺血对BBB及神经细胞的损伤[25]。
3 调节核转录因子-κB/丝裂原活化蛋白激酶通路
脑缺血发生后,促炎应答迅速启动,促炎因子如TNF-α、IL-1β、ICAM-1、血小板活化因子和选择素的表达上调,促进白细胞粘附、迁移,BBB紧密连接遭到破坏,屏障打开。而核转录因子-κB(nuclea factor- κB,NF-κB)通路是调节免疫和炎症的重要途径,NF-κB的活化与BBB通透性的增加密切相关[26]。
高迁移率族蛋白B1(High mobility group protein HMGB1)在脑缺血损伤发生时由胞核内转移到胞质和胞外,它可活化晚期糖基化终产物受体(receptor fo advanced glycation end products, RAGE)和toll样受体(toll-like receptor 4, TLR4),进而激活NF-κB,促进炎症的发生。有研究报道,pMCAO大鼠腹腔注射丹参酮ⅡA(10、20 mg·kg-1)后,其脑组织中紧密连接蛋白claudin-5的表达增加, IgG外渗减少;而且,在脑缺血早期,HMGB1、RAGE、TLR4 和NF-κB被激活,且24 h达到峰值,高表达状态持续14 d(只是48和72 h时略有下调),而丹参酮ⅡA能降低HMGB1、RAGE、TLR4 和NF-κB的表达,从而保护脑微血管内皮屏障功能[27]。此外,另有研究显示,在大鼠pMCAO造模后,腹腔注射小白菊内酯(250、50 μg·kg-1),可显著降低脑含水量和梗死面积,上调claudin-5基因和蛋白水平,降低NF-κB和 p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinas p38 MAPK)的活化水平,从而改善BBB通透性[28];来自中药紫草中的紫草醌(10、25 mg·kg-1)可显著改善MCAO模型小鼠的内皮屏障功能,其脑保护机制主要与降低TLR4、p38 MAPK、NF-κB和TNF-α的表达有关[29]。
MAPK在调节炎症方面也发挥着重要作用。研究表明,p38 MAPK磷酸化能诱导脑梗死和脑水肿的发生,而在脑缺血再灌注动物模型中,给予p38抑制剂,能够显著减少BBB的破坏和脑水肿的形成[30]。丹酚酸B是中药丹参中的水溶性有效单体成分。免疫组化实验发现,在大鼠MCAO缺血再灌模型中,丹酚酸B(1、1 mg·kg-1)能够明显降低模型大鼠脑血管周围IgG的渗出抑制MMP-9和一氧化氮合酶2(nitric oxide synthase 2,NOS2)的表达,从而保护脑微血管内皮屏障功能。此外,丹酚酸B还能显著抑制MAPK信号通路中p38 和胞外调节蛋白激酶(Erk)的磷酸化,提示,其BBB保护作用可能与抑制 MAPK 信号通路有关[31]。
4 调节蛋白激酶B /糖原合成激酶3β通路
蛋白激酶B(Akt)和糖原合成激酶 3β(glycogen synthase kinase-3β, GSK3β)磷酸化后(即pAkt和pGSK3β),能促进cAMP反应元件结合蛋白 (cAMP response element binding protein, CREB)入核,抑制NF-κB p65入核,从而调节炎症反应,而pGSK3β去磷酸化后,则具有脑损害作用[32]。
实验研究显示,吴茱萸碱(50、100 mg·kg-1)预给药3 d后,可减轻pMCAO模型小鼠脑水肿,其作用途径是,通过上调pAkt和pGSK3β,减少p65入核量,增加claudin-5的表达,从而减轻BBB的损害[33];pMCAO大鼠造模后,腹腔注射小檗碱(10、40 mg·kg-1),24 h后,与模型组相比,给药组大鼠脑含水量显著降低,claudin-5基因及蛋白水平均上调,而且,小檗碱可致大鼠脑组织中pAkt、pGSK3β和pCREB的表达上调以及核内p65下调,从而保护脑微血管内皮屏障[34]。
5 调节核转录因子E2相关因子2/血红素氧合酶1通路
核转录因子E2相关因子2(NF-E2-related factor 2,Nrf2)是调控氧化应激的关键因子,而pAkt 能使Nrf2转位入核,调控抗氧化酶如血红素氧合酶1(HO-1)和超氧化物歧化酶(SOD)的表达,防止细胞受自由基损伤,是对抗氧化损伤的重要保护机制[35]。
丹皮酚是牡丹皮中的有效成分之一,具有抗炎清除自由基等功效。实验发现,丹皮酚(30、60 mg·kg-1)连续给小鼠灌胃3 d,第4 d pMCAO造模前30 min再给药1次,结果,模型小鼠脑水肿减轻,脑组织中claudin-5表达上调,梗死面积减少,达到BBB保护功效。丹皮酚的这一作用机制可能是,减少氧化损伤,降低丙二醛(MDA)水平,上调pAkt、Nrf2、HO-1以及SOD的表达[35]。另有研究显示,小鼠双侧颈总动脉结扎前和再灌注时,分别腹腔注射蛇床子素(25、50、100 mg·kg-1),结果,再灌注后4和24 h时,小鼠脑组织中EB外渗显著减少,从而保护了BBB功能。蛇床子素这一作用的主要机制是,降低氧化损伤,增加Nrf2和HO-1的表达[36]。此外,在大鼠原代BMVEC氧糖剥夺24 h模型实验中发现,姜黄素(20 μmol·L-1)能使细胞中抗氧化蛋白HO-1的表达显著增加,跨膜电阻(TEER)值升高,辣根过氧化物酶(Horseradish Peroxidase, HRP)透过率降低,氧糖剥夺所致细胞间紧密连接及屏障功能的破坏减少[37]。
6 调节蛋白激酶C /肌球蛋白轻链激酶通路
蛋白激酶C(protein kinase C,PKC)属于丝氨酸/苏氨酸激酶家族,缺氧条件下能够分解紧密连接蛋白。此外,PKC能激活肌球蛋白轻链激酶(myosin light chain kinase,MLCK),导致肌球蛋白轻链(MLC)磷酸化,触发细胞骨架收缩或重排,从而影响内皮细胞通透性;它还能通过激活胞内的信号级联放大系统,调控BBB通透性[38]。
黄芩苷是黄芩中分离得到的黄酮类活性成分,广泛用于脑水肿和脑缺血的治疗。研究显示,小鼠原代BMVEC氧糖剥夺24 h后,细胞TEER降低,HRP渗透率显著增加,而黄芩苷(5、10、20 g·mL-1)则能使内皮细胞中PKC水平显著降低,ZO-1和claudin-5的基因及蛋白水平上调,减少了微血管内皮细胞间紧密连接蛋白可能的降解和重排,最终有效保护脑微血管内皮屏障功能[39]。清开灵注射液具有醒神开窍的功效,是一种可保护缺血脑组织且疗效确切的中药制剂。体外脑微血管内皮细胞模拟脑缺血模型实验显示,低、中、高各浓度(0.25%、0.5%、1%)清开灵注射液均能使细胞中claudin-5基因和蛋白的表达增加;而且,清开灵对内皮细胞模型中ZO-1蛋白的干预作用更强,可致ZO-1蛋白表达水平甚至高于正常组细胞[40-41]。同样在体外模型中,清开灵4%浓度组细胞中MLCK的表达降低,提示,清开灵可能通过调控 MLCK表达水平,改善脑微血管内皮细胞间紧密连接蛋白的表达,对微血管内皮屏障起保护作用[42]。
7 其他
大鼠MCAO模型实验显示,羟基红花黄色素A(HSYA ,1、5、10 mg·kg-1)能降低模型大鼠脑含水量,减少脑组织中EB及IgG的渗出,对BBB具有保护作用;而且,HSYA能剂量依赖性地抑制缺血区脑组织蛋白的氧化和硝化作用,降低12/15-脂氧合酶(12/15-LOX)的表达[43];此外,大鼠MCAO造模前,连续3 d灌胃给予当归多糖(50、100、200 mg·kg-1),结果,与模型组相比,给药组大鼠脑缺血侧EB渗出量显著减少,脑组织中ZO-1和claudin-5的表达上调[44];大鼠MCAO再灌注时,腹腔注射天麻素(5、10、20 mg·kg-1),能够降低脑组织中EB透过率,下调梗死半暗带皮层组织中炎症因子TNF-α、IL-1β和IL-6的表达,呈现脑微血管内皮屏障保护效应[45]。另有研究显示,大鼠脑缺血再灌注时,尾静脉注射脉络宁(1、2、4 mL·kg-1),可上调脑组织中ZO-1和occludin的表达,从而保护BBB紧密连接结构,抑制BBB对EB的高通透性[46]。
小鼠MCAO模型实验显示,通心络(1 g·kg-1)预给药7 d,能减少模型小鼠脑梗死面积、脑水肿以及EB和IgG的渗出,同时上调脑组织中ZO-1和occludin的表达;而与仅预给药7 d相比,造模后继续给药14 d,则致使模型小鼠脑梗死面积更小、BBB损伤更轻以及脑组织中细胞因子IL-6、IL-1β和TNF-α的表达更少[47]。
还有研究显示,体外原代培养的大鼠BMVEC在平衡盐溶液中缺氧10 h后,异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-葡聚糖透过率显著增加,ZO-1的基因和蛋白表达水平均下调,而经千叶素A(10 μmol·L-1)处理后,缺氧损伤的BBB通透性显著改善[48]。
8 结语与展望
缺血性脑卒中的防治一直是医学研究的难点与热点,其主要病因是血管病变造成的脑血流阻塞。脑缺血发生后,微血管内皮屏障遭破坏,导致血管源性脑水肿,进而增加缺血区有害产物进入脑实质,损伤神经组织。因此,保护脑微血管内皮屏障,是临床上有效防治缺血性脑卒中的重要途径之一。
综上所述,中药活性成分对脑微血管内皮屏障的保护作用,主要是通过降低破坏BBB的效应分子MM和AQP4的表达、抑制炎症反应信号通路(NF-κB MAPK和Akt/GSK3β)、增强抗氧化信号通路(Nr HO-1)以及阻抑诱导细胞骨架收缩和紧密连接蛋白降解与重排的信号通路(PKC/MLCK)来实现(见图1)。各中药活性成分对脑微血管内皮屏障保护作用研究的实验模型、评价指标及作用途径经分析归纳见表1。
由表1可见,具有脑微血管内皮屏障功能调节活性的中药有效成分中,报道最多的要数黄酮类和酚类化合物,其中,黄酮类成分作用途径广泛,其微血管内皮屏障保护作用涉及抗炎、抗氧化及紧密连接蛋白重排等多个环节,而酚类成分则以发挥抗氧化效应为主;另外以丹参为代表的活血化瘀类中药和以黄芩为代表的清热类中药中的活性成分对微血管内皮屏障保护作用研究报道得最多,而一些清热活血类复方制剂对微血管内皮屏障也具有显著的改善作用。现代药理学研究表明,活血类中药能够改善血流及微循环,而清热类中药则具有较好的抗急性炎症作用。提示,这两大类中药中可能存在更多具有改善缺血性脑损伤的天然活性成分有待进一步发现。
目前,中药活性成分对脑微血管内皮屏障功能的保护作用研究中,大多采用整体动物模型,体现了中药的整体效应,但体外模型多采用单一微血管内皮细胞模型,而随着近年来共培养技术的出现以及三维立体细胞培养的发展,越来越多地体现出体外BBB的整体性[49],将为进一步探讨中药活性成分保护脑微血管内皮细胞屏障功能的分子机制提供技术支持。在分子机制层面探讨中药活性成分脑微血管内皮屏障保护作用方面,现多数以检测信号分子表达及磷酸化为多,尚缺乏抑制剂联用、RNA干扰技术等的反证,机制阐释还不够深入。中药活性成分可多途径调节并维持脑微血管内皮屏障功能,发挥抗缺血性脑损伤的作用,但是否通过作用于特定的功能蛋白发挥作用,有待于进一步考察和鉴定。从活性突出、结构新颖的中药有效成分着手,研究及发现其作用靶标,为缺血性脑卒中的防治提供可能的新途径,进而开发出活性先导化合物,值得关注与探讨。
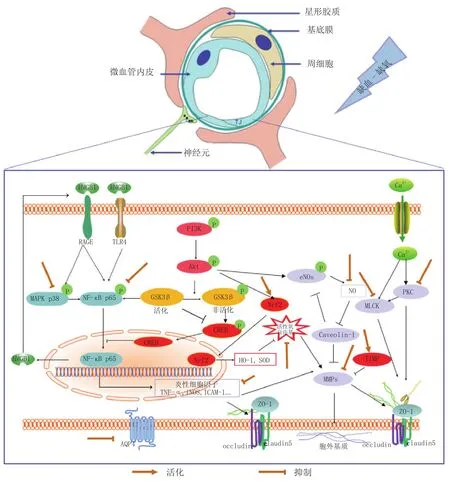
图1 中药活性成分改善缺血缺氧所致脑微血管内皮屏障功能损伤的信号通路Figure1 Signaling pathways involved in the improvement of hypoxia/ischemia-injured cerebral microvascular endothelial barrier function by active components in traditional Chinese medicines

表1 中药活性成分对脑微血管内皮屏障功能的保护作用实验研究一览Table 1 A summary of experimental studies on the protection of cerebral microvascular endothelial barrier function by active components in traditional Chinese medicines

续表1

续表1
[1]Sandoval K E, Witt K A. Blood-brain barrier tight junction permeability and ischemic stroke[J]. Neurobiol Dis, 2008, 32(2): 200-219.
[2]Schoknecht K, David Y, Heinemann U. The blood-brain barriergatekeeper to neuronal homeostasis: clinical implications in the setting of stroke[J]. Semin Cell Dev Biol, 2015, 38: 35-42.
[3]Liu W Y, Wang Z B, Zhang L C, et al. Tight junction in blood-brain barrier: an overview of structure, regulation, and regulator substances[J]. CNS Neurosci Ther, 2012, 18(8): 609-615.
[4]Gursoy-Ozdemir Y, Yemisci M, Dalkara T. Microvascular protection is essential for successful neuroprotection in stroke[J]. J Neurochem, 2012,123(s2): 2-11.
[5]Lakhan S E, Kirchgessner A, Tepper D, et al. Matrix metalloproteinases and blood-brain barrier disruption in acute ischemic stroke[J]. Front Neurol, 2013, 4: 32.
[6]Zhao Y L, Song J N, Zhang M. Role of caveolin-1 in the biology of the blood-brain barrier[J]. Rev Neurosci, 2014, 25(2): 247-254.
[7]Gu Y, Zheng G, Xu M, et al. Caveolin-1 regulates nitric oxide-mediated matrix metalloproteinases activity and blood-brain barrier permeability in focal cerebral ischemia and reperfusion injury[J]. J Neurochem, 2012,120(1): 147-156.
[8]Fu S, Gu Y, Jiang J Q, et al. Calycosin-7-O-β-d-glucoside regulates nitric oxide/caveolin-1/matrix metalloproteinases pathway and protects blood-brain barrier integrity in experimental cerebral ischemiareperfusion injury[J]. J Ethnopharmacol, 2014, 155(1): 692-701.
[9]顾民华, 洪文, 唐传其, 等. 芒柄花素保护前脑缺血再灌注损伤中的血脑屏障并抑制神经炎症[J]. 暨南大学学报: 自然科学与医学版,2015, 36(1): 34-39.
[10]Wang R, Wang G J, Wu X L, et al. Ginsenoside Rg1 attenuates structural disruption of the blood-brain barrier to protect the central nervous system in ischemia/reperfusion[J]. Chin J Nat Med, 2013, 11(1): 30-37.
[11]Wei H, Wang S, Zhen L, et al. Resveratrol attenuates the blood-brain barrier dysfunction by regulation of the MMP-9/TIMP-1 balance after cerebral ischemia reperfusion in rats[J]. J Mol Neurosci, 2015, 55(4): 872-879.
[12]Tan F, Fu W, Cheng N, et al. Ligustrazine reduces blood-brain barrier permeability in a rat model of focal cerebral ischemia and reperfusion[J]. Exp Ther Med, 2015, 9(5): 1757-1762.
[13]李玉芳, 刘坤, 杨智航, 等. 川芎嗪对大鼠脑缺血再灌注后occludin表达影响[J]. 中国公共卫生, 2013, 29(11): 1635-1637.
[14]Xiang J, Lan R, Tang Y P, et al. Apocynum venetum leaf extract attenuates disruption of the blood-brain barrier and upregulation of matrix metalloproteinase-9/-2 in a rat model of cerebral ischemiareperfusion injury[J]. Neurochem Res, 2012, 37(8): 1820-1828.
[15]Lan R, Xiang J, Wang G H, et al. Xiao-Xu-Ming decoction protects against blood-brain barrier disruption and neurological injury induced by cerebral ischemia and reperfusion in rats[J]. Evid Based Complement Alternat Med, 2013, 2013: 629782.
[16]祝美珍, 苏春寿, 吴志敏, 等. 清热化瘀Ⅱ号方对大鼠脑缺血再灌注损伤MMP-2及MMP-9表达的影响[J]. 中华中医药杂志, 2014,29(2): 582-585.
[17]武丽斐, 邢月, 关亚兰, 等. 解毒通络注射液对缺血再灌注大鼠脑水肿的防治作用[J]. 中国中药杂志, 2014, 39(6): 1088-1092.
[18]Tu X, Yang W, Liang R, et al. Effect of baicalin on matrix metalloproteinase-9 expression and blood-brain barrier permeability following focal cerebral ischemia in rats[J]. Neurochem Res, 2011,36(11): 2022-2028.
[19]Cavdar Z, Egrilmez M Y, Altun Z S, et al. Resveratrol reduces matrix metalloproteinase-2 activity induced by oxygen-glucose deprivation and reoxygenation in human cerebral microvascular endothelial cells[J]. Int J Vitam Nutr Res, 2012, 82(4): 267-274.
[20]Zhang W, Feng J, Zhou R, et al. Tanshinone IIA protects the human blood-brain barrier model from leukocyte-associated hypoxiareoxygenation injury[J]. Eur J Pharmacol, 2010, 648(1): 146-152.
[21]Yao X, Derugin N, Manley G T, et al. Reduced brain edema and infarct volume in aquaporin-4 deficient mice after transient focal cerebral ischemia[J]. Neurosci Lett, 2015, 584: 368-372.
[22]Yang D, Li S Y, Yeung C M, et al. Lycium barbarum extracts protect the brain from blood-brain barrier disruption and cerebral edema in experimental stroke[J]. PLoS One, 2012, 7(3): e33596.
[23]周天梅, 佟丽妍, 徐焕凤. 续命汤对局灶性脑缺血中风大鼠紧密连接相关蛋白(ZO-1)和水通道蛋白4(AQP4) mRNA 表达的影响[J].
中华中医药学刊, 2014, 32(8): 1983-1986.
[24]Zhou Y, Li H, Lu L, et al. Ginsenoside Rg1 provides neuroprotection against blood brain barrier disruption and neurological injury in a rat model of cerebral ischemia/reperfusion through downregulation of aquaporin 4 expression[J]. Phytomedicine, 2014, 21(7): 998-1003.
[25]敬乃鲁, 李晓丹, 赵丽, 等. 胡黄连苷 Ⅱ 对大鼠脑缺血损伤水通道蛋白4表达的影响[J]. 中国临床神经科学, 2013, 21(6): 631-636.
[26]Hoffman W H, Stamatovic S M, Andjelkovic A V. Inflammatory mediators and blood brain barrier disruption in fatal brain edema of diabetic ketoacidosis[J]. Brain Res, 2009, 1254: 138-148.
[27]Wang L, Zhang X, Liu L, et al. Tanshinone II A down-regulates HMGB1,RAGE, TLR4, NF-κB expression, ameliorates BBB permeability and endothelial cell function, and protects rat brains against focal ischemia[J]. Brain Res, 2010, 1321: 143-151.
[28]Dong L, Qiao H, Zhang X, et al. Parthenolide is neuroprotective in rat experimental stroke model: downregulating NF-κB, phosph p38MAPK, and caspase-1 and ameliorating BBB permeability[J Mediators Infl amm, 2013, 2013: 370804.
[29]Wang L, Li Z, Zhang X, et al. Protective effect of shikonin i experimental ischemic stroke: attenuated TLR4, p-p38MAPK, N κB, TNF-α and MMP-9 expression, up-regulated claudin-5 expressio ameliorated BBB permeability[J]. Neurochem Res, 2014, 39(1): 97-106
[30]Nito C, Kamada H, Endo H, et al. Role of the p38 mitogen-activate protein kinase/cytosolic phospholipase A2 signaling pathway in blood brain barrier disruption after focal cerebral ischemia and reperfusion[J J Cereb Blood Flow Metab, 2008, 28(10): 1686-1696.
[31]李琴, 韩力培, 李泽慧, 等. 丹酚酸 B 通过抑制 MAPK 通路减轻鼠脑缺血再灌注引起的血脑屏障损伤[J]. 药学学报, 2010, 45(12 1485-1490.
[32]Kelly S, Zhao H, Sun G H, et al. Glycogen synthase kinase 3β inhibit Chir025 reduces neuronal death resulting from oxygen-glucos deprivation, glutamate excitotoxicity, and cerebral ischemia[J]. Ex Neurol, 2004, 188(2): 378-386.
[33]Zhao T, Zhang X, Zhao Y, et al. Pretreatment by evodiamine is ne roprotective in cerebral ischemia: up-regulated pAkt, pGSK3β, dow regulated NF-κB expression, and ameliorated BBB permeability[J Neurochem Res, 2014, 39(8): 1612-1620.
[34]Zhang X, Zhang X, Wang C, et al. Neuroprotection of early and shor time applying berberine in the acute phase of cerebral ischemia: u regulated pAkt, pGSK and pCREB, down-regulated NF-κB expressio ameliorated BBB permeability[J]. Brain Res, 2012, 1459: 61-70.
[35]Zhao Y, Fu B, Zhang X, et al. Paeonol pretreatment attenuates cerebr ischemic injury via upregulating expression of pAkt, Nrf2, HO-1 an ameliorating BBB permeability in mice[J]. Brain Res Bull, 2014, 10 61-67.
[36]Chen Z W, Mao X X, Liu A M, et al. Osthole, a natural coumari improves cognitive impairments and BBB dysfunction after transie global brain ischemia in C57 BL/6J mice: involvement of Nrf pathway[J]. Neurochem Res, 2015, 40(1): 186-194.
[37]Wang Y, Gu Y, Qin G, et al. Curcumin ameliorates the permeabilit of the blood-brain barrier during hypoxia by upregulating hem oxygenase-1 expression in brain microvascular endothelial cells[J]. Mol Neurosci, 2013, 51(2): 344-351.
[38]Rigor R R, Shen Q, Pivetti C D, et al. Myosin light chain kinase signaling in endothelial barrier dysfunction[J]. Med Res Rev, 2013,33(5): 911-933.
[39]Zhu H, Wang Z, Xing Y, et al. Baicalin reduces the permeability of the blood-brain barrier during hypoxia in vitro by increasing the expression of tight junction proteins in brain microvascular endothelial cells[J]. J Ethnopharmacol, 2012, 141(2): 714-720.
[40]朱海燕, 马涛, 娄利霞, 等. 清开灵对缺氧体外血脑屏障紧密连接蛋白ZO-1表达的影响[J]. 中西医结合心脑血管病杂志, 2011, 9(7): 846-848.
[41]高永红, 朱海燕, 娄利霞, 等. 清开灵注射液对小鼠脑微血管内皮细胞缺氧模型紧密连接蛋白claudin-5的影响[J]. 中西医结合心脑血管病杂志, 2014, 12(11): 1363-1365.
[42]玛娜璐璐, 朱海燕, 高永红, 等. 清开灵对小鼠脑微血管内皮细胞缺氧损伤MLCK基因转录的影响[J]. 中华中医药学刊, 2015, 33(2): 327-329.
[43]Sun L, Yang L, Xu Y W, et al. Neuroprotection of hydroxysafflor yellow A in the transient focal ischemia: inhibition of protein oxidation/ nitration, 12/15-lipoxygenase and blood-brain barrier disruption[J]. Brain Res, 2012, 1473: 227-235.
[44]夏旺旭, 徐露. 当归多糖对脑梗死大鼠血脑屏障通透性影响及MRI评价[J]. 遵义医学院学报, 2014, 37(6): 601-604.
[45]李文君, 徐振田, 索大琴, 等. 天麻素对大鼠局灶性脑缺血损伤的保护作用研究[J]. 中国生化药物杂志, 2014, 3(5): 40-43.
[46]庞晓斌, 谢欣梅, 王保全, 等. 脉络宁对脑缺血再灌注大鼠血脑屏障通透性的影响研究[J]. 中成药, 2014, 36(7): 1347-1350.
[47]Liu Y, Tang G H, Sun Y H, et al. The protective role of Tongxinluo on blood-brain barrier after ischemia-reperfusion brain injury[J]. J Ethnopharmacol, 2013, 148(2): 632-639.
[48]郭虹, 史芳, 王少峡, 等. 千叶素 A 对缺氧损伤下血脑屏障通透性的影响及其机制研究[J]. 中草药, 2013, 44(16): 2278-2281.
[49]Naik P, Cucullo L. In vitro blood-brain barrier models: current and perspective technologies[J]. J Pharm Sci, 2012, 101(4): 1337-1354.
Research Advances in the Improvement of Hypoxia/ Ischemia-Injured Cerebral Microvascular Endothelial Barrier Function by Active Components in Traditional Chinese Medicines
CHEN Honglin1,2, LIU Han1,2, YE Xinyi1,2, KOU Junping1,2
(1. Jiangsu Key Laboratory of Traditional Chinese Medicine Evaluation and Translational Research, China Pharmaceutical University, Nanjing 211198, China; 2. Department of Complex Prescription of Traditional Chinese Medicine, China Pharmaceutical University, Nanjing 211198, China)
The effector molecules such as matrix metalloproteinases, infl ammation and oxidative stress breakdown blood-brain barrier, resulting in the increase of the harmful products entering brain tissue, cerebral edema and secondary brain damage, during ischemic stroke. Therefore, protecting the integrity of the cerebral microvascular endothelial barrier is one of the important strategies for the prevention and management of stroke. In this article, the research progress on the improvement of in vivo and in vitro models of cerebral microvascular endothelial barrier function damage similar to ischemic stroke by active components in traditional Chinese medicines was reviewed from the perspectives of the effector molecules and related signaling pathways, in order to provide some
for further interpretation of the acting mechanisms of active components in traditional Chinese medicines in preventing and treating ischemic stroke and innovation of new drugs.
traditional Chinese medicine; active component; hypoxia/ischemia; cerebral microvascular endothelial barrier; experimental model; effector molecule; signaling pathway
R285.5; R743.3
A
1001-5094(2015)06-0415-10
接受日期:2015-05-10
项目资助:国家自然科学基金项目(No.81274004);江苏省高校优势学科建设项目
*通讯作者:寇俊萍,教授,博士生导师;
研究方向:中药药效物质基础与作用机制研究;
Tel:025-86185158; E-mail:junpingkou@cpu.edu.cn

