表面增强拉曼散射光谱定量分析技术的研究进展
左奇 陈瑶 石彩霞 陈增萍

摘 要 表面增强拉曼散射(SERS)光谱具有灵敏度高、光谱特征强、受光漂白影响小等特点,在环境、食品和药品、以及生物分析等领域有着广阔的应用前景。目前,SERS光谱技术仅属于定性或半定量分析技术,尚未发展成为一项成熟的定量分析检测技术。本文综述了现有文献中用于提高SERS定量结果准确度的方法以及它们的优缺点,并在此基础上展望了SERS技术在复杂体系中定量分析的发展方向。
关键词 表面增强拉曼散射光谱; 乘子效应模型; 定量分析; 评述
1 引 言
拉曼光谱可用于包括固体、液体、气体等样品的分析和检测。但拉曼散射信号非常弱(比荧光光谱平均低2个数量级),使用拉曼光谱难以对低浓度的待分析物进行检测,从而大大地限制了拉曼光谱的应用范围。1974年,Fleischman等[1]首次获得修饰在粗糙的银电极表面上单分子层吡啶分子的高质量拉曼光谱信号,从而发现了表面增强拉曼散射(Surface enhanced Raman scattering,SERS)效应。近几十年来,随着纳米技术的发展,基于金或银纳米颗粒的SERS技术将拉曼光谱检测灵敏度提高了数百万倍[2~5]。SERS光谱技术很好地克服了传统拉曼光谱灵敏度低的缺陷,具有光谱特征强、受光漂白影响小、检测灵敏度高等优点,其应用领域得到了很大的拓展。SERS光谱技术作为一种分析检测技术,被广泛应用于吸附催化反应[6]、环境分析[7~11]、食品安全[12~14]、生物医药分析[15~20]等领域。
SERS技术的核心在于SERS增强基底[21~25]。SERS信号的获得依赖于纳米级粗糙的金属基底(如银或金纳米颗粒),因而样本SERS信号的绝对强度不但取决于样本中待测物质的浓度,而且与SERS增强基底的物理性质(如:银或金纳米颗粒的形状、大小、聚集度等)以及激光光源功率和聚焦位置有关。而作为SERS增强基底主要组成的银和金纳米颗粒的重现性和稳定性均较差,严重影响了SERS信号的可靠性和重现性,使得SERS光谱定量分析结果的准确度远远达不到实际分析的要求。目前,从事SERS光谱技术研究的科学工作者主要通过改良SERS增强基底的制作工艺、采用内标法、以及使用多元数据分析方法提高SERS光谱定量分析结果的准确度。本文的主要目的是:归纳总结现有SERS光谱定量分析技术的优缺点及其在环境、食品、生物领域的应用现状,展望其发展趋势,为SERS光谱定量分析技术的进一步发展提供借鉴。
2 现有SERS光谱定量分析方法
SERS光谱的灵敏度高,检测速度快,尤其是在单分子检测方向有着独特的优势。但是由于SERS光谱信号的稳定性和重现性较差,制约了其在定量分析领域中的应用。目前人们主要采用如下几种方法提高SERS定量分析结果的准确度。
2.1 提高SERS增强基底的均一性、稳定性和重现性
自从SERS现象发现以来,各种SERS增强基底的开发研究就从未停止过。通过优化SERS增强基底,获得优质的SERS光谱信号,从而实现准确SERS定量分析,研究者在此阶段走过了一条漫长的道路。理想情况下的SERS增强基底应该具有很高的SERS增强效果、表面规则均一、稳定性高、重现性好、洁净且无复杂背景[26]。早期的SERS增强基底是通过电化学氧化还原循环法(EC-ORC)[1,27,28]或真空沉积法制备的[29~31]。这两种方法形成的SERS增强基底虽然具有较好的SERS增强效果,但是很难达到表面规整均一,在不同的区域SERS增强效果相差非常大,且用这两种方法制备SERS增强基底需要特殊的设备仪器,其适用性较窄。随后发展起来的贵金属纳米溶胶在一定程度上实现了SERS增强效果相对均一的目标。研究发现:通过调整还原剂摩尔比可以控制球状贵金属纳米颗粒如Au、Ag等纳米粒子的尺寸[23,24,32]。在此基础上,Jana等[33]通过调整表面活性剂和金离子的量首次制备出了金纳米棒。Nikoobakht等[34]改进方案后使金纳米棒制备的重现性和产率得到极大的提升,使得金纳米棒开始得到较广泛的应用。此外,三角形、立方形、星形等各种非球形纳米颗粒,以及Au@SiO2、Fe3O4@Au等各种类型的复合粒子的制备和应用研究也得到迅速发展[35~39]。贵金属纳米溶胶的制备简单,成本低廉,颗粒形貌可控,聚集状态下具有很高的SERS增强效果,这些特点使得贵金属纳米溶胶得到了快速的发展,是目前主要的商品化SERS增强基底。但是在制备贵金属纳米溶胶的过程中不可避免的需要添加表面活性剂等物质,这对被测物质在SERS增强基底上的吸附有着极大的影响,这种影响通常是难以预测的。而且不同批次制备的纳米溶胶之间的SERS增强效果通常存在显著的差异。此外,纳米溶胶在聚集的状态下才具有很高的SERS增强效果,但是在拉曼光谱激光光源所照射的微小范围内的纳米溶胶的聚集度是相当随机的。因此,即使在使用同一批次制备的纳米溶胶SERS增强基底的情况下,不同次实验所获得SERS增强效果可能不一致。以上因素限制了贵金属纳米溶胶作为SERS增强基底在SERS光谱定量分析中的广泛应用。
Freeman等[40]率先提出了一种在固体表面修饰双官能团分子制备SERS增强基底的方法。该双官能团分子的一端在固体表面形成自组装的致密膜,另一端与金纳米颗粒通过吸附或者化学键的方式将金纳米颗粒固定在固体表面。利用这种自组装方式可以在固体表面形成单层甚至多层纳米颗粒结构[41,42]。针对不同的基底选择不同的偶联剂可以在实验室获得面积较大、SERS光谱信号相对均匀的增强基底。但是这种SERS增强基底的制备相对比较费时,且不同批次制备的SERS增强基底的增强效果很难保持一致,这在一定程度上也限制了其在SERS光谱定量分析领域的应用。
Langmuir-Blodgett(LB)膜法是另一种可以在固相基底上形成大面积的有序纳米膜的方式。该方法是将憎水基团修饰的纳米粒子分散在与水不互溶的易挥发溶剂中,通过不断加大表面压力,溶剂挥发后可以在气液界面上形成纳米粒子的有序膜[43~45]。在目前所有基于自组装方式获得SERS增强基底中,利用LB膜法所获得的SERS增强基底的增强效果的均一性最好。但是,利用LB膜法制备SERS增强基底需要在纳米粒子上修饰憎水基团,这在一定程度上会影响到SERS增强基底的增强效果,且可能对待测分析物质的SERS光谱信号造成影响。endprint
为了使所获得的SERS增强基底具有相对较均一的增强效果,人们将多孔阳极氧化铝模板法(AAO)和纳米光刻技术用于制备SERS活性基底的惰性衬底。AAO模板法利用多孔阳极氧化铝存在着与其表面垂直的纳米级孔道这一特性,在孔道中沉积金属,最后溶解氧化铝,从而得到高度有序的纳米阵列[46,47]。纳米光刻技术则是利用高能粒子在固体表面直接刻蚀出高度有序的纳米结构,再通过沉积纳米颗粒等方式获得SERS增强基底[48,49]。这两种方法制备出来的纳米棒阵列或者纳米孔阵列排布均匀整齐,是非常理想的SERS增强基底之一。但是,这两种方法的操作步骤繁复,且所需仪器昂贵,限制了其大规模应用。
2.2 普通内标法消除干扰因素变化的影响
为了实现待测物质的准确SERS光谱定量分析,除了采取各种措施来提高SERS增强基底的均一性、稳定性和重现性之外,人们还常采用普通内标法提高SERS光谱定量分析结果的准确度。普通内标法是通过计算待测物质与内标物的SERS峰面积或峰高的比值消除SERS增强基底的物理性质以及激光光源功率和聚焦位置等干扰因素的变化对SERS光谱定量分析结果准确度的影响。常用的内标法主要有3种方式:(1)采用溶剂或增强基底的SERS信号作为内标[50~52]。显然,这种方式要求溶剂或者基底本身具有特征SERS信号;(2)在待测样本中加入与待测物质结构类似的物质(如同位素取代物)作为内标[53,54];(3)在SERS增强基底的表面修饰内标分子或在其内部嵌入内标分子[55,56]。不论采用上述何种方式,所用内标必须具有与待测样本中所有组分的SERS峰均不重叠的特征SERS峰,且待测样本的SERS信号中不能包含有显著的背景干扰。内标法在一定程度上可以消除SERS增强基底物理性质以及仪器设备对SERS光谱定量分析结果准确度的影响。然而,对不同待测物质进行SERS光谱定量分析通常需要选择不同的内标物质。对于复杂待测体系来说,常常难以找到合适的内标物质,这在很大程度上限制了普通内标法的广泛应用。
2.3 多元数据分析方法提高SERS光谱定量分析结果的准确度
传统的SERS光谱定量分析方法一般是利用待测物质的SERS光谱信号中最强峰的峰高或峰面积来进行定量分析的。待测样本中的共存干扰物质通常会严重影响这种单变量分析方法的定量分析结果。采用多元数据分析方法,例如偏最小二乘回归法(Partial least-squares)、人工神经网络(Artificial neural networks)和支持向量回归法(Support vector regression)等,对待测样本的整条SERS光谱进行分析,充分利用整条SERS光谱所携带的全部信息,能够在一定程度上提高SERS光谱定量分析结果的精确度[57,58]。但是这些多元数据分析方法并未明确阐明SERS增强基底物理性质变化与待测物质SERS光谱信号强度之间的定量关系,因而不能有效消除SERS增强基底之间的物理性质差异对SERS定量分析结果的影响,其定量分析结果的准确度尚不能满足实际样品分析的要求。
2.4 SERS光谱乘子效应模型实现准确SERS光谱定量分析
表面增强拉曼光谱的乘子效应模型(Multiplicative effects model for surface-enhanced Raman spectroscopy,MEMSERS)[59,60]首次明确阐明了共存干扰物质,SERS增强基底物理性质、仪器的光学特性、以及激光光源功率和聚焦位置等干扰因素的变化对待测物质SERS光谱信号强度(xk, k=1,2, …,K)的影响。
xk=Kj=1bk·ck,j·rchem, j+dk (k=1,2, …,K)(1)
其中,ck,j表示第j个化学组分在第k个样本中的浓度; rchem, j 表示第j个化学组分分子的拉曼散射性质; bk表示SERS增强基底物理性质、仪器的整体响应特性以及光源聚焦位置变化对第k个样本SERS信号的乘子效应影响部分;dk表示背景干扰以及SERS增强基底物理性质变化对第k个样本SERS信号的非乘子效应影响部分。从式(1)可知,由于乘子效应的存在,使得待测样本的SERS信号xk与待测物质浓度ck,j之间不服从简单的线性关系。这正是多元线性数据分析方法(如偏最小二乘回归法)不能有效消除SERS增强基底的物理性质,以及激光光源的功率和聚焦位置的变化对SERS光谱定量分析结果的不利影响的根本原因。
为了利用MEMSERS模型实现准确SERS光谱定量分析,必须先将校正样本的乘子效应参数(bk, k=1,2,…,K)估计出来。光程估计与纠正(Optical path length estimation and correction,OPLEC)及其改进方法[61~63]的出现正好解决了SERS增强基底物理性质以及激光光源功率和聚焦位置变化对校正样本SERS信号的乘子效应(bk)的估计问题。在获得所有校正样本的乘子效应向量b(b=)后,则可以建立如下两个校正模型:
b=α11+Xcalβ1(2)
diag(cj)·b=α21+Xcalβ2(3)
其中,Xcal=; cj(cj=)为第j个待测物质的浓度矢量;对角矩阵diag(cj)的对角线元素为cj中的对应元素; 1是一列向量,其元素均为1。模型参数α1,α2,β1和 β2可通过常用的偏最小二乘回归法求解出来。对于未知待测样本,一旦获得其SERS光谱信号xtest后,则SERS增强基底物理性质以及激光光源功率和聚焦位置的变化对未知待测样本SERS光谱信号的乘子效应可以通过两个校正模型预测值的比值予以消除,从而准确预测出未知待测样本中待测组分的浓度。
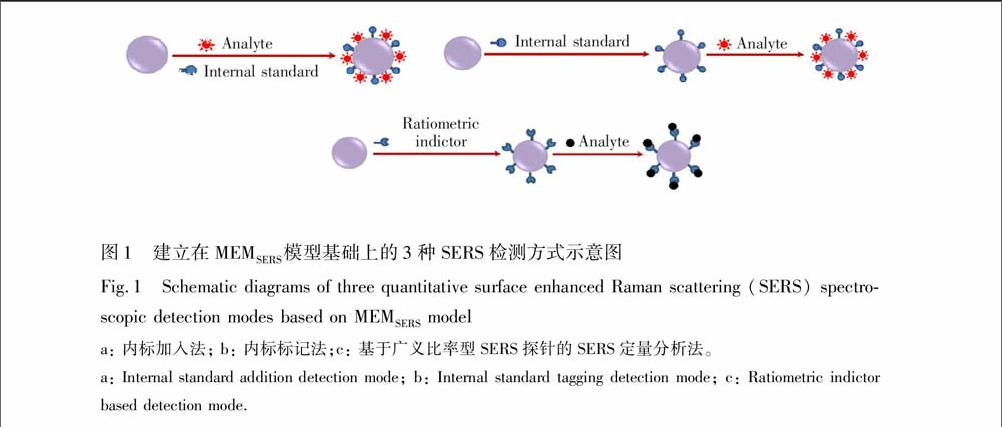
根据上述MEMSERS定量分析模型,本研究小组发展了如图1所示的内标加入法[64]、内标标记法[65]和基于广义比率型SERS探针的SERS定量分析技术[66]。建立在MEMSERS模型基础上的内标加入法和内标标记法不要求内标物质具有与待测样本中所有组分的SERS光谱峰均不重叠的特征SERS光谱峰,而且它们的分析结果不受其它共存SERS活性物质和荧光背景干扰的影响,因此与普通内标法有着显著的区别。但这两种检测方式只适用于能吸附到SERS增强基底上并产生SERS信号的待测物质的定量分析。基于广义比率型SERS探针的SERS定量分析技术则无需使用任何内标,可用于本身没有SERS信号的物质的检测,能更好地应用于实际复杂体系中待测物质的SERS光谱定量分析。在今后的SERS光谱定量分析技术研究中,可以将稳定性好、具有特异性识别以及功能化的SERS增强基底与建立在MEMSERS模型基础上的几种SERS定量检测方式相结合,以提高待测物质SERS定量分析的灵敏度和精确度。endprint
3 SERS光谱定量分析技术的应用
3.1 SERS光谱定量分析技术在环境分析领域中的应用
随着科学技术及社会经济的发展,环境问题与人们的生产生活密切相关,并对人类的生存造成巨大威胁。如生产企业排放的废水中含有多种重金属离子,这些离子不能自行分解,在生物体内积累富集造成慢性中毒;有机污染物如多环芳烃、农药、毒素、染料、酚类等都具有一定的毒性,对人类健康生活造成严重威胁。因此,定量检测环境样本中污染物的问题具有极其重要的意义。SERS光谱技术在环境污染物的定量检测方面具有巨大的潜能。新型SERS增强基底如Fe3O4@Ag核壳型磁性纳米粒子[67]、Au/CuS复合材料[68]、氨甲基膦酸修饰的金纳米粒子[69]、镀金硅材料[70]、立方体和正八面体纳米晶体组成的膜[71]等已被尝试用于无机污染物的定量检测;在有机污染物定量检测中使用到的SERS增强基底主要包括Ag纳米粒子[72]、金纳米棒[73]、银量子点纳米复合材料[74]、银纳米颗粒包裹的硅纳米线阵列[75]、多功能的镀金稀土元素掺杂氢氧化氟纳米管等[76]。而建立在SERS光谱乘子效应定量分析模型基础上的3种SERS检测方式也分别成功应用于环境样中不同污染物的准确定量分析[57,58,63,64]。
3.2 SERS光谱定量分析技术在食品分析领域中的应用
食品安全与人类的健康有着非常紧密的联系。食品安全问题主要包括化学性危害、生物毒素、微生物性危害、食品掺假、基因工程等。SERS光谱技术由于其具有选择性好、灵敏度高、检测快速等诸多优势,在食品检测领域中的应用越来越广泛。用于食品中有害物质的定量检测的SERS增强基底包括银纳米粒子[13]、金纳米粒子[77]、青铜便士为底的银纳米树突[78]、采用分子印迹技术合成的银纳米树突结构[79]、银包裹修饰有拉曼探针的金颗粒形成的核壳型复合颗粒[80]、直立金纳米棒阵列[81]、在由硅片支撑的聚苯乙烯微球上覆盖一层纳米金颗粒而成的SERS增强基底[82]、石墨烯上铺一层金膜后再铺一层金纳米棒而成的SERS增强基底[83]等。另外,偏最小二乘法和多元线性回归等多元数据分析方法结合SERS光谱技术也已成功用于食品的定量检测[55,84~86]。
3.3 SERS光谱定量分析技术在生物分析领域中的应用
近年来,SERS光谱技术结合纳米技术在生物分析领域的应用越来越广泛。目前, SERS光谱技术在生物分析领域中的应用主要在生物标记物、蛋白质、目标DNA链、药物与基因载体的检测、细胞与生物分子的分离与纯化、临床医学诊断、生物制药等方面。例如,对性质比较均一的金属或磁性纳米颗粒进行特异性功能化修饰,结合抗体抗原的特异性反应可对蛋白质进行高灵敏的SERS光谱定量分析[87~96];利用靶标纳米探针结合SERS光谱技术可实时监测细胞内待测分子的振动光谱,从而有助于进一步揭示细胞的各种生命活动过程 [97~105]。但是目前利用SERS光谱技术对细胞内待测分子实时监测的研究尚处于定性或半定量的阶段。建立在MEMSERS模型基础上的基于广义比率型SERS探针的SERS定量分析技术将有可能为细胞内重要生理功能活性物质的准确定量检测提供有效工具。
4 展 望
近年来,SERS光谱技术在检测灵敏度、特异性识别以及功能化SERS增强基底的制备等方面都获得了巨大的发展。然而实际分析体系的复杂化对SERS光谱技术提出了更高的要求,SERS基底制作技术和工艺仍然面临着巨大的挑战。目前还没有一项制作技术能保证制备出的SERS增强基底的物理性质完全一致、且具有完全相同的SERS增强效果。因此在近期内仅依靠提高和改善制作SERS增强基底的技术和工艺, 实现SERS光谱准确定量分析的目的至少是不太现实的。表面增强拉曼光谱的乘子效应模型能够有效地消除SERS基底物理性质等干扰因素的变化对SERS光谱定量分析结果准确度的影响,从而实现复杂体系中待测物质的准确SERS光谱定量分析。该模型具有简单实用、性能优良的特点。将表面增强拉曼光谱的乘子效应模型与具有特异性识别功能,以及均一性、稳定性和重现性较好的SERS增强基底相结合,对复杂体系中待测物质进行直接或间接的快速定量分析应为未来SERS光谱定量分析技术研究的重要方向。
References
1 Fleischmann M,Hendra P J, McQuillan A J. Chem. Phys. Lett., 1974, 26(2): 163-166
2 Albrecht M G, Creighton J A. J. Am. Chem. Soc., 1977, 99(15): 5215-5217
3 Jeanmaire D L, Van Duyne R P. J. Electroanal. Chem. Interfacial Electrochem., 1977, 84(1): 1-20
4 Yamada H, Yamamoto Y. Chem. Phys. Lett., 1981, 77(3): 520-522
5 Nie S M, Emery S R. Science, 1997, 275(5303): 1102-1106
6 Lu L H, Sun G Y, Zhang H J, Wang H S, Xi S Q,Hu J Q, Tian Z Q, Chen R. J. Mater. Chem., 2004, 14(6): 1005-1009
7 XIE Yun-Fei, WANG Xu, RUAN Wei-Dong, SONG Wei, ZHAO Bing. Spectroscopy and Spectral Analysis, 2011, 31(9): 2319-2323endprint
谢云飞, 王 旭, 阮伟东, 宋 薇, 赵 冰. 光谱学与光谱分析, 2011, 31(9): 2319-2323
8 Li J L, Chen L X, Lou T T, Wang Y Q. ACS Appl. Mater. Inter., 2011, 3(10): 3936-3941
9 Guerrini L, Garcia-Ramos J V, Domingo C, Sanchez-Cortes S. Anal. Chem., 2009, 81(4): 1418-1425
10 Zhang LL, Jiang C L, Zhang Z P. Nanoscale, 2013, 5(9): 3773-3779
11 Wu L N, Wang Z J,Shen B Z. Nanoscale, 2013, 5(12): 5274-5278
12 Lou TT, Wang Y Q, Li J H, Peng H L, Xiong H, Chen L X. Anal. Bioanal. Chem., 2011, 401(1): 333-338
13 FAN Yu-Xia, LAI Ke-Qiang, HUANG Yi-Qun. Spectroscopy and Spectral Analysis, 2014, 34(7): 1859-1864
樊玉霞, 赖克强, 黄轶群. 光谱学与光谱分析, 2014, 34(7): 1859-1864
14 Kim K, Shin K S. Anal. Sci., 2011, 27(8): 775-783
15 WU Zi-Tong, LIU Yi-Zhen, ZHOU Xiao-Dong, SHEN Ai-Guo, HU Ji-Ming. Journal of Analytical Science, 2014, 30(6): 829-839
伍子同, 刘翼振, 周晓东, 沈爱国, 胡继明. 分析科学学报, 2014, 30(6): 829-839
16 Calvet A, Ryder A G. Anal. Chim. Acta, 2014, 840: 58-67
17 Barhoumi A, Halas N J. J. Am. Chem. Soc., 2010, 132(37): 12792-12793
18 Singhal K, Kalkan A K. J. Am. Chem. Soc., 2010, 132(2): 429-431
19 ZHAI Fu-Li, HUANG Yi-Qun, WANG Xi-Chang, LAI Ke-Qiang. Chinese J. Anal. Chem., 2012, 40 (5): 718-723
翟福丽, 黄轶群, 王锡昌, 赖克强. 分析化学, 2012, 40 (5): 718-723
20 Lu G, Keersmaecker H D, Su L, Kenens B, Rocha S, Fron E, Chen C, Dorpe P V, Mizuno H, Hofkens J, Hutchison J A, Uji I H. Adv. Mater., 2014, 26(30): 5124-5128
21 Palys B J, Bukowska J, Jackowska K. J. Electroanal. Chem., 1997, 428(1-2): 19-24
22 Seki H. J. Vac. Sci. Technol., 1981, 18(2): 633-637
23 Frens G. Nature, 1973, 241(105): 20-22
24 Lee P C, Meisel D. J. Phys. Chem., 1982, 86(17): 3391-3395
25 Alvarez-Puebla R A,Arceo E, Goulet P J G, Garrido J J, Aroca R F. J. Phys. Chem. B, 2005, 109(9): 3787-3792
26 Lin X M, Cui Y,Xu Y H, Ren B, Tian Z Q. Anal. Bioanal. Chem., 2009, 394:1729-1745
27 Gao P, Weaver M J. J. Phys. Chem., 1985, 89 (23): 5040-5046
28 Ren B, Liu G K, Lian X B , Yang Z L, Tian Z Q, Anal. Bioanal. Chem., 2007, 388: 29-45
29 Knight D S, Weimer R,Pilione L, White W B. Appl. Phys. Lett., 1990, 56: 1320
30 Moskovits M. Chem. Phys. Lett., 1983, 98(5): 498-502
31 Rowe J E, Shank C V,Zwemer D A,Murray C A. Phys. Rev. Lett., 1980, 44: 1770-1773
32 Grabar K C, Freeman R G, Hommer M B, Natan M J. Anal. Chem., 1995, 67(4): 725-743
33 Jana N R,Gearheart L, Murphy C J. J. Phys. Chem. B, 2001, 105: 4065-4067endprint
34 Nikoobakht B, El-Sayed M A. Chem. Mater., 2003, 15: 1957-1962
35 Xiong Y J, McLellan J M, Chen J Y, Yin Y D, Li Z Y, Xia Y N. J. Am. Chem. Soc., 2005, 127: 17118-17127
36 HU Di-Jun, ZHANG Xue-Jiao, XU Min-Min, YAO Jian-Lin, GU Ren-Ao. Spectroscopy and Spectral Analysis, 2015, 35(5): 1262-1265
胡迪军, 张雪姣, 徐敏敏, 姚建林, 顾仁敖. 光谱学与光谱分析, 2015, 35(5): 1262-1265
37 Khoury C G, Vo-Dinh T. J. Phys. Chem. C, 2008, 112(48): 18849-18859
38 Li J F,HuangY F, Ding Y, Yang Z L, Li S B, Zhou X S, Fan F R, Zhang W, Zhou Z Y, Wu D Y, Ren B, Wang L Z, Tian Z Q. Nature, 2010, 464: 392-395
39 Cai Q, Hu F, Lee S T, Liao F, Li Y Q, Shao M W. Appl. Phys. Lett., 2010, 106: 023107
40 Freeman R G,Grabar K C, Allison K J, Bright R M, Davis J A, Guthrie A P, Hommer M B, Jackson M A, Smith P C, Walter D G, Natan M J. Science, 1995, 267(5204): 1629
41 Jia P, Cao B, Wang J, Qu J, Liu Y, Pan K. Analyst, 2015, 140: 5707-5715
42 Ko H, Singamaneni S, Tsukruk V V. Small, 2008, 4: 1576-1599
43 Tao A R, Huang J X, Yang P D. Acc. Chem. Res., 2008, 41(12): 1662-1673
44 Deng Y H,Tüysüz H, Henzie J, Yang P D. Small, 2011, 7(14): 2037-2040
45 Ling X Y, Yan R X, Lo S, Hoang D T, Liu C,Fardy M A, Khan S B, Asiri A M, Bawaked S M, Yang P D. Nano Res., 2014, 7(1): 132-143
46 Kondo T,Kitagishi N, Yanagishita T, Masuda H. Appl. Phys. Express, 2015, 8(6): 062002
47 Shan D Z, Huang L Q, Li X, Zhang W W, Wang J, Cheng L, Feng X H, Liu Y, Zhu J P, Zhang Y. J. Phys. Chem. C, 2014, 118(41): 23930-23936
48 Schmidt M S,Hübner J, Boisen A. Adv. Mater., 2012, 24:11-18
49 Kahl M, Voges E, Kostrewa S, Viets C, Hill W. Sens. Actuators B, 1998, 51: 285-291
50 Lee S,Choi J, Chen L X, Park B, Kyong J B, Seong G H, Choo J, Lee Y, Shin K H, Lee E K, Joo S W, Lee K H. Anal. Chim. Acta, 2007, 590: 139-144
51 Aarnoutse P J, Westerhuis J A. Anal. Chem., 2005, 77(5): 1228-1236
52 Xu L J, Lei Z C, Li J X, Zong C, Yang C J, Ren B. J. Am. Chem. Soc., 2015, 137(15): 5149-5154
53 Bell S E J,Mackle J N, Sirimuthu N M S. Analyst, 2005, 130: 545-549
54 Mrz A, Ackermann K R, Malsch D, Bocklitz T, Henkel T, Popp J. J. Biophotonics, 2009, 2(4): 232-242
55 Lorén A, Engelbrektsson J, Eliasson C, Josefson M, Abrahamsson J, Johansson M, Abrahamsson K, Anal. Chem., 2004, 76(24): 7391-7395
56 Shen W, Lin X, Jiang C Y,Li C Y, Lin H X, Huang J T, Wang S, Liu G K, Yan X M, Zhong Q L, Ren B. Angew. Chem. Int. Ed., 2015, 54: 1-6endprint
57 Cheung W,Shadi I T, Xu Y, Goodacre R. J. Phys. Chem. C, 2010, 114: 7285-7290
58 Graham D,Faulds K. Chem. Soc. Rev., 2008, 37: 1042-1051
59 Song J, Chen Z P, Jin J W, Chen Y, Yu R Q. Chemom. Intell. Lab. Syst., 2014, 135: 31-36
60 Xia T H, Chen Z P, Chen Y, Jin J W, Yu R Q. Anal. Methods, 2014, 6(7): 2363-2370
61 Chen Z P, Morris J, Martin E. Anal. Chem., 2006, 78(22): 7674-7681
62 Chen Z P, Zhong L J, Nordon A, Littlejohn D, Holden M, Fazenda M, Harvey L, McNeil B, Faulkner J, Morris J. Anal. Chem., 2011, 83 (7): 2655-2659
63 Jin J W, Chen Z P, Li L M,Steponavicius R, Thennadil S N, Yang J, Yu R Q. Anal. Chem., 2012, 84(1): 320-326
64 Long S Y,Chen Z P, Chen Y, Yu R Q. J. Raman Spectrosc., 2015, 46(7): 605-609
65 Chen Y, Chen Z P,Jin J W, Yu R Q. Chemom. Intell. Lab. Syst., 2015, 142: 166-171
66 Chen Y, Chen Z P, Long S Y, Yu R Q. Anal. Chem., 2014, 86(24): 12236-12242
67 Du J, Jing C. J. Colloid Interface Sci., 2011, 358(1): 54-61
68 Cai Q, Lu S, Liao F, Li Y, Ma S, Shao M. Nanoscale, 2014, 6(14): 8117-8123
69 Ruan C, Luo W, Wang W, Gu B. Anal. Chim. Acta, 2007, 605(1): 80-86
70 Gajaraj S, Fan C, Lin M, Hu Z. Environ. Monit. Assess., 2013, 185(7): 5673-5681
71 Mulvihill M, Tao A, Benjauthrit K, Arnold J. Angew. Chem., 2008, 120(34): 6556-6560
72 Furini L N, Sanchez-Cortes S, López-Tocón I, Otero J C, Aroca R F, Constantino C J L. J. Raman Spectrosc., 2015
73 Saute B, Premasiri R, Ziegler L, Narayanan R. Analyst, 2012, 137(21): 5082-5087
74 Carrillo-Carrión C, Simonet B M, Valcárcel M, Lendl B. J. Chromatogr. A, 2012, 1225: 55-61
75 Wang X T, Shi W S, She G W, Mu L X. Appl. Phys. Lett., 2010, 96(5): 053104
76 Zhang D Q, Sun T Y, Yu X F, Jia Y, Chen M, Wang J H, Huang H, Chu P K. Mater. Res. Bull., 2014, 52: 122-127
77 Giovannozzi A M, Rolle F, Sega M, Abete M C, Marchis D, Rossi A M. Mater. Res. Bull., 2014, 159: 250-256
78 Gao F, Feng S, Chen Z, Li-Chan E C Y, Grant E, Lu X. J. Food Sci., 2014, 79(12): N2542-N2549
79 Feng S L, Gao F, Chen Z W, Grant E, Kitts D D, Wang S, Lu X N. J. Agric. Mater. Res. Bull., 2013, 61(44): 10467-10475
80 Li M X, Yang H, Li S Q, Zhao K, Li J G, Jiang D N, Sun L L, Deng A P. J. Agric. Mater. Res. Bull., 2014, 62(45): 10896-10902
81 Zhang Z, Yu Q, Li H, Mustapha A, Lin M. J. Food Sci., 2015, 80(2): N450-N458
82 Peksa V, Jahn M, tolcov L, Schulz V, Proka J, Prochzka M, Weber K, Popp J. Anal. Chem., 2015, 87(5): 2840-2844endprint
83 Nguyen T H D, Zhang Z, Mustapha A, Lin H, Lin M S. J. Agric. Mater. Res. Bull., 2014, 62(43): 10445-10451
84 He L, Chen T,Labuza T P. Mater. Res. Bull., 2014, 148: 42-46
85 Lin M, He L,Awika J, Yang L, Ledoux D R, Li H, Mustapha A. J. Food Sci., 2008, 73(8): T129-T134
86 Lee K M,Herrman T J, Bisrat Y, Murray S C. J. Agric. Mater. Res. Bull., 2014, 62(19): 4466-4474
87 Gong J L, Liang Y, Huang Y, Chen J W, Jiang J H,Shen G L, Yu R Q. Biosens. Bioelectron., 2007, 22(7): 1501-1507
88 Gong J L, Jiang J H, Yang H F,Shen G L, Yu R Q, Ozaki Y. Anal. Chim. Acta, 2006, 564(2): 151-157
89 Song C Y, Wang Z Y, Zhang R H, Yang J, Tan X B, Cui Y P. Biosens. Bioelectron., 2009, 25(4): 826-831
90 Zhou Z, Huang GG, Kato T, Ozaki Y. J. Raman Spectrosc., 2011, 42(9): 1713-1721
91 Volkert A A, Haes A J. Analyst, 2014, 139(1): 21-31
92 Shin M H, Hong W, Sa Y, Chen L, Jung Y J, Wang X, Zhao B, Jung Y M. Vib. Spectro., 2014, 72: 44-49
93 Gu X F, Yan Y R, Jiang G Q, Adkins J, Shi J, Jiang G M, Tian S. Anal. Bioanal. Chem., 2014, 406(7): 1885-1894
94 Wang Y L,Vaidyanathan R, Shiddiky M J A, Trau M. ACS Nano, 2015, 9(6): 6354-6362
95 Kamińska A, Witkowska E, Winkler K, Dzicielewski I, Weyher J L, Waluka J. Biosens. Bioelectron., 2015, 66: 461-467
96 Guo M D, Dong J, Xie W, Tao L, Lu W B, Wang Y, Qian W Q. J. Mater. Sci., 2015, 50(9): 3329-3336
97 Vitol E A,Orynbayeva Z, Friedman G, Gogotsi Y. J. Raman Spectrosc., 2012, 43(7): 817-827
98 LEI Yun, XU Jun. Journal of Light Scattering, 2015, 1: 35-38
雷 芸, 徐 骏. 光散射学报, 2015, 1: 35-38
99 Panikkanvalappil S R, Mackey M A, El-Sayed M A. J. Am. Chem. Soc., 2013, 135(12): 4815-4821
100 Huang J,Zong C, Shen H, Liu M, Chen B, Ren B, Zhang Z J. Small, 2012, 8(16): 2577-2584
101 Xiao L,Harihar S, Welch D R, Zhou A H. Anal. Chim. Acta, 2014, 843: 73-82
102 Lentini G, Fazio E, Calabrese F, De Plano L M, Puliafico M, Franco D, Nicolò M S, Carnazza S, Trusso S, Allegra A, Neri F, Musolino C, Guglielmino S P P. Biosens. Bioelectron., 2015, 74: 398-405
103 Ramya A, Samanta A, Nisha N, Chang Y T, Maiti K K. Nanomedicine, 2015, 10(4): 561-571
104 Toccafondi C, Rocca R L, Scarpellini A, Salerno M, Das G, Dante S. Appl. Surf. Sci., 2015, 351: 738-745
105 Jamieson L E,Jaworska A, Jiang J, Baranska M, Harrison D J, Campbell C J. Analyst, 2015, 140: 2330-2335endprint

