术前放疗与术前化疗治疗Ⅰb2期宫颈癌的疗效比较
贺清波 闫 涛
既往临床常采用手术联合术后放疗治疗早期宫颈癌,值得注意的是,该治疗方案难以取得理想疗效,患者常出现较高的并发症发生率、复发率[1],因此临床有必要探索更为有效的早期宫颈癌的治疗方案。随着研究的深入,术前放化疗等新的治疗手段应用于临床,并且在多种恶性肿瘤的治疗过程中发挥积极有效的作用[2-3]。但是术前放疗与术前化疗的临床效果不同,本文即旨在对比分析术前放疗与术前化疗治疗Ⅰb2期宫颈癌的疗效,现报告如下。
1 资料与方法
1.1 一般资料
2009年3月-2011年7月我院收治的110例患者。纳入标准:①术后经病理检查确诊为宫颈癌;②临床分期为Ⅰb2期;③无放化疗、手术禁忌证。排除标准:①既往接受宫颈癌相关治疗的患者;②随访丢失的患者。根据治疗方案将上述患者分为观察组与对照组,观察组58例,年龄 37~54岁,平均(42.7±8.0)岁;鳞癌47例、腺癌11例。对照组52例,年龄39~51岁,平均(42.0±7.8)岁;鳞癌44例、腺癌8例。2组患者一般资料差异无统计学意义(P>0.05)。
1.2 研究方法
观察组患者接受术前放疗联合手术治疗,术前放疗方案为A点剂量DT 5 Gy/次,连续2次,2次放疗之间间隔3天;术前放疗结束后第14天给予患者手术。对照组患者接受术前化疗联合手术治疗,化疗采用PVB方案,顺铂(江苏豪森药业股份有限公司生产,国药准字 H20010743,规格 20 mg/支)20 mg/m2,第1 ~4天静脉点滴2 h;长春新碱(海正辉瑞制药有限公司生产,国药准字H20043326,规格为1 mg/支)2 mg,第1天静脉推注;平阳霉素(辽源市迪康药业有限责任公司生产,国药准字H20123357,规格为8 mg/支)16 mg/m2,第1~3天静脉点滴4 h;术前化疗结束后第14天给予患者手术。
1.3 随访方式
在手术结束后对患者进行随访,随访方式主要为门诊就诊、电话询问等,记录患者的远期疗效指标,包括复发、转移、生存情况等。本研究随访期为3年,患者死亡后即终止随访,所有患者均得到有效随访。
1.4 统计学分析
2 结果
2.1 放化疗前后2组患者宫颈肿块体积的比较
放化疗前,2组患者宫颈肿块体积相比差异无统计学意义(P>0.05);放化疗后,观察组宫颈肿块体积显著小于对照组(P<0.05)。见表1。
表1 放化疗前后2组患者宫颈肿块体积的比较(s,cm3)

表1 放化疗前后2组患者宫颈肿块体积的比较(s,cm3)
组别 例数 放化疗前 放化疗后观察组58 4.9 ±1.1 1.7 ±0.6对照组52 4.7 ±0.9 2.5 ±0.7
2.2 放化疗过程中2组患者不良反应发生率的比较
放化疗过程中,2组患者骨髓抑制发生率、胃肠道反应发生率相比差异无统计学意义(P>0.05)。见表2。

表2 放化疗过程中2组患者不良反应发生率的比较(例,%)
2.3 2组患者手术指标的比较
观察组手术时间、术中出血量均显著低于对照组(P <0.05)。见表3。
表3 2组患者手术指标的比较(s)
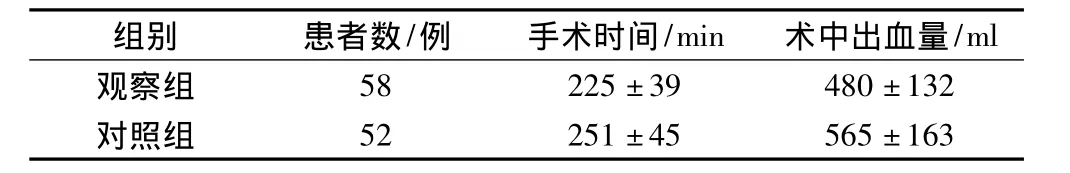
表3 2组患者手术指标的比较(s)
/ml观察组组别 患者数/例 手术时间/min 术中出血量58 225±39 480±132对照组52 251±45 565±163
2.4 随访期内2组患者复发率及转移率的比较
随访期内,2组患者腹腔转移率、腹股沟淋巴结转移率、锁骨上淋巴结转移率、阴道残端复发率相比,差异无统计学意义(P>0.05)。见表4。

表4 随访期内2组患者复发率及转移率的比较(例,%)
2.5 2组患者1年生存率与3年生存率的比较
2组患者1年生存率、3年生存率相比,差异无统计学意义(P>0.05)。见表5。

表5 2组患者1年生存率与3年生存率的比较(例,%)
3 讨论
宫颈癌是目前临床上最常见的妇科恶性肿瘤,其发病率占女性恶性肿瘤的第2位。目前临床治疗宫颈癌的主要原则是根据患者年龄、临床分期、全身情况等给予相应的治疗方案[4]。根据这个原则,同一宫颈癌患者可以采用多种方案进行治疗,如手术联合术后放化疗、术前放化疗联合手术等。
对于Ⅰb2期宫颈癌,传统临床主要治疗方案是先给予子宫根治术以及盆腔淋巴结清扫术,卵巢正常则予以保留,在手术结束后,再给予患者必要的放疗。化疗则多用于晚期宫颈癌、复发宫颈癌的治疗,因此传统临床较少将其用于Ⅰb2期宫颈癌患者[5]。值得注意的是,传统宫颈癌治疗方案的疗效不甚理想,近期主要表现为并发症发生率较高,而远期则主要表现为复发率较高[1]。随着研究的深入,术前放化疗应用于Ⅰb2期宫颈癌的治疗。由于术前放化疗可以减小肿瘤体积,减小肿瘤浸润范围与转移范围,在增加患者手术机会的同时还可以降低术后转移率和复发率[6-7],因此它们目前已有取代传统治疗方案的趋势。
本研究中,观察组患者接受术前放疗联合手术治疗,对照组患者接受术前化疗联合手术治疗,结果显示观察组缩减宫颈肿块体积的效果显著优于对照组,这主要是因为化疗难以完全消灭微转移灶、亚临床病灶,而放疗比化疗可以更好地透过细胞膜发挥细胞毒作用,且放疗作用无细胞周期性限制,通过杀灭微转移灶为宫颈根治术创造更佳的条件[8]。进一步分析显示2组患者放化疗过程中不良反应发生率相当,但是观察组在手术时获得了更佳的手术疗效指标,包括手术时间更短、术中出血量更低等,其原因则是观察组在术前放疗后宫颈肿块体积缩减得更小,这势必可以降低手术操作难度、减少患者的手术创伤等。通过术后3年的随访,结果显示2组患者的远期疗效指标包括转移率、复发率、生存率等相当,这说明术前放化疗对Ⅰb2期宫颈癌患者的远期疗效影响有限。综上所述,术前放疗与术前化疗治疗Ⅰb2期宫颈癌的远期疗效相当,但前者的近期疗效更佳,值得临床推广应用。
[1]孙 帅,张福泉,胡 克,等.宫颈癌术后调强放疗同期化疗临床分析〔J〕.中华放射肿瘤学杂志,2013,22(1):13-16.
[2]刘少晓,程晓燕,郑红枫,等.紫杉醇联合顺铂新辅助治疗局部晚期宫颈癌的临床疗效及安全性评价〔J〕.中国临床药理学杂志,2015,31(6):432-434.
[3]王体兵.新辅助放疗治疗中晚期宫颈癌60例临床分析〔J〕.吉林医学,2013,34(32):6686-6687.
[4]周 晖,彭永排,俞 进,等.《2014年NCCN宫颈癌临床实践指南》解读(续)〔J〕.实用妇产科杂志,2014,30(7):505-507.
[5]邢 艳,吴玉梅.局部晚期宫颈癌新辅助化疗研究进展〔J〕.肿瘤学杂志,2014,20(12):967-971.
[6]赖淑贞,廖卫坚,余晓文,等.巨块型子宫颈癌术前252锎腔内后装放疗与术前化疗的对比分析〔J〕.实用癌症杂志,2013,28(4):414-416.
[7]潘施施,龚丽华,陈秀秀,等.Ⅰb2~Ⅱa2期局部晚期宫颈癌术前辅助治疗的疗效比较〔J〕.中国妇幼保健,2014,29(1):20-22.
[8]姚 彬,朱 燕.新辅助化疗结合放疗与单纯放疗治疗局部晚期宫颈癌的临床比较〔J〕.实用癌症杂志,2013,20(1):69-71.

