腹腔镜全胃D2根治术治疗胃上部癌的近期疗效观察
邓正兴
胃癌是目前临床上最常见的消化系统恶性肿瘤之一,其发病率与死亡率占所有恶性肿瘤的第2位[1]。根据胃癌的发病部位,临床上常将其分为胃上部癌、胃中部癌、胃下部癌等。近年来,随着胃窦部肿瘤发病率的逐步下降,胃上部癌发病率却逐步上升[2]。与其他部位胃癌一样,手术是目前临床上治疗胃上部癌的主要手段,且随着微创外科的发展,腹腔镜等微创术式逐步应用于胃上部癌的治疗。本研究即对腹腔镜全胃D2根治术治疗胃上部癌的近期疗效进行详细分析,现报告如下。
1 资料与方法
1.1 一般资料
2010年3月-2015年2月在资溪县人民医院进行手术治疗的139例胃上部癌患者,所有患者均经术后病理检查确诊为胃癌,TNM分期为Ⅰ~Ⅲa期,且肿瘤位置均为胃上部。排除:肿瘤直径>10 cm的患者,合并浆膜层大面积受侵的患者;合并腹部严重粘连的患者;合并重要脏器功能不全,不能耐受手术的患者。根据术式将139例患者分为观察组与对照组,2组患者一般资料相比差异无统计学意义(P>0.05),见表1。
1.2 手术方法
观察组患者接受腹腔镜全胃D2根治术治疗,步骤如下:穿刺脐孔建立气腹,再制作4个操作孔,置入相应器械,分离大网膜,按分区清扫原则清扫淋巴结。探查腹腔转移情况,沿横结肠边缘离断胃结肠韧带、大网膜,解剖、结扎、离断胃网膜右动静脉,清扫第6组淋巴结。沿着胃十二指肠动脉游离肝总动脉、肝固有动脉,清扫第12a组淋巴结。解剖、结扎、离断胃右血管,清扫第5组淋巴结。游离十二指肠球部直至幽门下3 cm,沿着胰腺上缘解剖腹腔干及其三分支,清扫第7~9组、11p组淋巴结。解剖、结扎、离断胃左动静脉。沿肝缘离断肝胃韧带,游离胃小弯,清扫第3组淋巴结。解剖、结扎、离断胃网膜左动静脉,清扫第4 s组淋巴结。在近脾门处离断脾胃韧带,结扎、离断胃短动脉,游离、解剖胃底,离断膈胃韧带,切开膈肌腹膜返折,清扫第1~2组淋巴结。游离食管下段直至贲门口上缘6 cm,切断其营养血管及双侧迷走神经,在幽门下2 cm离断十二指肠,关闭气腹。在剑突下取切口进腹,在肿瘤上缘5 cm处将食管离断,荷包缝合食管近侧断端,端侧吻合食管与空肠远侧断端,检查吻合口情况,如无异常后闭合空肠远侧断端,侧侧吻合空肠近侧断端、距食管空肠吻合口40 cm的空肠段,关闭空肠近侧断端。在吻合口周围与胰腺上方置入硅胶负压球引流管,逐层缝合关闭切口。对照组有患者接受开腹手术治疗,术前准备与观察组一致,在患者脐上腹正中作一长15~20 cm的绕脐切口,按胃癌D2根治术要求进行手术。

表1 2组患者一般资料的比较
1.3 统计学分析
采用SAS 9.0统计软件,计量资料用均数±标准差表示,计量资料比较采用μ检验,计数资料比较采用四格表χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 观察组中转开腹情况分析
72例观察组患者仅1例患者中转开腹,主要是由于胃后壁受到侵犯,与胰腺之间的界限不清,分离困难所致,中转开腹率为 1.39%。
2.2 2组患者手术指标及术后恢复指标的比较
观察组手术时间显著高于对照组(P<0.05),手术切口长度、术中出血量、胃肠功能恢复时间、首次进食时间、术后住院时间显著低于对照组(P<0.05),2组患者淋巴结清除数相比差异无统计学意义(P>0.05)。见表2。
表2 2组患者手术指标及术后恢复指标的比较(±s)
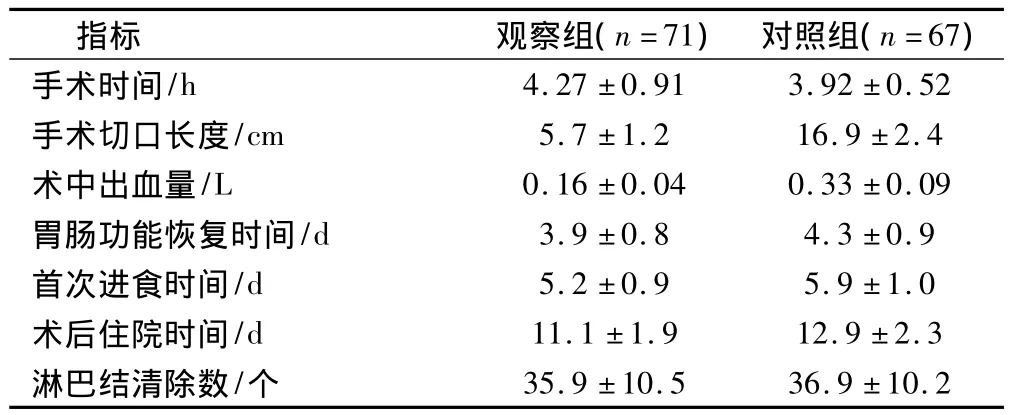
表2 2组患者手术指标及术后恢复指标的比较(±s)
指标 观察组(n=71)对照组(n=67)/h 4.27 ±0.91 3.92 ±0.52手术切口长度/cm 5.7 ±1.2 16.9 ±2.4术中出血量/L 0.16 ±0.04 0.33 ±0.09胃肠功能恢复时间/d 3.9 ±0.8 4.3 ±0.9首次进食时间/d 5.2 ±0.9 5.9 ±1.0术后住院时间/d 11.1 ±1.9 12.9 ±2.3淋巴结清除数/个手术时间35.9 ±10.5 36.9 ±10.2
2.3 2组患者手术并发症发生率的比较
观察组切口感染率显著低于对照组(P<0.05),2组患者吻合口瘘、肺部感染、粘连性肠梗阻等并发症发生率相比差异无统计学意义(P>0.05)。见表3。

表3 2组患者手术并发症发生率的比较(例,%)
3 讨论
胃癌是指来源于胃黏膜上皮细胞的恶性肿瘤,占所有胃恶性肿瘤的95%。至目前为止,胃癌的病因尚未完全明确,各种研究报道均认为幽门螺杆菌感染,胃良性慢性疾病,胃黏膜上皮异型性增生以及环境、饮食等因素与胃癌的发生及发展密切相关[3-5]。在解剖学上,胃可以分为贲门、胃底、胃体、胃窦、幽门等5个区域,其中胃窦部是胃癌最常见的发生部位,贲门部次之,因此胃上部癌亦是临床上较常见的胃癌类型,但是不论胃癌发生在哪个部位,手术被认为是其最主要的方法。
既往临床研究认为全胃切除术治疗胃上部癌有很多不足之处,如手术创伤大,对胃肠道的生理构造进行了显著的改变,因此患者术后恢复慢、并发症发生率高、围手术期死亡率高等[6]。值得注意的是,随着近年来吻合器的应用、腹腔镜技术以及围手术期营养的发展,全胃切除术治疗胃上部癌的近期疗效得到显著改善,从而使得该术式的优势逐步得到显示,如根治性能更好,可以对第2站淋巴结彻底清扫,而这是近端胃切除术无法达到的[7]。此外,全胃切除术患者还可以获得更佳的远期生活质量,如术后胆汁不易反流至吻合口,显著降低顽固性反流、小胃综合征的发生率[8]。
在全胃切除术治疗胃上部癌的临床应用过程中,腹腔镜技术发挥了举足轻重的作用。尽管腹腔镜全胃切除术的手术难度大,如胃周围血管多、解剖层次多、淋巴结清扫范围广、吻合技术难度大等,但是这些难点均可以通过提高手术技巧得以解决,一旦术者熟练掌握腹腔镜全胃切除术的操作技巧,其独特优势就会得到充分显示[9-10]。在本研究中,观察组接受腹腔镜全胃D2根治术治疗,对照组接受开腹手术治疗,结果显示观察组患者取得了更佳的近期疗效,如手术切口小,术中出血量少,术后恢复快,切口感染并发症发生率低,且两种术式淋巴结清除数无显著差异。由于部分研究对象失访,本研究未对两术式的远期疗效进行比较,这有待进一步研究。
[1]还勇为.FOLFOX方案新辅助化疗在治疗进展期胃癌中的疗效观察〔J〕.实用癌症杂志,2013,28(6):678-680.
[2]林文霖,李志雄,许燕常,等.腹腔镜全胃D2根治术与开腹手术治疗胃上部癌的比较研究〔J〕.肿瘤研究与临床,2014,26(5):332-335.
[3]徐 伟,吴福林,孙春花.卡培他滨联合奥沙利铂治疗进展期胃癌老年患者的疗效观察〔J〕.实用癌症杂志,2014,29(12):1604-1606.
[4]丁士刚,王 丽.应重视胃癌发病机制的规范研究〔J〕.中华医学杂志,2013,93(16):1201-1202.
[5]杨 俊,戴一扬,厉朝喜,等.三叶肽因子1表达与胃癌及胃溃疡的关系〔J〕.浙江医学,2012,34(8):587-589.
[6]杨天阳,郑民华.胃上部癌腹腔镜脾门淋巴结清扫术的研究进展〔J〕.中华消化外科杂志,2014,13(12):991-994.
[7]刘俊松,车向明,李铎伟,等.胃上部癌行全胃切除术与近端胃切除术疗效的 Meta分析〔J〕.中华消化外科杂志,2013,12(7):496-499.
[8]陈红星,施祖群,董明都.全胃切除术和近端胃切除术治疗胃上部癌的预后分析〔J〕.安徽医药,2012,16(10):1475-1476.
[9]张 辉,臧卫东,卓长华,等.进展期胃中上部癌行腹腔镜与开腹根治性全胃切除术的围手术期疗效比较〔J〕.中国临床医学,2010,17(3):341-344.
[10]于建平,韩晓鹏,刘宏斌,等.腹腔镜下行全胃和近侧胃切除治疗胃上部癌的疗效对比〔J〕.重庆医学,2014,43(28):3716-3717,3721.

