钒电池电解液配比的优化及其对电池性能的影响
王绍亮,范新庄,张建国,吴晓亮,刘建国,严川伟
(中国科学院金属研究所,辽宁 沈阳 110016)
全钒液流电池(钒电池)的活性物质存在于电解液中,通过不同价态钒离子间的氧化还原反应来实现电荷的存储和释放。由于钒电池中正负极活性物质均为钒离子,避免了传统液流电池普遍存在的交叉污染问题[1-4]。
目前,钒电池主要使用离子交换膜来实现正、负极电解液的隔离,在离子交换过程中难免伴随水的迁移和钒离子的扩散,所以钒电池在长期循环过程中容易导致因钒离子不匹配造成的电解液容量失衡现象[5]。此外,由于钒电池负极反应的标准电极电位与析氢反应的标准电极电位很接近,在充电过程中负极发生还原反应的同时往往伴随着氢气的析出,这也在一定程度上影响了钒电池的能量转换效率、运行稳定性、寿命等关键性能[6-7]。
在钒电池的实际操作过程中,由于离子交换膜存在不同物质间的传输,而不同钒离子的扩散系数也不相同,再加上正负极反应速度存在差异,所以价态匹配的电解液并非意味着最优的电化学性能,往往需要进行适当调整[8-9]。如果正极电解液过量,虽然可以避免正极侧因活性物质耗竭而发生的烧毡现象,但负极侧容易发生析氢反应,进而影响电池的效率,并会造成正极电解液价态偏高,严重降低电池的容量以及能量转换效率[7]。
此外,从钒电池正负极反应的动力学角度考虑,负极反应的动力学相对较差,电化学反应速率远低于正极,这就使得负极成为了钒电池的限制性电极[10-12]。如果在一定程度上提高负极活性物质的含量,则可以在一定程度上降低电池极化,避免析氢反应的发生,进而提高钒电池性能。
本文通过调整正负极电解液的体积和价态来调整负极活性物质的含量,系统考察了负极活性物质过量对电池能量转换效率和放电容量的影响规律。
1 实 验
1.1 实验试剂及仪器
实验采用由99.5% V2O5(湖南汇锋高新能源有限公司)制备的总钒浓度为1.5 mol/L(其中含有不同浓度的V3+和V4+)、H2SO4浓度为2.5 mol/L的混合溶液作为电解液。电化学测试采用自制单组钒电池,电极采用厚度为5 mm的碳毡(江油润生石墨毡有限公司)作为电极,其有效面积为28 cm2,隔膜为Nafion 212(美国杜邦公司),已标定刻度的试剂瓶作为电解液储罐。
实验仪器主要有CT-3008 5V 10A电池测试系统(深圳新威尔公司),TU-1900紫外分光光度计(北京普析通用仪器有限责任公司),BT100-1L蠕动泵(保定兰格恒流泵有限公司)。
1.2 实验方法
通过化学法、后续电解法分别制备了不同价态的钒电解液,并采用NB/T 42006—2013《全钒液流电池用电解液测试方法》中的测量方法对电解液中V3+和V4+的浓度进行测定。电化学测试中,采用不同配比的V3+、V4+的混合溶液作为初始电解液进行充放电。考虑到以V3+、V4+的配比来给电解液命名有些繁琐,因此引入了电解液价态的概念,根据式(1)可以计算出钒电解液的价态

式中,CV4+为钒电解液中V4+的浓度,mol/L;C为钒电解液的浓度,mol/L。
根据钒电池正负极反应方程式,可以得到正负极反应过程中的理论可转移电子数n,如式(2)和式(3)。对于不同价态的电解液,根据其理论可转移电子数来确定正负极电解液的体积,然后进行电化学性能测试。

式中,n-、n+分别为负极、正极反应理论可转移电子数;CV3+、CV4+分别为钒电解液中V3+、V4+的浓度,mol/L;V-、V+分别为负极、正极的电解液体积,mL。对于由负极电解液体积偏多导致的负极活性物质过量的下文简称为体积过量;由电解液价态偏高导致的负极活性物质过量的下文简称为价态过量。
单电池主要进行恒电流充放电循环测试,测试条件为:25~30 ℃,充放电电压为0.8~1.6 V,充放电电流密度为100 mA/cm2,蠕动泵的转速为45 mL/min。
2 结果与讨论
2.1 电解液体积配比对电池性能的影响
选取0.75 mol/L V3++0.75 mol/L V4++2.5 mol/L H2SO4混合溶液为电解液(即3.50价),正极电解液体积均为50 mL,负极电解液体积依次为50 mL、60 mL、65 mL,即负极与正极的电解液之比(Vnegative/Vpositive,下文均简写为N/P)分别为1.0∶1.0,1.2∶1.0,1.3∶1.0。根据方程(2)和(3)可知,其负极理论可转移电子数相对正极分别过量0、20%和30%。图1为体积比不同时钒电池的放电容量和效率循环曲线。对于3.50价钒电解液,随着负极体积的增加,放电容量明显增加,而且在前期循环过程中,负极过量会使正、负极电解液经历一个再平衡的过程,从而达到容量的峰值,然后随循环次数逐渐降低[图1(a)]。然而,随着负极体积的增加,电池的效率并无明显变化,如图1(b)所示,这说明单纯增加负极的电解液体积,并未能改善放电过程中钒电池内部各部分极化,仅仅提高了钒电池的放电容量。
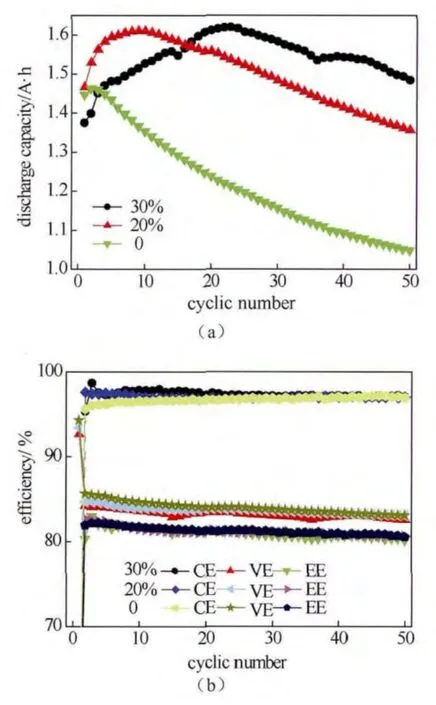
图1 3.50价钒电解液负极体积过量不同程度时钒电池的放电容量循环曲线(a)和效率循环曲线(b)Fig.1 The discharge capacity curve (a) and efficiency curve (b) with cycles of 3.50 valence vanadium electrolyte with different excess of the anodic volume
2.2 电解液价态对电池性能的影响
图2为正负极均采用50 mL的3.50、3.57、3.67和3.74价电解液时的容量循环曲线和效率循环曲线。由图2(a)可知,当正负极体积相同时,钒电解液价态越高,电池的首次放电容量越低。当电解液价态较为匹配(即3.50价溶液)时,电池的放电容量随着循环次数的增加不断降低,而当电解液价态过量时,钒电池的放电容量均随循环次数的增加不断升高直至达到一个稳定值。这可能是由于电解液的价态不匹配改变了正负极转移电子数的平衡,正负极电解液需要重新建立新的平衡,价态越高,需要的循环时间越长。此外,当电解液价态过高时,其放电容量的平台也会逐渐降低,这说明负极活性物质适当过量对钒电池放电容量是有利的,但当过量较多时就会不断降低其放电容量,因此需要综合考虑放电容量和电池性能才能确定最优的电解液配比。
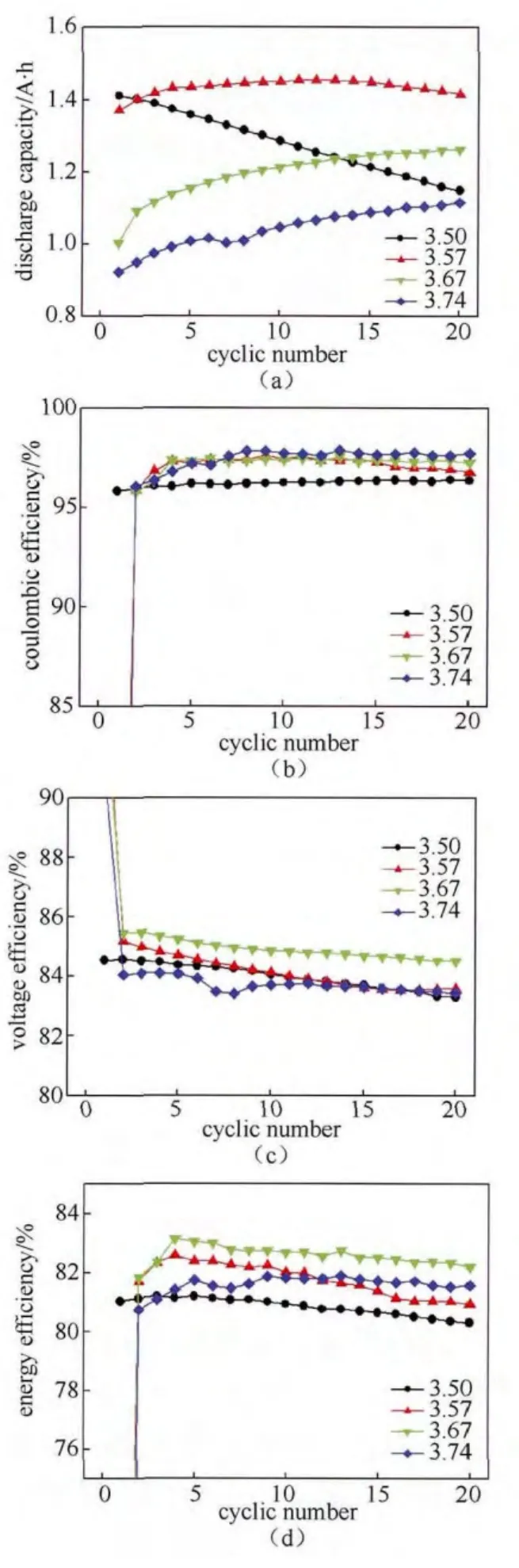
图2 电解液价态不同时钒电池的放电容量循环曲线(a)、库仑效率循环曲线(b)、电压效率循环曲线(c)和能量效率循环曲线(d)Fig.2 The discharge capacity curves (a), coulombic efficiency curves (b), voltage efficiency curves (c), and energy efficiency curves (d) for VFB with different electrolyte valence state
图2(b)~2(d)为不同电解液价态下的钒电池充放电效率曲线。可见,随着电解液价态的升高,电池的库仑效率略有升高,电压效率和能量效率则呈抛物线规律,先升高后降低趋于稳定,当电解液价态为3.67价时,电池的能量转换效率最高。由于负极反应在放电过程中所产生的极化在钒电池整体极化中占据较大的比例,尤其在充放电过程末期,负极的极化现象更为严重,而随着电解液价态的提高,电极表面负极活性物质的浓度比较高,相当于增加了活性粒子的扩散驱动力,降低了浓差极化,从而保证钒电池具有较高的放电电压平台和电压效率。同时,按照式(2)和式(3)计算,负极反应转移电子数大于正极反应的转移电子量,起到负极过量的作用,提高了负极电解液的电导率[13],降低了电池的欧姆极化,也使得电池效率有一定程度的提高。然而,当电解液价态过高时,会引起正极电解液的转移电子数明显不足,造成两极电解液严重不平衡,从而加速钒离子在正负极两侧的扩散,降低了电池的电压效率和能量效率。因此,结合电池放电容量和效率结果,可知当电解液价态为3.67价时,钒电池性能为最优。
2.3 电解液价态偏高时正负极体积配比对电池性能的影响
考虑到负极体积过量及价态过量均为负极活性物质过量,但两者的电化学性能却截然不同,为了进一步核实负极电解液体积过量对电池性能的影响,采用3.67价溶液(相当于负极电解液转移电子数过量30%),通过调整负、正极体积比(N/P分别为1.0∶1.18、1.0∶1.06、1.0∶1.0和1.1∶1.0),分别研究了负极转移电子数过量10%、20%、30%、40%四种状态下电池的放电容量和效率变化规律。
图3为负、正极电解液不同体积比(N/P)的放电容量和效率循环曲线。如图3(a)所示,随着负极体积的增加,放电容量逐渐升高,这与增加3.50价电解液的体积造成放电容量增加的结果是一致的。但当电解液价态为3.67时,不同负极体积下钒电池的放电容量循环一段时间后趋于稳定,这一现象却不同于3.50价电解液,这说明负极电解液价态适当过量有利于钒电池的长期稳定性。
如图3(b)~3(d),当电解液体积比不同时它们的库仑效率变化较小,电压效率和能量效率却明显升高。当负极体积过量30%以上时,电池的电压效率和能量效率基本稳定,而库仑效率略有降低,这与3.50价电解液体积过量对效率的影响规律截然不同。同样为负极电解液体积过量,但电解液价态偏高时才会对钒电池能量转换效率具有明显影响,这说明电解液价态对电池性能的影响更大,在价态过量的基础上负极体积过量对电池性能的改善得到了有效放大。
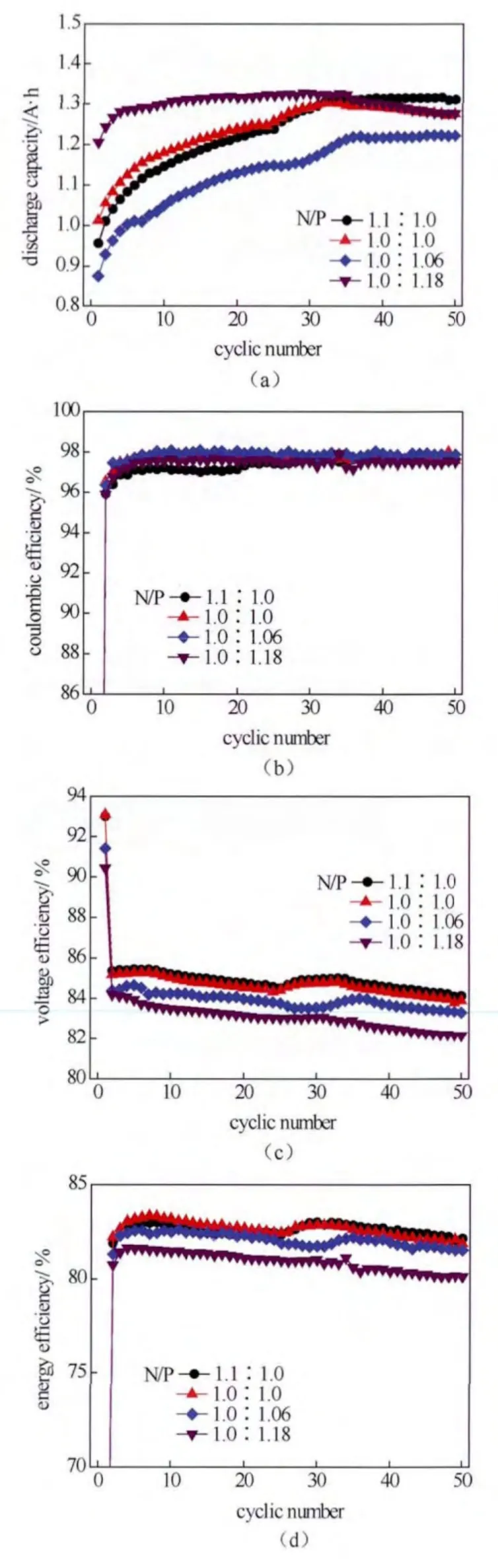
图3 3.67价钒电解液正负极不同体积比的放电容量循环曲线(a)、库仑效率循环曲线(b)、电压效率循环曲线(c)和能量效率循环曲线(d)Fig.3 The discharge capacity curves(a), coulombic efficiency curves(b), voltage efficiency curves(c), and energy efficiency curves(d) of 3.67 valence state with different volume ratio of cathode with anode
为了更进一步地确定正负极电解液价态和体积比对电池性能的影响,分别选取适量的3.50价和3.67电解液,其正负极体积比分别为1.3∶1和1∶1,通过式(2)和式(3)计算其转移电子数,均为负极转移电子数过量30%。图4为两种价态和配比的放电容量循环曲线和效率循环曲线。
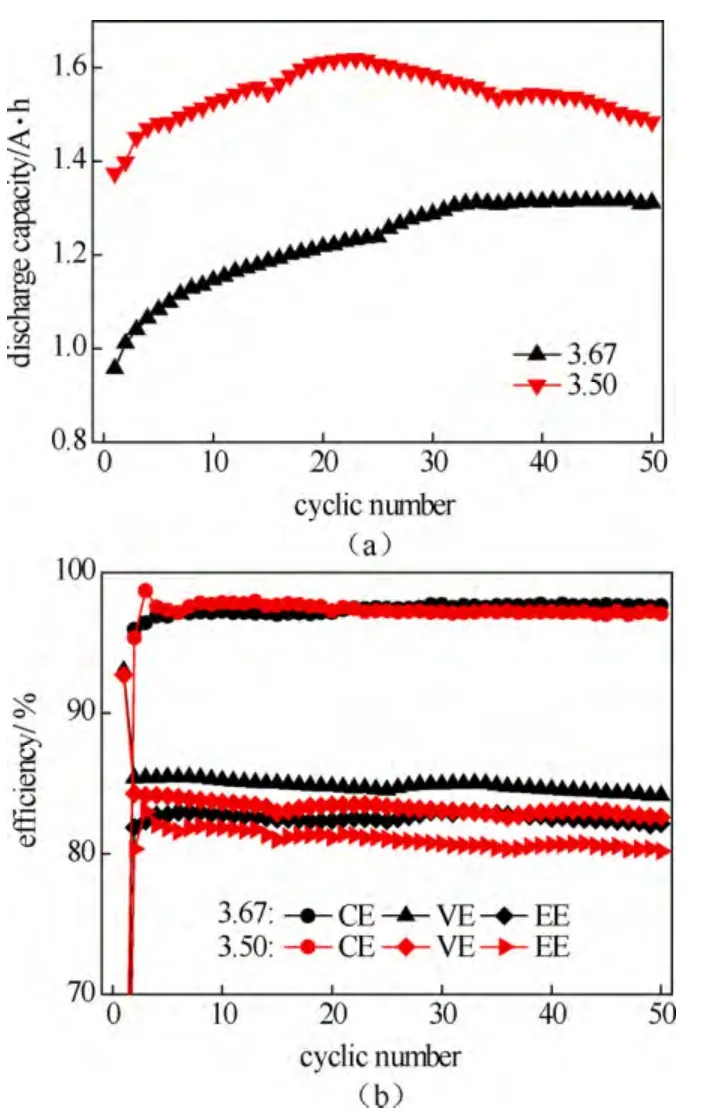
图4 3.5价、3.67价钒电解液在转移电子数相同时的放电容量循环曲线(a)和效率循环曲线(b)Fig.4 The discharge capacity curve(a) and efficiency curve(b) with cycles of 3.50 and 3.67 valence vanadium electrolyte with the same electron transfer number
由图4可以看出,通过调整电解液的正负极体积比来改变负极活性物质的含量主要影响的是电池的容量,对电池的能量转换效率并无明显改善;然而,通过调整钒电解液的价态来改变负极的转移电子数,虽然在一定程度上降低了电池的放电容量,但电池的能量转换效率得到了明显提高。究其原因,认为在钒电池充放电末期,活性物质浓度上的差异对其扩散驱动力、降低浓差极化具有较大的意义,而当体积过量时增加的仅为活性物质总的物质的量,而其关键作用的浓差驱动力并无明显改善,因此,电解液价态过量可以对钒电池性能的提高产生直接影响,而电解液体积的过量对钒电池性能的积极影响只能在浓度过量的基础上体现出来。
3 结 论
钒电池电解液配比对于钒电池的放电容量和能量转换效率具有显著影响,负极体积过量和价态过量虽然均能在一定程度上提高钒电池的性能,但它们的影响方式是不一样的。电解液价态匹配时(3.50价),保持正极电解液体积不变,单纯增加负极的体积,可提高电池的放电容量,但对电池的能量转换效率影响较小;电解液价态的升高会在一定程度上降低钒电池的放电容量,但其能量转换效率却呈现先升高后降低的抛物线规律;增加负极电解液体积和提高电解液价态均会导致负极活性物质过量,但后者对电池性能的影响更为显著,在后者的基础上前者对能量转换效率的影响也会被放大。
[1]Fabjana C,Garcheb J,Harrer B,et al.The vanadium redox-battery:An efficient storage unit for photovoltaic systems[J].Electrochimica Acta,2001,47:825-831.
[2]Piergiorgio A,Massimo G,Federico M.Redox f low batteries for the storage of renewable energy:A review[J].Renewable and Sustainable Energy Reviews,2014,29:325-335
[3]Rychcik M,Skyllas-Kazacos M.Characteristics of a new all-vanadium redox flow battery[J].Journal of Power Sources,1988,22(1): 59-67.
[4]Xu Weiguo(许维国),Liu Jianguo(刘建国),Qin Ye(秦野),et al.Development of electrolyte thermodynamic studies for vanadium flow battery[J].Energy Storage Science and Technology(储能科学与技术),2014,3(5):513-519.
[5]Hwang G J,Ohya H.Preparation of cation exchange membrane as a separator for the all-vanadium redox flow battery[J].Journal of Membrane Science,1996,120:55-67.
[6]Shah A A,Al-Fetlawi H,Walsh F C.Dynamic modelling of hydrogen evolution effects in the all-vanadium redox flow battery[J].Electrochimica.Acta,2010,55:1125-1139.
[7]Whitehead A H,Harrer M.Investigation of a method to hinder charge imbalance in the vanadium redox f low battery[J].Journal of Power Sources,2013,230:271-276.
[8]Ismailia L E,Jesse S W,Levi T T,et al.Performance of a non-aqueous vanadium acetylacetonate prototype redox flow battery:Examination of separators and capacity decay[J].Journal of the Electrochemical Society,2015,162(3):A363-A372 .
[9]Ngamsai K,Arpornwichanop A.Analysis and measurement of the electrolyte imbalance in a vanadium redox f low battery[J].Journal of Power Sources,2015,282:534-543.
[10]Agar E,Dennison C R,Knehr K W,et al.Identif ication of performance limiting electrode using asymmetric cell conf iguration in vanadium redox f low batteries[J].Journal of Power Sources,2013,225:89-94.
[11]Bourke A,Miller M A,Lynch R P,et al.Effect of cathodic and anodic treatments of carbon on the electrode kinetics of V4+/V5+oxidation-reduction[J].Journal of the Electrochemical Society,2015,162(8):A1547-A1555.
[12]Sun C N,Delnick F M,Douglas S,et al.Resolving losses at the negative electrode in all-vanadium redox flow batteries using electrochemical impedance spectroscopy[J].Journal of the Electrochemical Society,2014,161(6):A981-A988.
[13]Zhang Huamin(张华民).Flow Battery Technology[M].Beijing:Chemical Industry Press,2014.

