耐高温菌的分离及在固态发酵上部烟叶中的应用
李士林,王宜君,汤朝起,许赣荣
(1.江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122;2.上海烟草集团有限责任公司,上海 200082)
耐高温菌的分离及在固态发酵上部烟叶中的应用
李士林1,王宜君1,汤朝起2,许赣荣1
(1.江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122;2.上海烟草集团有限责任公司,上海 200082)
从上部低次烟叶中筛选出耐高温淀粉酶产生菌GW-2和耐高温蛋白酶产生菌GW-3,通过对菌落的形态观察、16S rRNA的鉴定和同源性分析,初步确定GW-2为解淀粉芽胞杆菌,GW-3为枯草芽胞杆菌。对上部低次烟叶进行双菌种固态发酵,并优化发酵条件,最佳发酵条件:GW-2菌悬液(OD600=1)接种量为7.5 mL/g,GW-3菌悬液(OD600=1)接种量为10 mL/g,物料填充度为500 mL三角瓶中装50 g烟叶干基,当烟叶发酵水分质量分数为45%时,48℃发酵5 d。在该发酵条件下,上部低次烟叶的淀粉降解率为22.33%,蛋白质降解率为16.74%。烟叶淀粉和蛋白质的质量分数较大幅度下降,其含量指标接近优等烟叶的含量。该发酵方式比传统的贮存式烟叶发酵大大缩短了发酵时间。
上部低次烟叶;耐高温有益菌;固态发酵;淀粉;蛋白质
国内优等烟叶中淀粉和蛋白质的质量分数一般在4%和7%左右[1],而本实验所涉及的上部低次烟叶中的淀粉、蛋白质的质量分数分别为7%以上和10%以上,较优等烟叶明显偏高,致使吸食后香气欠缺、较苦、刺激性大,目前只用于低档卷烟的配方中,或者直接丢弃,严重影响了卷烟行业的经济效益[2-4]。如果能降低上部低次烟叶中淀粉和蛋白质的含量,可有效减少烟叶在吸食过程中产生的辛辣味和刺激性,提高烟叶的利用价值,减少资源的浪费[5]。
烟叶表面定殖大量微生物,这些微生物在烟叶的贮存过程中对于改进烟叶品质发挥一定的作用。目前,利用人工接种微生物对烟叶进行发酵的研究也有不少报道,但是大多数研究均局限于低水分(发酵水分低于 20%)下的贮存式发酵[6-7]。在固态低水分状态下,微生物的生长代谢速度一般较为缓慢,因此会影响烟叶发酵陈化的速度。而烟叶在高水分发酵时,虽然可以加快发酵速度,但是也极易引起霉菌的生长。笔者在研究中发现,当烟叶发酵温度超过48℃时,未发现烟叶发霉现象。所以采用高温、高水分发酵的方法值得探索。从烟叶中筛选产淀粉酶和蛋白酶的耐高温微生物,并将其应用于烟叶的固态发酵,有可能加速并有效地降解低次烟叶中的淀粉和蛋白质,从而提高烟叶的品质。
1 材料与方法
1.1 材料与仪器
上部低次烟叶(2012年福建烟叶),由上海烟草集团有限责任公司提供;H2-2型电热恒温振荡水槽,上海精宏实验设备有限公司;UV 3000型紫外-可见分光光度计,日本Hitachi公司;FA 1004型电子天平,上海舜宇恒平科学仪器有限公司;PL602-S型电子天平,METTLER TOLEDO仪器上海仪器有限公司;PB-10型pH计,SartoriUs公司;Sartorius MA-40型红外线水分测试仪,德国赛多利斯公司;PYX-XHS-405型电热恒温培养箱,上海跃进医疗器械厂;SW-CJ-IFD型超净工作台,苏州安泰空气技术公司。
富集培养基(g/L):牛肉膏5.0,蛋白胨10.0, NaCl 5.0;pH 7.0~7.2。
种子液培养基:同富集培养基。
肉汤琼脂培养基(g/L):牛肉膏5.0,蛋白胨10.0,琼脂20.0,NaCl 5.0;pH 7.0~7.2。
斜面保藏培养基:同肉汤琼脂培养基。
淀粉液态培养基(g/L):蛋白胨 10.0,NaCl 5.0,可溶性淀粉20.0;pH 7.0~7.2。
淀粉琼脂培养基(g/L):蛋白胨 10.0,NaCl 5.0,可溶性淀粉20.0,酵母膏5.0,琼脂20.0;pH 7.0~7.2。
奶粉液态培养基:酵母膏5.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂20.0 g,去离子水900 mL。脱脂奶粉10 g,溶于100 mL去离子水中,121℃灭菌20 min。将二者在无菌环境下混匀。
奶粉琼脂培养基:于奶粉液态培养基中加20 g/L的琼脂。
以上培养基都调节pH至7.0~7.2,于121℃灭菌20 min。
豆芽汁培养基:黄豆芽200 g,蒸馏水1 L,煮沸15 min,用纱布过滤,加葡萄糖20.0 g,酵母膏0.5 g,pH自然,121℃灭菌20 min。
1.2 实验方法
1.2.1 耐高温淀粉酶产生菌和蛋白酶产生菌的分离筛选
耐高温菌的筛选 取粉碎后的烟叶末1.0 g,装入盛有100 mL富集培养基的500 mL三角瓶中,50℃、200 r/min摇床培养24 h。将培养液涂布到肉汤琼脂培养基平板中,于培养箱50℃恒温培养72 h,将生长出的细菌通过划线法获得单菌落后接入斜面保存。
初筛 将筛选出的单菌落分别点接种到淀粉培养基平板和奶粉培养基平板中,50℃培养24 h,筛选出的菌株接入斜面保藏。
筛选菌株发酵液酶活测定 将初筛得到的单菌落分别接种到含100 mL种子液培养基的500 mL三角瓶中,50℃、200 r/min摇床培养24 h,然后分别取2 mL菌液接种至100 mL淀粉液态培养基或奶粉液态培养基的500 mL三角瓶中,50℃、200 r/min培养72 h;发酵液于8 000 r/min离心5 min,取上清液测酶活。
菌株的复筛 取50 g烟叶,分别喷洒单一菌株的菌悬液5 mL,补水至烟叶水分质量分数为40%,将烟叶装入500 mL三角瓶中,50℃下发酵3 d,发酵结束后测烟叶的淀粉和蛋白质含量。分别筛选出淀粉和蛋白质降解率最高的菌株,接入斜面保藏。
1.2.2 种子菌悬液的制备
用接种针将斜面上的菌种点接到含100 mL种子液培养基的500 mL三角瓶中,37℃、200 r/min摇床培养24 h,然后分别取2 mL种子液接种至含100 mL豆芽汁培养基的500 mL三角瓶中,37℃、200 r/min摇床培养24 h,4 000 r/min离心5 min,取菌体,加适量无菌水,配制成OD600=1的菌悬液,用于人工接种发酵。
1.2.3 双菌种固态发酵方法
量取优化后的菌株菌悬液3.75 mL、优化后的菌种菌悬液10 mL均匀喷洒50 g烟叶(干基)中,补水使烟叶水分质量分数为45%。将烟叶均匀装入500 mL三角瓶中,于培养箱中48℃下发酵。
1.3 分析方法
1.3.1 发酵液淀粉酶和蛋白酶酶活的测定
采用3,5-二硝基水杨酸(DNS)法[8]测定淀粉酶活性。温度为50℃时,1 min催化分解淀粉生成1 mg麦芽糖所需酶量定义为1个酶活(U),对3个平行样品进行测定。
1.3.2 蛋白酶酶活测定
采用Folin-酚试剂显色法[9]测定蛋白酶活性。温度为50℃时,1 min生成1 μg酪氨酸所需酶量定义为1个酶活(U),对3个平行样品进行测定。
1.3.3 细菌的形态特征
将37℃培养48 h的平板进行菌落形态观察,将37℃培养24 h的种子液进行革兰氏染色,在油镜下观察细菌的形态,参照文献[10]。
1.3.4 16S rDNA序列分析
所用引物为细菌 16S rDNA的通用引物。16SF:5′-AGAGTTTGATCCTGGCTCAG-3′;16SR:5′-TACGGCTACCTTGTTACGACTT-3′由上海生工生物工程技术服务有限公司合成。
扩增(PCR)反应体系(25 μL)为 dNTP(10 mmol/L)0.5 μL,10×PCR缓冲液2.5 μL,Mg2+(20 mmol/L)2 μL,引物(20 μmol/L)各0.5 μL,模板DNA(约50 ng/μL)1 μL,Taq酶(5 U/μL)0.2 μL,补水至25 μL。
扩增(PCR)程序:95℃预变性5 min,94℃变性30 s,52℃退火45 s,72℃延伸60 s,35个循环;最后72℃延伸8 min。扩增产物用0.75%的琼脂糖凝胶电泳回收,纯化后的产物进行测序,测序后获得的16S rDNA序列登录http://blast.ncbi.nlm.nih. gov/Blast.cgi网站,用BLAST程序进行序列比对分析,应用ClustalX、Mega4软件,采用Neighbor-Joining法(邻接法)建立进化树状图。
1.3.5 烟叶化学成分的测定
烟叶水分的测定采用红外快速水分测定仪测定;烟叶水溶性总糖及淀粉的测定参照文献[11];总氮、蛋白质测定采用凯氏定氮法;烟碱含量采用紫外分光光度法。淀粉和蛋白质的降解率的计算见式(1)和式(2)。

2 结果与讨论
2.1 耐高温淀粉酶产生菌的初筛结果
经50℃平板培养,初筛获得5株耐高温细菌(编号为GW-1~GW-5)。利用淀粉琼脂培养基对这5株菌进行复筛,发现其中4株菌GW-1、GW-2、GW-4和GW-5具有淀粉降解能力,GW-3没有淀粉降解能力。所测得的淀粉水解透明圈与发酵液淀粉酶活力如表1所示。

表1 4株菌的淀粉水解透明圈及发酵液淀粉酶活力Table 1 Starch hydrolysis halos and amylase activities of 4 strains
由表1比较不同菌种在平板上的透明圈直径/菌落直径值以及发酵液淀粉酶活力发现,GW-5的透明圈直径/菌落直径比值最大,GW-2的发酵液淀粉酶活力最高。鉴于鉴定培养基与烟草发酵基质成分上存在差异性,本研究进一步将4株菌接种至烟叶发酵基质进行发酵实验考察烟叶中淀粉的降解情况,对照组为不接种烟叶,结果如图1所示。

图1 不同菌株发酵后烟叶淀粉降解率的比较Fig.1 Comparison of starch decomposition rates of tobacco leaf after fermentation
由图1可见:4株淀粉酶产生菌均对烟叶中的淀粉有不同程度的降解,其中GW-2菌株的淀粉降解率最高,故选择GW-2为最佳发酵菌株。
2.2 耐高温蛋白酶产生菌株的筛选
利用奶粉琼脂培养基对5株菌进行复筛,发现GW-1、GW-2、GW-3、GW-4和GW-5具有蛋白质降解能力。所测得的蛋白质水解透明圈与发酵液淀粉酶活力如表2所示。

表2 5株菌的蛋白质水解透明圈及发酵液蛋白酶活力Table 2 Protein hydrolysis halos and protease activities of 5 strains
由表2比较不同菌种在平板上的透明圈直径/菌落直径比值以及发酵液蛋白酶活力发现,GW-3的透明圈直径/菌落直径比值最大,GW-4的发酵液蛋白酶活力最高。鉴于鉴定培养基与烟草发酵基质成分上存在差异性,本研究进一步将5株菌接种至烟叶发酵基质进行发酵实验考察烟叶中淀粉的降解情况,对照组为不接种烟叶,结果如图2所示。
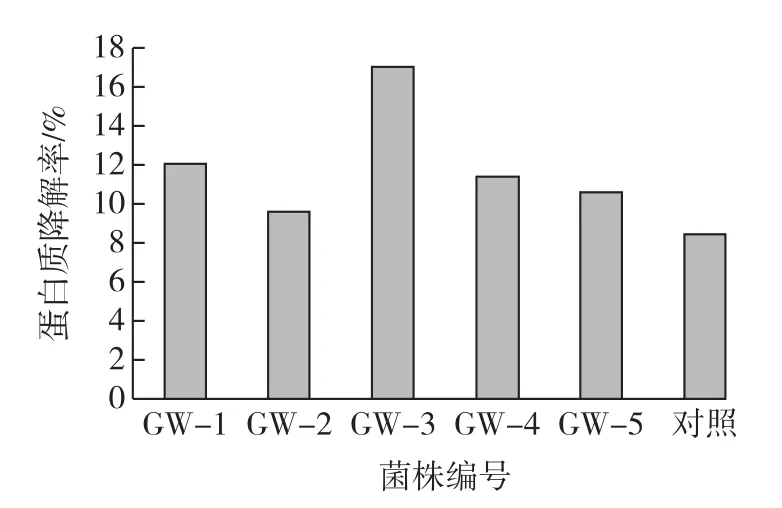
图2 不同菌株发酵后烟叶蛋白质降解率的比较Fig.2 Comparison of protein decomposition rates of tobacco leaf after fermentation
由图2可见:发酵结束后,5种菌对烟叶蛋白质都有不同程度的降解,GW-2菌株虽然有蛋白酶酶活性,但是在发酵过程中烟叶蛋白质降解率与对照组相差不大,说明此菌株在烟叶发酵中没有表现出蛋白酶酶活性。GW-3的淀粉降解率最高,故选择GW-3为最佳发酵菌株。
2.3 GW-2与GW-3的形态观察
经平板培养48 h后观察,GW-2菌落呈花瓣形状,淡黄色不透明,菌落中间呈脉状;GW-3菌落呈淡黄色不透明,边缘不整齐,中间凸起。经液态培养24 h后显微镜观察,GW-2菌株呈短杆状,GW-3菌株呈球状或椭圆状,经革兰氏染色后,两株菌均呈阳性。
2.4 GW-2与GW-3的16S rRNA序列分析
GW-2菌株的16S rRNA序列全长为1 413 bp,用BLAST进行比对,比对结果表明GW-2与解淀粉芽胞杆菌的同源性为100%,初步确定GW-2菌株为解淀粉芽胞杆菌。菌株GW-3菌株的16S rRNA序列全长1 404 bp,用BLAST进行比对,比对结果表明GW-3与枯草芽胞杆菌的同源性为100%,初步确定GW-3菌株为枯草芽胞杆菌,经比对构建树状图,如图3所示。
2.5 双菌种固态发酵上部低次烟叶发酵条件的确定
2.5.1 GW-3菌株菌悬液接种量的确定
由于上部低次烟叶蛋白质含量过高,从而导致烟叶辛辣味,所以降低蛋白质的含量是首要目标。本实验中,笔者设计GW-3菌株菌悬液接种量为2.5~15(mL/g),发酵结束后测得烟叶蛋白质降解率,如图4所示。
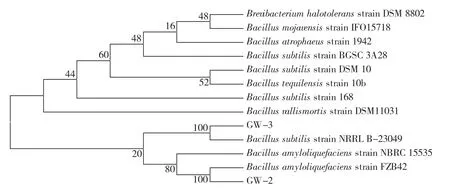
图3 GW-2和GW-3的16S rDNA序列系统发育进化树Fig.3 Phylogenetic trees of 16S rDNA of GW-2 and GW-3 strain

图4 GW-3接种量对烟叶蛋白质降解率的影响Fig.4 Effects of inoculum of GW-3′s bacterial suspension on decomposition rate of protein in tobacco
由图4可见:蛋白质的降解率随着GW-3菌悬液用量的增加而升高,当接种量为10 mL/g时,蛋白质降解率达到最大值,之后随着接种量的增加,蛋白质降解率基本不变。
2.5.2 GW-2菌悬液接种量的确定
设计GW-3接种量为10 mL/g,GW-2接种量为2.5~12.5 mL/g,发酵结束后烟叶淀粉和蛋白质降解率如图5所示。
由图5可见:当GW-2接种量达到7.5 mL/g时,蛋白质的降解率开始有所下降,这可能是GW-2生物量过多,影响了 GW-3的代谢。故选择GW-2的接种量为7.5 mL/g。
2.5.3 物料填充度的影响
固态发酵时,烟叶物料填充度的大小会影响O2的传递,进而影响微生物的生长。设计物料填充度范围为每500 mL三角瓶中30~80 g烟叶干基,发酵结束后测得烟叶淀粉和蛋白质降解率,如图6所示。

图5 GW-2接种量对烟叶淀粉和蛋白质降解率的影响Fig.5 Effects of inoculum of GW-2′s bacterial suspension on decomposition rate of starch and protein in tobacco
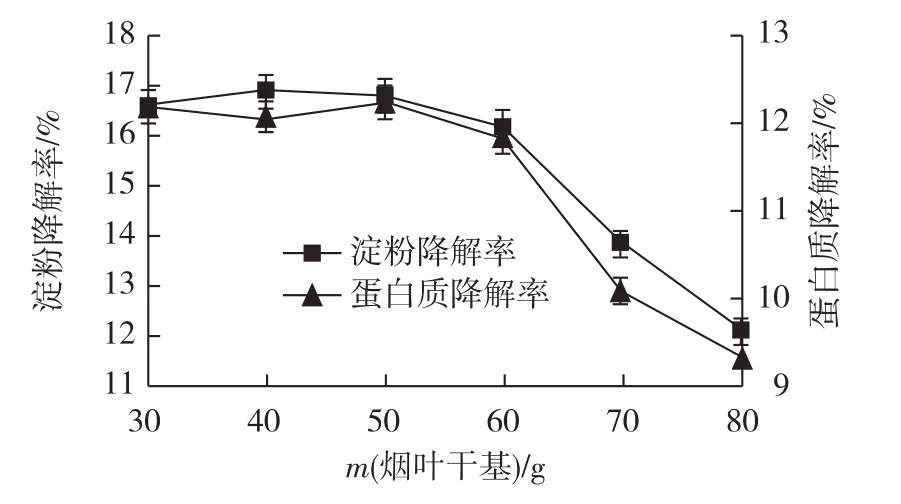
图6 物料填充度对烟叶淀粉和蛋白质降解率的影响Fig.6 Effects of filling degree on decomposition rate of starch and protein in tobacco
由图6可见:填充度为30~50 g烟叶干基时,淀粉和蛋白质的降解率维持较高且基本不变;当填充度超过50 g烟叶干基时,淀粉和蛋白质的降解率会随着填充度的增大而降低。为了节省空间,最佳物料填充度确定为每500 mL三角瓶中填充50 g烟叶干基。
2.5.4 发酵温度的影响
当发酵水分质量分数达30%以上时,发酵温度只有到达48℃以上时霉菌才不能生长,而发酵温度过高会使烟叶变黑,故设置本实验发酵温度为48、50、52、54和56℃,烟叶淀粉和蛋白质降解率结果如图7所示。

图7 发酵温度对烟叶淀粉和蛋白质降解率的影响Fig.7 Effects of fermentation temperatures on decomposition rate of starch and protein in tobacco
由图7可见:烟叶淀粉和蛋白质的降解率随着发酵温度的升高而下降,虽然2株菌都可以在48℃下生长,但温度的升高也会抑制菌体的生长活动。所以本实验的发酵温度确定为48℃。
2.5.5 烟叶物料水分的影响
水分是影响固态发酵的重要条件,水分的高低影响着微生物的生长代谢活动。研究不同发酵水分质量分数对发酵后烟叶的淀粉和蛋白质的降解率的影响,结果如图8所示。
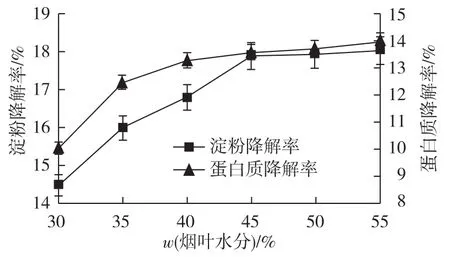
图8 发酵水分质量分数对烟叶淀粉和蛋白质降解率的影响Fig.8 Effects of tobacco leaf moisture content on decomposition rate of starch and protein in tobacco
由图8可见:发酵结束后上部低次烟叶淀粉和蛋白质降解率随着发酵水分的增加而逐渐提高。当发酵水分质量分数超过45%时,淀粉和蛋白质降解率变化趋缓。考虑到水分过高,发酵后烟叶的颜色变深,发酵水分宜低不宜高,故发酵水分质量分数选择45%。
2.5.6 发酵时间的影响
发酵时间对微生物生长及其代谢产物有重要的影响。在确定其他发酵条件下,设计不同的发酵时间,发酵结束后烟叶淀粉和蛋白质的降解率如图9所示。
烟叶在高水分高温度发酵过程中,烟叶的形状和颜色随着发酵时间的延长而变化严重,因此应该尽量缩短发酵时间。本实验在发酵第5天时,淀粉和蛋白质的降解率达到 22.33%和16.74%。淀粉和蛋白质的质量分数降低至5.80%和8.49%,已经达到优等烟叶的含量要求,而且从图9中还可看出,延长发酵时间,对提高烟叶中淀粉和蛋白质的降解率没有明显的作用。故本实验决定发酵时间为5 d。

图9 发酵时间对烟叶淀粉和蛋白质降解率的影响Fig.9 Effects of fermentation time on decomposition rate of starch and protein in tobacco
2.5.7 发酵结束后上部低次烟叶化学成分变化
将2.5.6中发酵结束的烟叶进行化学成分的测定,结果如表3所示。
由表3可见:发酵结束后的烟叶较原烟叶淀粉和蛋白质质量分数大幅度降低,水溶性总糖质量分数略有上升,总氮和烟碱质量分数略有下降。烟碱的下降也会提高烟叶的利用价值。
施木刻值和糖氮比是衡量烟叶品质的重要标准。优等烟叶的施木刻值为2~2.5,糖氮比为(6~10)∶1[1]。发酵结束后的烟叶施木刻值更加接近2,糖氮比更加接近6,烟叶的化学成分变得更加协调,烟叶的品质得到了明显的改善。

表3 双菌种发酵结束后烟叶的主要化学成分及其变化Table 3 Changes of chemical composition in tobacco after fermentation by two strains
3 结论
从上部低次烟叶中筛选出耐高温淀粉酶产生菌GW-2和耐高温蛋白酶产生菌GW-3,通过对2株菌菌落的形态观察和16S rRNA的鉴定,初步鉴定为解淀粉芽胞杆菌和枯草芽胞杆菌。利用2株菌对上部低次烟叶进行双菌种固态发酵,并对发酵条件进行优化,结果表明,上部低次烟叶双菌种固态发酵的最佳发酵条件:GW-2菌悬液(OD600=1)接种量为7.5 mL/g,GW-3菌悬液(OD600=1)接种量为10 mL/g,物料填充度为每500 mL三角瓶中添加50 g烟叶干基,发酵温度为48℃,烟叶水分为45%,发酵时间为5 d。在该发酵条件下,上部低次烟叶的淀粉降解率为22.33%,蛋白质降解率为16.74%。烟叶淀粉和蛋白质的含量得到了较大幅度的下降,基本达到了优等烟叶的含量要求。
与传统的烟叶自然陈化相比,笔者所采用的高水分双菌种固态发酵方法最大的优点在于能短时间内大幅度降解上部低次烟叶中淀粉和蛋白质的含量,而且由于采用高温发酵,基本上可杜绝霉菌的生长,避免烟叶发霉产生异味。但固态高温发酵对烟叶香气成分及吸味的影响还有待于进一步考察。
[1]肖协忠.烟草化学[M].北京:中国农业科技出版社,1997:48-52.
[2]王静,王安亭.废次烟叶的综合利用研究[J].洛阳大学学报,2007(4):51-55.
[3]饶国华,赵谋明,林伟锋,等.中国低次烟叶资源综合利用研究[J].资源科学,2005(5):120-127.
[4]郑奎玲,余丹梅.废弃烟叶的综合利用现状[J].重庆大学学报:自然科学版,2004(3):61-64.
[5]李少鹏.利用生物技术降解烟叶淀粉和蛋白质含量研究[D].郑州:河南农业大学,2006.
[6]谢和,赵维娜.利用枯草芽孢杆菌提高烤烟质量[J].山地农业生物学报,1998,17(4):205-207.
[7]罗家基,朱子高,罗毅.微生物在烟叶发酵过程中的作用[J].烟草科技,1998,1(6):6-8.
[8]董晓燕.生物化学实验[M].北京:化学工业出版社,2007.
[9]诸葛健,王正祥.工业微生物实验技术手册[M].北京:中国轻工业出版社,1994.
[10]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2008.
[11]尹建雄,卢红,谢强,等.3,5-二硝基水杨酸比色法快速测定烟草水溶性总糖、还原糖及淀粉的探讨[J].云南农业大学学报:自然版,2007,22(6):829-838.
(责任编辑 管 珺)
Isolation and application of thermotolerant bacterials to solid-state
fermentation of upper-leaves of tobacoo
LI Shilin1,WANG Yijun1,TANG Zhaoqi2,XU Ganrong1
(1.The Key Laboratory of Industrial Biotechnology of the Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.Shanghai Tobacco Group Co.Ltd.,Shanghai 200082,China)
In this study,two thermotolerant strains were isolated from tobacoo leaves.One is an amylase producing bacterial strain named GW-2 and another is a protease producing bacterial strain named GW-3.By morphological observation of colonies and 16S rRNA sequence homology analysis,they were identified as Bacillus subtilis and Bacillus amyloliquefaciens.Then the two strains were used for tobacco solid-state fermentation,and the condition was optimized by monofactorial experiments.The experimental results show that the best conditions for solid-state fermentation were that:inoculum of bacterial suspension(OD600=1)of GW-2 and GW-3 were 7.5 mL/g and 10 mL/g,respectively,charge amount of tobacoo was 50 g(500 mL flask),fermentation temperature was 48℃,moisture content of the tobacco was 45%and fermentation time was 5 d.Under these conditions of solid-state fermentation,the starch and protein decomposition rates in the upper leaves of flue-cured tobacco were 22.33%and 16.74%,respectively.The content of starch and protein in the upper leaves of flue-cured tobacco was close to the standard of the top quality tobacco.In this way,the fermentation time was greatly shortened than traditional storage fermentation.
upper leaves of flue-cured tobacco;thermotolerant bacterials;solid-state fermentation;starch;protein
Q93
A
1672-3678(2015)01-0035-07
10.3969/j.issn.1672-3678.2015.01.007
2013-12-13
上海烟草集团有限责任公司科技项目(SZBCW201000744)
李士林(1987—),男,山东临沂人,硕士研究生,研究方向:发酵工学;许赣荣(联系人),教授,E-mail:grxu123@126.com

