Gibberella intermedia CA3-1羟基化去氢表雄酮的工艺
付珍珍,李 恒,李 会,许正宏
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 药学院,江苏 无锡 214122)
Gibberella intermedia CA3-1羟基化去氢表雄酮的工艺
付珍珍1,李 恒2,李 会2,许正宏2
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 药学院,江苏 无锡 214122)
利用Gibberella intermedia CA3-1对甾体化合物去氢表雄酮(DHEA)进行C7α-羟基化反应研究。用单因素实验的方法考察接种量、装液量、转速、有机溶剂助溶、投料浓度以及底物投加时间对产物7α-羟基去氢表雄酮(7α-OH-DHEA)生成的影响。最终确定最适工艺条件:接种量6%,装液量30 mL(250 mL三角瓶),转速220 r/min,体积分数6%丙二醇助溶,接种时即添加底物,底物DHEA质量浓度1 g/L,转化时间36 h。采用优化后的转化条件,7α-OH-DHEA摩尔得率为72.34%。
生物转化;7α-羟基化;去氢表雄酮;甾体;Gibberella intermedia
自开展甾体化合物研究以来,甾体药物在医疗领域的应用范围便不断扩大,被用于治疗多种疾病[1]。其中,甾体化合物去氢表雄酮(DHEA)及其羟化物被证实具有重要的生理活性和药理作用,是甾体药物研究领域的重点。国外研究报道,DHEA及其代谢产物能够促进机体的免疫应答[2]。进一步研究发现,DHEA的7α-羟基衍生物7α-OHDHEA具有抗氧化、抗肿瘤以及免疫调节等重要的药理作用[3]。7-羟基甾体化合物已经被证实对治疗癌症和阿尔茨海默病有一定疗效,此外它还具有增强机体免疫功能、抗糖皮质激素作用和促进减肥的功效[4]。
微生物对甾体底物的羟基化反应是利用微生物代谢过程中的某一种酶或一组酶对外源性化合物进行催化反应[5],具有立体选择性、区域选择性、反应条件温和、催化效率高、反应类型多、污染环境小等特点,在甾体的生物转化中具有重要的地位和意义[6-7]。DHEA用Fusarium moniliforme和Mortierella isabellina AM212进行生物羟化的产物是7α-OHDHEA和7β-OH-DHEA[8]。Romano等[9]也研究证实Colletotrichum lini可以同时使DHEA发生7α-和15α-羟基化。根据已报道的文献,DHEA最大投料质量浓度为1 g/L,7α-OH-DHEA的最高收率为60.2%,且转化周期为4 d[10]。筛选具有羟化DHEA生成7α-OH-DHEA的菌株,并且提高其底物添加浓度和转化效率有重要的意义。
赤霉菌Gibberella intermedia CA3-1是笔者所在实验室筛选得到的具有羟化DHEA生成7α-OH-DHEA的菌株,但目前该菌株转化能力仍然偏低。文中笔者对Gibberella intermedia CA3-1羟化DHEA生成7α-OHDHEA的条件进行优化,以期提高产物得率。
1 材料与方法
1.1 材料
1.1.1 菌种
赤霉菌Gibberella intermedia CA3-1由笔者所在实验室成员筛选得到,保藏在中国微生物菌种保藏管理委员会普通微生物中心,编号为CGMCC No.4903。
1.1.2 试剂
DHEA、7α-OH-DHEA均为分析纯,由浙江仙居君业药业有限公司提供;二甲基亚砜(DMSO)、N,N-二甲基甲酰胺(DMF)、乙醇、丙三醇、甲醇、丙二醇、丙酮,均为化学纯,国药集团化学试剂苏州有限公司;乙腈,色谱纯,国药集团化学试剂苏州有限公司;其他试剂为市售分析纯。
1.1.3 培养基
斜面培养基(g/L):葡萄糖5、酵母粉10、NaCl 5、KH2PO415、琼脂20,pH 7.0。
种子培养基(g/L):葡萄糖5、酵母粉10、NaCl 5、KH2PO415,pH 7.0。
转化培养基(g/L):葡萄糖15、酵母粉15、玉米浆2.0、NaCl 5,pH 6.5。
1.2 培养和转化方法
1.2.1 种子培养
在500 mL三角瓶中加入50 mL培养液,121℃灭菌20 min,然后将活化后的菌种接入三角瓶,在30℃、220 r/min的恒温摇床上培养24 h。
1.2.2 菌体培养
在250 mL三角瓶中装入30 mL培养液,121℃灭菌20 min,将种子液以体积分数为4%接种量接种至发酵培养基中,在30℃、200 r/min的恒温摇床上培养24 h。
1.2.3 生物转化
准确称取一定量的DHEA加入到已培养24 h的菌液中,或者将底物溶于不同的有机溶剂中,超声5 min以加速底物的溶解,然后加入到已培养24 h的菌液中,在30℃、220 r/min的恒温摇床上转化培养48 h,每隔一定时间取样检测转化效果。
1.3 分析方法
1.3.1 质谱分析
电离源电喷雾电离(ESI);毛细管电压2.80 kV;锥空电压40 V;源温度110℃;脱溶剂温度350℃。
1.3.2 高效液相色谱法[11]
取一定量发酵液,用等体积乙酸乙酯萃取4次,合并萃取液并烘干。用5倍体积的乙腈复溶,0.25 μm有机滤膜过滤,采用高效液相色谱(HPLC)进行测定。对照标准曲线计算含量。测定条件:C18柱,流动相 V(乙腈)∶V(水)=70∶30;流速为 0.5 mL/min;进样量为10 μL;柱温为30℃。
1.3.3 计算方法
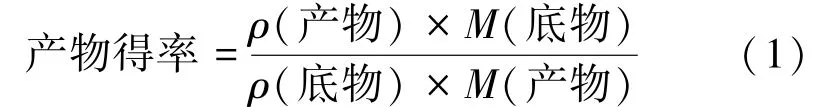
式中:ρ(产物)为液相测得的产物质量浓度(g/L);ρ(底物)为投加的底物质量浓度(g/L);M(底物)与M(产物)分别为底物与产物的摩尔质量(g/mol)。
2 结果与讨论
2.1 转化产物分析
2.1.1 转化产物高效液相色谱分析
赤霉菌Gibberella intermedia CA3-1对DHEA的转化液高效液相检测结果如图1所示。化合物3为底物,1和2分别为转化产物。图2为产物标准品的高效液相检测结果。由图1和图2可以看出,标准品和转化产物2的保留时间一致,可以初步确定产物2为7α-OH-DHEA。
2.1.2 转化产物质谱分析
赤霉菌Gibberella intermedia CA3-1对DHEA的转化液质谱检测结果如图3所示。通过分析可得到结果:MS(ESI)m/z[2M+NH4]+626.3、[3M+NH4]+930.6。结果表明样品的相对分子质量为304.2,与7α-OH-DHEA(C19H28O3)的相对分子质量一致。
加工食物吃太多:加工食物含有大量的添加剂,这些添加剂中的化学成分都需要依靠肝脏解毒代谢。如果长期摄入加工食物,无形中增加肝脏负担,容易引发慢性肝损伤。
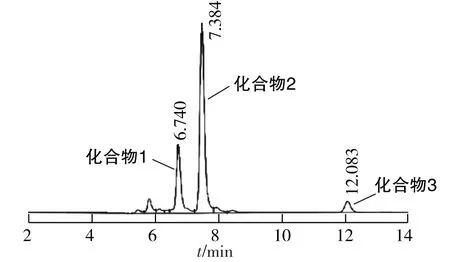
图1 Gibberella intermedia CA3-1转化DHEA的产物高效液相色谱图Fig.1 HPLC of transformation products of DHEA by Gibberella intermedia CA3-1

图2 7α-OH-DHEA标准品的高效液相色谱图Fig.2 HPLC of 7α-OH-DHEA standard

图3 Gibberella intermedia CA3-1转化DHEA产物的质谱Fig.3 MS of transformation products of DHEA by Gibberella intermedia CA3-1
2.2 接种量对转化的影响
选择不同接种量进行发酵培养,研究其对转化的影响,结果如图4所示。由图4可知:DHEA质量浓度为 3 g/L、接种量为 6%时,产物 7α-OHDHEA得率最高,为28.35%。在发酵过程中,接种量过大,生物量过大造成菌液黏稠,对转化过程溶氧不利;接种量过小,菌体生长过慢,同样不利于转化[12],故最佳接种量为6%。

图4 接种量对生物量及产物得率的影响Fig.4 Effects of inoculation amount on biomass of bacteria and product yield
2.3 装液量和转速对转化的影响
图5和图6是装液量和转速对转化的影响。由图5和图6可知,装液量和转速对7α-OH-DHEA的得率影响很大。250 mL三角瓶中装液量为30 mL时,产物得率最大。甾体羟化是一个耗氧过程[13],装液量较多,溶氧下降,进而导致转化效果不佳。在一定范围内,增加摇瓶转速,溶氧水平相应增加,可提高产物得率。在220 r/min时,产物得率较高,达到30.22%,但继续增加转速,得率反而下降。转速过大,菌体受到较强的剪切作用,不利于菌体的生长,生物量下降。所以,装液量选择为30 mL,转速为220 r/min较佳。

图5 装液量对生物量及产物得率的影响Fig.5 Effects of liquid volume in flask on biomass of bacteria and product yield
2.4 底物助溶剂种类及添加量
2.4.1 底物助溶剂种类
甾体化合物DHEA在水中的溶解度很低[14],属于微溶或难溶化合物,而甾体羟化酶属于胞内酶,底物只有通过扩散进入细胞才能与酶接触,从而进行转化反应,这就限制了底物和胞内羟化酶的有效接触和反应。甾体底物的难溶性对生物羟化反应的速率和产物得率有重要的影响,是导致转化效率偏低的重要原因之一。目前,在甾体生物转化中常用添加助溶剂的方法提高底物在水相的浓度。本研究中笔者以有机溶剂对底物的溶解性以及其对菌体的毒性为依据,选择7种常用的有机助溶剂,包括DMSO、DMF、乙醇、丙三醇、甲醇、丙二醇和丙酮来提高底物DHEA在转化液中的浓度和分散度,助溶剂对7α-OH-DHEA得率影响如图7所示。由图7可见:与对照相比,在菌液中加入体积分数4%的助溶剂丙二醇后,产物得率有明显提高,故选择丙二醇作为最佳助溶剂。
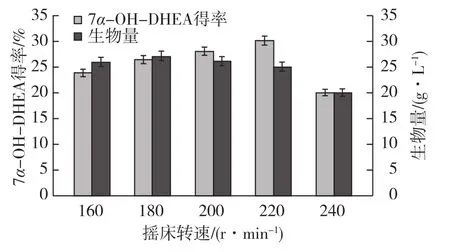
图6 摇床转速对生物量及产物得率的影响Fig.6 Effects of rotation speed on biomass of bacteria and product yield

图7 不同有机助溶剂对产物得率的影响Fig.7 Effects of different organic solvents on product yield
助溶剂的加入量控制至关重要,考察丙二醇的添加浓度对7α-OH-DHEA得率的影响,结果如图8所示。由图8可知:丙二醇体积分数由2%增至6%,产物 7α-OH-DHEA得率由 35%增加到42.12%,但过高浓度的丙二醇会对菌体生长产生影响,抑制细胞中羟化酶的活性,导致产物得率明显降低。因此,丙二醇的体积分数应控制在6%。

图8 丙二醇体积分数对产物得率的影响Fig.8 Effects of propylene glycol concentrations on product yield
2.5 投料浓度对转化的影响
底物DHEA加入量过少会导致微生物的羟化能力得不到充分利用,增加生物转化的批次和成本,而过高浓度的底物对菌体有一定的毒害性,影响菌体正常的生长和代谢,导致菌体对底物的转化能力下降,故需要选择最适的底物添加浓度[15]。投料浓度对转化的影响如图9所示。由图9可知,7α-OH-DHEA得率随底物浓度的增加而显著降低,底物质量浓度较低时(1 g/L),产物得率最高,达56.78%。
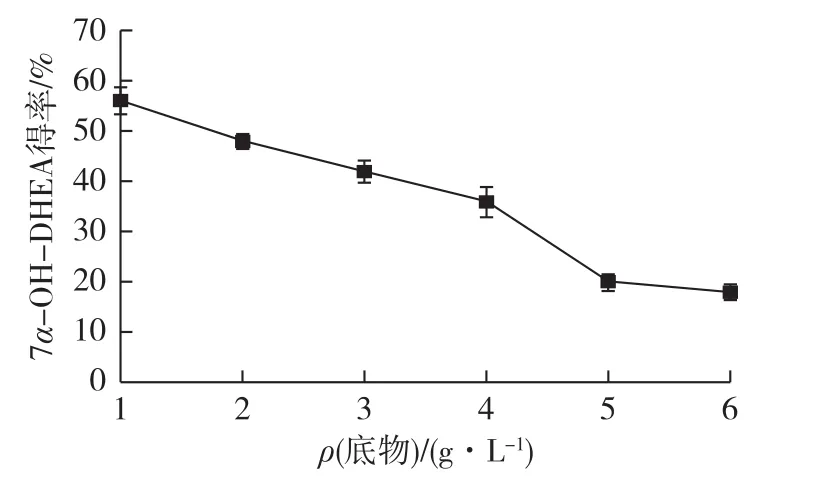
图9 底物投料质量浓度对产物得率的影响Fig.9 Effects of substrate mass concentrations on product yield
2.6 底物投加时间对转化的影响
羟化酶为诱导酶,能被底物诱导,故底物的添加时间往往对转化效果产生显著影响[16]。
因此,分别在赤霉菌生长不同时期加入底物,转化过程取样检测,以转化过程中的最高得率作为此条件下的产物得率,结果如表1所示(表中转化周期指接种到转化结束的时间)。由表1可知:在0 h时,即菌体开始培养时添加质量浓度为1 g/L的底物,转化36 h,此时产物得率最大,达到72.34%,高于初始条件下菌体培养24 h时添加底物。在该条件下既能对羟化酶进行预诱导,得到最高产物得率,同时也减少菌体培养时间,从而缩短了整个转化周期,且菌体培养和转化时间均短于文献报道水平[10]。

表1 底物投加时间对产物得率的影响Table 1 Effects of feeding time on product yield
2.7 转化过程分析
在最佳工艺条件下,对 Gibberella intermedia CA3-1转化DHEA的过程进行分析,结果如图10所示。由图10可知:转化产物主要在对数生长期后期至稳定期快速生成,在36 h时,摩尔产物得率达到最高(72.34%);转化36 h后产物得率开始快速下降,分析其原因是由于产物继续被转化为其他副产物。因此,转化时间控制在36 h利于目的产物的生成。
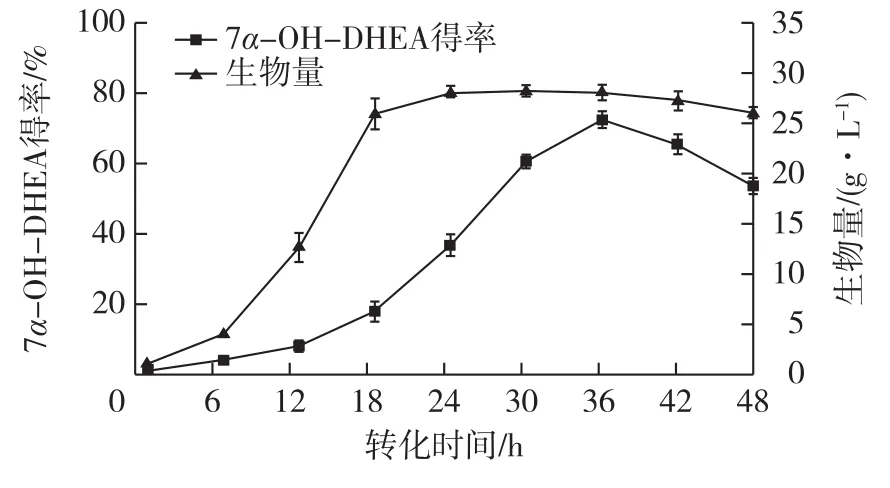
图10 Gibberella intermedia CA3-1转化DHEA的过程曲线Fig.10 Process curves of DHEA transformation by Gibberella intermedia CA3-1
3 结论
通过单因素试验探讨了接种量、装液量、转速、有机溶剂助溶、投料浓度以及底物投加时间对产物7α-OH-DHEA生成的影响,结果发现:6%接种量、装液量30 mL(250 mL三角瓶)、转速220 r/min、底物质量浓度1 g/L条件下,用体积分数6%丙二醇助溶,菌体开始培养时即投入底物,转化时间36 h,此时产物收率最高,达到72.34%,高于文献报道水平。作为 1株高羟化能力的新菌株,Gibberella intermedia CA3-1的培养时间和转化周期短、投料工艺简单、菌体形态均匀、副产物易分离,为工业化生产奠定了基础。然而,对于工艺的溶料方式及添加因子、放大条件等因素还有待进一步确定和优化。
[1]梁剑光,黄鹏,徐正军.重要甾体医药中间体的微生物转化研究进展[J].化工中间体,2008,4(11):20-23.
[2]Solerte S B,Fioravanti M,Vignati G,et al.Dehydroepiandrosterone sulfate enhances natural killer cell cytotoxicity in humans via locally generated immunoreactive insulin-like growth factor I[J].J Clin Endocrinol Metab,1999,84(3):3260-3267.
[3]Marie A P,Catherine T,Marie I M,et a1.Antioxidant effects of dehydroepiandrosterone and 7α-hydroxy-dehydroepiandrostrerone in the rat colon,intestine and liver[J].Steroids,2004,69(2):137-144.
[4]葛文中,李楠,姜宫凌侠.甾体C7-羟基化研究进展[J].生物技术通报,2007(2):82-86.
[5]Bernhardt R.Cytochromes P450 as versatile biocatalysts[J].J Biotechnol,2006,124(1):128-145.
[6]Woodley J M.New opportunities for biocatalysis:making pharmaceutical processes greener[J].Trends Biotechnol,2008,26(6):321-327.
[7]Donova M V,Egorova O V.Microbial steroid transformations:current state and prospects[J].Appl Microbiol Biotechnol,2012,94(6):1423-1447.
[8]Kołek T,Milecka N,Šwizdor A,et al.Hydroxylation of DHEA,androstenediol and epiandrosterone by Mortierella isabellina AM212.evidence indicating that both constitutive and inducible hydroxylases catalyze 7α-as well as 7β-hydroxylations of 5-ene substrates[J].Org Biomol Chem,2011,9(15):5414-5422.
[9]Romano A,Romano D,Ragg E,et al.Steroid hydroxylations with Botryodiplodia malorum and Colletotrichum lini[J].Steroids,2006,71(6):429-434.
[10]葛文中,李楠,单丽红,等.总枝状毛霉对去氢表雄酮的生物转化研究[J].微生物学杂志,2007,27(1):14-17.
[11]Li H,Fu Z,Li H,et al.Improvement of the steroid dihydroxylation efficiency from dehydroepiandrosterone using a substrate preinduction biotransformation process[J].Biotechnol Bioproc Eng,2013,18(3):486-490.
[12]徐银,陈小龙,郑裕国.雅致小克银汉霉对16α,17α-环氧黄体酮C11α-羟基化的工艺研究[J].中国生化药物杂志,2009,30(4):239-242.
[13]Fernandes P,Cruz A,Angelova B,et al.Microbial conversion of steroid compounds:recent developments[J].Enzyme Microb Technol,2003,32(6):688-705.
[14]Kim P Y,Pollard D J,Woodley J M.Substrate supply for effective biocatalysis[J].Biotechnol Prog,2007,23(1):74-82.
[15]Lu W Y,Du L X,Wang M,et al.Effect of two-steps substrate addition on steroids 11β-hydroxylation by Curvularia lunata CL-114[J].Biochem Eng J,2006,32(3):233-238.
[16]Paraszkiewicz K,Dlugonski J.Cortexolone 11β-hydroxylation in protoplasts of Curvularia lunata[J].J Biotechnol,1998,65(2):217-224.
(责任编辑 管 珺)
C7α-hydroxylation of dehydroepiandrosterone by Gibberella intermedia CA3-1
FU Zhenzhen1,LI Heng2,LI Hui2,XU Zhenghong2
(1.School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.School of Pharmaceutical Sciences,Jiangnan University,Wuxi 214122,China)
We studied enzymatic C7-hydroxylation of dehydroepiandrosterone(DHEA)by Gibberella intermedia CA3-1.The single factor experiment was applied to determine the optimal fermentation conditions with the conversion rate of C7-hydroxylation as the criterion.The optimal biotransformation conditions were as follows:inoculation amount 6%(V/V),medium volume 30 mL(per 250 mL flask),rotation speed 220 r/min,DHEA concentration 1 g/L,co-solvent propylene glycol(6%,V/V),adding substrate at the same time with inoculation,and biotransformation time 36 h.The molar yield of 7α-OHDHEA from substrate DHEA was 72.34%.
biotransformation;7α-hydroxylation;dehydroepiandrosterone;steroid;Gibberella intermedia
TQ920.6
A
1672-3678(2015)01-0001-05
10.3969/j.issn.1672-3678.2015.01.001
2013-12-10
国家高技术研究发展计划(863计划)(2011AA02A211);国家自然科学基金(21206055);江苏省自然科学基金(BK2012127)
付珍珍(1989—),女,湖北宜昌人,硕士研究生,研究方向:发酵工程;李 会(联系人),副教授,E-mail:lihui@jiangnan.edu.cn

