可降解蓖麻饼粕的蛋白酶产生菌筛选及产酶条件优化
王海涛, 王昌禄, 李贞景, 陈勉华
(天津科技大学食品营养与安全教育部重点实验室,天津 300457)
可降解蓖麻饼粕的蛋白酶产生菌筛选及产酶条件优化
王海涛, 王昌禄*, 李贞景, 陈勉华
(天津科技大学食品营养与安全教育部重点实验室,天津 300457)
利用酪素平板透明圈法初筛和测蛋白酶活力复筛,从分离自蓖麻饼粕和实验室保存的菌株中筛选出1株高产蛋白酶菌株P3-2,对其产酶条件进行了研究。结果表明,最适碳源为麦芽糖,最适氮源为蓖麻饼粕,Na+对产酶具有促进作用,培养基初始pH值为7.5时出现产酶高峰,最适接种量为4%,培养到36 h和84 h时有两个产酶高峰。经正交试验优化,得到较佳产酶培养基组成:2.0%麦芽糖、1.0%蓖麻饼粕及1.0%NaCl。
蓖麻饼粕;蛋白酶;筛选;发酵
蓖麻饼粕是蓖麻籽榨油后的副产物,含有75%~78%的有机质,粗蛋白含量在30%以上,是一种潜在的优质蛋白饲料和有机肥料[1]。处于生长期的家畜,特别是乳猪幼猪,如以蓖麻饼粕为饲料,其中偏高的蛋白质含量会造成幼猪消化不良,影响生长[2]。蓖麻饼粕作为肥料直接施于农田,其中的大分子蛋白质不能直接被植物吸收利用,肥效缓慢,无法满足作物生长对氮肥的需求,发酵时产生的热量会造成作物烧根、烧种[3]。为提高蓖麻饼粕的使用价值,科研人员多集中于研究蓖麻饼粕的脱毒处理,少见从蓖麻饼粕中筛选产蛋白酶的微生物的研究报道。
蛋白酶是能催化肽键水解的一群酶类,可将蛋白质分解为多肽和游离氨基酸[4-8]。蛋白酶既可以从动植物组织中提取,也可以通过微生物发酵工艺进行生产[9]。微生物蛋白酶大约占全球总酶制剂销量的40%[10]。随着蛋白酶应用的日趋广泛和需求的日益增多,分离筛选能分泌具有良好酶学特性并适用大规模工业生产的蛋白酶高产菌株,是广大科研人员的研究目标和任务。
为提高蓖麻饼粕的使用价值,可筛选高产蛋白酶的菌株发酵蓖麻饼粕,将其中的蛋白质分解为小分子的多肽和游离氨基酸,制成高质量的生物饲料、生物肥料。本实验从蓖麻饼粕中分离筛选出一株高产蛋白酶菌株,并对其产酶条件进行了初步研究,为其在生产中的应用奠定基础。
1 材料与方法
1.1 实验材料
供试菌株P3-2系从蓖麻饼粕中分离出的具有蛋白酶活力的菌株;蓖麻饼粕,天津科技大学食品生物技术实验室保存;麸皮,市售;干酪素购自上海紫一试剂厂;福林酚购自北京索莱宝科技有限公司;其他用作培养基配制试剂均分析纯,购自天津市北方天医化学试剂厂。
1.2 培养基
1)牛肉膏蛋白胨培养基:牛肉膏3 g、蛋白胨10 g、氯化钠5 g、琼脂20 g,自来水1 000 mL,pH值为7.2~7.4。
2)蛋白酶选择性培基:NaNO32 g,K2HPO41 g,KCl 0.5 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,蔗糖30 g,干酪素4 g,琼脂20 g,自来水1 000 mL。
3)产酶培养基:蓖麻饼粕1 g,麦芽糖2 g,NaCl 0.9 g,自来水100 mL。
各培养基灭菌条件均为121℃,20 min。
1.3 仪器与设备
HH-B11型电热恒温培养箱,天津市实验仪器厂;CHB-213型生物显微镜,OLYPUS公司;SP-2102UV型紫外可见分光光度计,上海光谱仪器有限公司;CL-32L型全自动智能高压蒸汽灭菌器,日本ALP公司。
1.4 实验方法
1.4.1 产蛋白酶菌株的筛选
将蓖麻饼粕稀释液涂布于平板上,多次分离后得到单菌落,将单菌点接于蛋白酶选择性培养基上,根据透明圈的有无及大小初筛菌株。将初筛出来的菌株进行摇瓶发酵复筛,测定发酵液中蛋白酶活力,选出酶活力最大的菌株作为产蛋白酶菌株。
1.4.2 蛋白酶活力测定方法
采用Folin酚法测蛋白酶活力[11],1 mL发酵液加1 mL质量分数为2%的酪蛋白液,pH值为7.0,40℃水浴10 min,再加0.4 mol/L的三氯乙酸2 mL,保温20 min后离心取1 mL上清液,加1 mL Folin酚在5 mL 0.4 mol/L的NaCO3碱性条件下40℃水浴20 min,测660 nm下的吸光值,空白实验在加酪蛋白液之前先加三氯乙酸,使酶失活,再加酪蛋白液。
蛋白酶活力定义为1 min水解酪蛋白产生1 μg酪氨酸所需酶量为一个蛋白酶活力单位U。
1.4.3 产酶条件优化
将筛选出来的菌株接种到50 mL液体产酶培养基中,32℃,180 r/min培养2 d,测定粗酶液中蛋白酶活力。优化碳源、氮源、金属离子、pH值、接种量、培养时间对产酶的影响。在单因素实验的基础上,采用正交试验优化培养基组分。试验设麦芽糖(A)、饼粕(B)、Na+(C)3个因素,每个因素设3个水平,因素与水平设计见表1。实验设空白列,每组实验做3个平行。进行摇瓶发酵实验,确定最佳发酵产酶培养基成分。
2 结果与分析
2.1 蛋白酶菌株的筛选结果
2.1.1 蛋白酶菌株的初筛结果
将分离自蓖麻饼粕和实验室保存的菌株点接于酪素平板上,以有无透明圈及透明圈大小作为初筛依据。结果如表2。
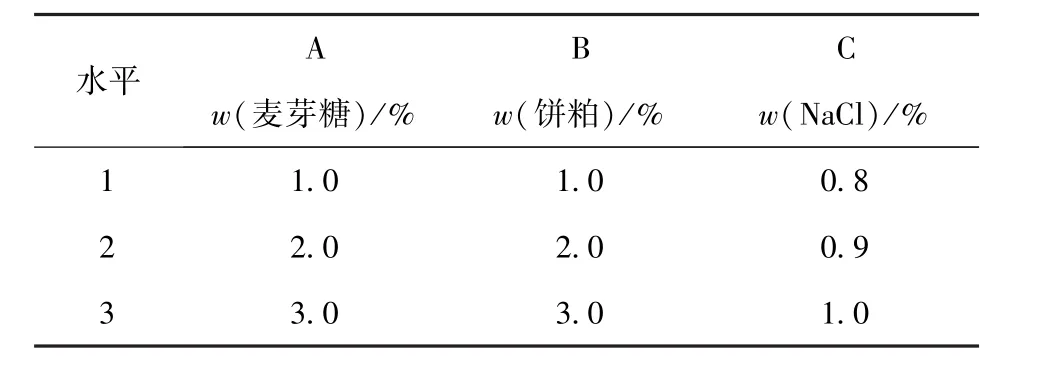
表1 培养基成分正交试验因素与水平Tab.1 Orthogonal experiment factors and their levels for optimization of medium components

表2 产蛋白酶菌初筛结果Tab.2 Primary screening results of protease-producing strains
从表2可以看出,供试菌株虽然能够利用蛋白质,但产生的蛋白酶活力不同,在菌落周围出现透明圈大小也不同。根据透明圈的大小,可以初步判断菌株产蛋白酶的能力。其中,菌株M和菌株B是实验室保存的米曲霉和白地霉,菌株P3-2是从蓖麻饼粕中分离出来的细菌。图1是菌株P3-2在添加酪素的平板上生长及产生透明圈的情况。

图1 菌株P3-2在酪素平板上的透明圈Fig.1 Clearing zones of strain P3-2 on casein plates
2.1.2 蛋白酶菌株的复筛结果
将初筛出来的3株菌进行发酵产酶复筛,用福林试剂法测定中性蛋白酶活力大小,比较酶活力大小,选出酶活力最大的菌株为目标菌株。实验结果如表3。
从表3可以看出,在相同实验条件下,菌株P3-2的蛋白酶活性最高,后续实验选择其作为产蛋白酶的菌株。

表3 产蛋白酶菌复筛结果Tab.3 Re-screening results of protease-producing strains
2.2 产酶条件的研究
2.2.1 碳源对产酶的影响
在发酵产酶培养基中分别添加质量分数为2%的葡萄糖、蔗糖、蓖麻饼粕、麸皮、甘油、麦芽糖、乳糖、淀粉作为不同的碳源,32℃,180 r/min发酵培养一定时间后测定其中性蛋白酶活力,结果如图2。

图2 不同碳源对菌株P3-2产酶的影响Fig.2 Effect of different carbon sources on protease production of strain P3-2
从图2可以看出,以麦芽糖作为培养基碳源时,酶活最高,其次是乳糖和甘油。易于被微生物利用的葡萄糖作为碳源时,酶活最低,说明葡萄糖作为碳源时对产酶有一定的抑制作用,可能是由于代谢产物的阻遏作用。蓖麻饼粕是一种成分复杂的有机物,其中能作为碳源的物质主要是粗纤维,产酶量低说明以蓖麻饼粕作为培养基碳源不利于产酶。
2.2.2 氮源对产酶的影响
分别以质量分数为2%的硫酸铵、蛋白胨、胰蛋白胨、蓖麻饼粕、酵母膏、牛肉膏、硝酸钠作为培养基唯一氮源,以麦芽糖为碳源,摇瓶发酵培养测定中性蛋白酶活力,结果如图3。
从图3可以看出,不同氮源对菌株P3-2产酶的影响较大。其中,以蓖麻饼粕作为氮源时,蛋白酶活性最高,其次为牛肉膏、蛋白胨。胰蛋白胨和酵母膏用作氮源时,可能对产酶有阻遏作用,导致酶活偏低。无机氮源硫酸铵和硝酸钠用作氮源时,菌株P3-2基本不产蛋白酶。已有很多以饼粕作为固态发酵基质生产多种酶的研究报道,如食品级的淀粉酶、纤维素酶、单宁酶、植酸酶等[12-16]。

图3 不同氮源对菌株P3-2产酶的影响Fig.3 Effect of different nitrogen sources on protease production of strain P3-2
2.2.3 金属离子对产酶的影响
在发酵产酶培养基中添加不同种类的金属离子,以不添加任何金属离子为空白对照,测定中性蛋白酶活力,结果如图4。

图4 不同金属离子对菌株P3-2产酶的影响Fig.4 Effect of different metal ions on protease production of strain P3-2
从图4可以看出,金属离子对菌株P3-2产蛋白酶有较大影响。与不添加任何金属离子相比,添加Na+能促进产酶,其他金属离子均有一定的抑制作用,特别是Zn2+对产酶抑制作用最大。
2.2.4 Na+对产酶的影响
调整培养基中的NaCl质量分数分别为0.1%,0.5%,0.9%,1.3%,摇瓶发酵培养,测定中性蛋白酶活力,结果如图5。
通常情况下,金属离子在低浓度范围内对产酶有促进作用,超过一定范围就会抑制产酶,甚至对微生物生长产生毒害作用。从图5可以看出,NaCl质量分数在0.1%~0.9%时,随着添加量的增加酶活也逐渐升高,并在0.9%时达到最高,添加1.3%时酶活降低。
2.2.5 培养基起始pH值对产酶的影响
将发酵产酶培养基的起始pH值分别调至4.5, 5.5,6.5,7.5,8.5,摇床发酵培养,测定中性蛋白酶活力,结果如图6。

图5 NaCl质量分数对菌株P3-2产酶的影响Fig.5 Effect of NaCl concentration on protease production of strain P3-2

图6 培养基起始pH值对菌株P3-2产酶的影响Fig.6 Effect of initial pH value of medium on protease production of strain P3-2
从图6可以看出,培养基起始pH值对产酶有较大影响,在7.5时达到最大值,pH值低于4.5或高于8.5时,产酶水平都显著降低。
2.2.6 接种量对产酶的影响
接种活化10 h的菌种P3-2菌悬液,分别以1%,2%,3%,4%,5%的接种量接种到发酵产酶培养基中,摇床发酵培养,测定中性蛋白酶活力,结果如图7。
从图7可以看出,接种量为4%时酶活最高,接种量过高或过低都不利于产酶。接种量过低,菌体延滞期变长,菌体量少,影响酶的合成;接种量过高,则会导致菌体生长旺盛,培养基营养成分消耗过快,在酶的合成过程中,营养成分相对不足。
2.2.7 培养时间对产酶的影响
将活化后的菌株P3-2菌悬液接种到发酵产酶培养基中,从第24小时开始,每隔12 h测定中性蛋白酶活力,结果如图8。
从图8可以看出,菌株P3-2在36 h和84 h出现产酶高峰,但72 h前的产酶量都较低,84 h的产酶量最高。在发酵前60 h,菌株P3-2的产蛋白酶量较低,第84 h时产酶量最高,之后略有降低。
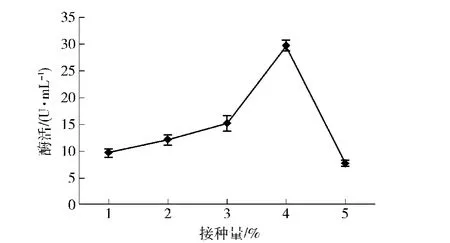
图7 不同接种量对菌株P3-2产酶的影响Fig.7 Effect of amounts of inoculum on protease production of strain P3-2

图8 培养时间对菌株P3-2产酶的影响Fig.8 Effect of culture time on protease production of strain P3-2
2.2.8 培养基成分正交试验
培养基成分正交试验结果与分析如表4。

表4 培养基成分优化正交试验结果及其极差分析Tab.4 Orthogonal experiment results and range analysis for optimization of medium components
由表4可以看出,麦芽糖含量对菌株P3-2产蛋白酶影响最为显著,其次为蓖麻饼粕含量、NaCl浓度。培养基成分为A2B1C3D3时,即2.0%麦芽糖、1.0%蓖麻饼粕、1.0%NaCl,蛋白酶活力最高。由于在正交试验表中没有出现组合A2B1C3D3,试验组4与组合A2B1C3D3接近且蛋白酶活力测定结果也是最高。因此,选取实验组4和优化后的组合A2B1C3D3进行比较试验,结果显示,实验组4蛋白酶活力为42.91 U/mL,组合A2B1C3D3活力为43.42 U/mL,即优化后的组合蛋白酶活力略高于正交试验中出现的最佳组合。由此,确定培养基成分的最佳组合为A2B1C3D3,即2.0%麦芽糖、1.0%蓖麻饼粕、1.0% NaCl。
3 结 论
本研究采用酪素平板透明圈法从分离自蓖麻饼粕和实验室保存的菌株中进行初筛,得到3株能够产生明显透明圈的菌株。利用Folin酚法测定3株菌的中性蛋白酶活力,得到1株分离自蓖麻饼粕的菌株P3-2,其蛋白酶活力最高。通过单因素实验优化了影响菌株P3-2产酶的主要条件,确定麦芽糖为最适碳源,蓖麻饼粕为最适氮源,Na+促进产酶,培养基较佳起始pH值为7.5,较佳接种量是4%,较佳培养时间为84 h。经正交试验优化得到最适产酶培养基成分为:麦芽糖含量2.0%、蓖麻饼粕含量1.0%、NaCl含量1.0%。通常情况下,培养条件对菌株的产酶水平影响较大,在合适的条件下发酵能促进菌株的产酶。菌株P3-2来源于蓖麻饼粕,对其进行诱变处理有望进一步提高蛋白酶活力,为蓖麻饼粕的饲料化、肥料化利用奠定基础。
[1]冀照君,杨文军,黄凤兰,等.蓖麻饼粕成分分析及研究进展[J].内蒙古民族大学学报,2011,26(5):545-548.
[2]胡学智,王俊.蛋白酶生产和应用的进展[J].工业微生物,2008,38(4):39-61.
[3]邱鑫,肖汉乾,向天勇,等.菜籽饼粕粗蛋白降解菌的筛选、初步鉴定与发酵条件摸索[J].氨基酸和生物资源,2005,27(1):1-5.
[4]李咏梅.水产品加工中蛋白酶的应用研究[J].畜牧与饲料科学,2011,32(7):89-90.
[5]吴京平.天然有机物对碱性蛋白酶活力的影响[J].北京工商大学学报:自然科学版,2005,23(6):6-9.
[6]Rao M B,Tankasale A M,Ghatge M S,et al.Molecular and biotechnological aspects of microbial proteases[J]. Microbiology and Molecular Biology Reviews,1998,62(3):597-634.
[7]Sumantha A,Larroche C,Pandey A.Microbiology and industrial biotechnology of food-grade proteases:a perspective[J].Food Technol Biotechnol,2006,44(2):211 -220.
[8]肖阳.洗涤剂最新发展动态探讨[J].北京工商大学学报:自然科学版,2004,22(5):8-12.
[9]Sumantha A,Sandhya C,Szakacs G.Production and partial purification of a neutral metalloprotease by fungal mixed substrate fermentation[J].Food Technol Biotechnol,2005,43(4):313-319.
[10]梁春梅.牛乳产蛋白酶菌分离鉴定及产酶条件的研究[D].呼和浩特:内蒙古农业大学,2009.
[11]上海市酿造科学研究所.SB/T 10317蛋白酶活力测定方法[S].北京:中国标准出版社,1999.
[12]Madeira J V Jr,Macedo J A,Macedo G A.Detoxification of castor bean residues and the simultaneous production of tannase and phytase by solid-state fermentation using paecilomyces variotii[J].Bioresource Technology,2011(102):7343-7348.
[13]Xu Hui,Sun Lanping,Zhao Daqing,et al.Production of α-amylase by aspergillus oryzae as 3951in solid state fermentation using spent brewing grains as substrate[J]. Journal of the Science of Food and Agriculture,2008,88(3):529-535.
[14]Gautam P,Sabu A,Pandey A,et al.Microbial production of extracellular phytase using polystyrene as inert support[J].Bioresource Technology,2002(8):229-233.
[15]Sabu A,Sarita S,Pandey A,et al.Solid-state fermentation for production of phytase by Rhizopus oligosporus[J].Applied Biochemistry and Biotechnology,2002(102-103):251-260.
[16]Singhania R R,Patel A K,Soccol C R,et al.Recent advances in solidstate fermentation[J].Biochemical Engineering Journal,2009,44:13-18.
Screening of Protease-Producing Bacterium for Degrading Castor Bean Meal and Optimization of Its Fermentation Conditions
WANG Haitao, WANG Changlu*, LI Zhenjing, CHEN Mianhua
(Key Laboratory of Food Nutrition and Safety,Ministry of Education,Tianjin University of Science and Technology,Tianjin 300457,China)
A strain named P3-2 with the ability to produce protease was isolated from castor bean meal and laboratory preservation by the casein plate culture method and enzyme activity detection.The optimal fermentation conditions were investigated.The optimum carbon and nitrate sources were maltose and castor bean meal.Meanwhile,the yield of protease was increased by adding Na+and one peak of the protease yield was obtained when the initial pH value of medium was 7.5.Moreover,the optimum amount of inoculum was 4%and there were two peaks of the protease yield when culture time was 36 h and 84 h. Through the orthogonal experiment,the optimum compositions of medium were as follows:2.0%maltose,1.0%castor bean meal,and 1.0%NaCl.
castor bean meal;protease;screening;fermentation
叶红波)
TS201.3
A
10.3969/j.issn.2095-6002.2015.01.008
2095-6002(2015)01-0043-06
王海涛,王昌禄,李贞景,等.可降解蓖麻饼粕的蛋白酶产生菌筛选及产酶条件优化[J].食品科学技术学报,2015,33(1):43-48.
WANG Haitao,WANG Changlu,LI Zhenjing,et al.Screening of protease-producing bacterium for degrading castor bean meal and optimization of its fermentation conditions[J].Journal of Food Science and Technology,2015,33(1):43-48.
2014-01-17
王海涛,男,硕士研究生,研究方向为食品生物技术;
*王昌禄,男,教授,博士生导师,主要从事食品生物技术方面的研究。
。

