精索平滑肌肉瘤1例报告并文献复习
王逸云 付启忠 刘 颖 吕光耀 董圣芳 杨建勋 刘险峰
大连大学附属中山医院泌尿外科(大连 116001)
精索平滑肌肉瘤1例报告并文献复习
王逸云 付启忠*刘 颖 吕光耀 董圣芳 杨建勋 刘险峰
大连大学附属中山医院泌尿外科(大连 116001)
目的 探讨精索平滑肌肉瘤的影像、病理特征及治疗方法。方法 回顾性分析2014年11月收治1例精索平滑肌肉瘤患者的诊治情况。男性患者,46岁,因无痛性阴囊左侧肿物13年入院。查体:阴囊左侧可触及一质地坚实、大小约5.0cm×4.0cm的肿物,透光试验阴性。B超检查提示左侧精索上附有一内部不均质的肿物,而且肿物并不与左侧睾丸及附睾粘连。左侧精索增粗,血供丰富。甲胎蛋白1.00ng/mL,人绒毛膜促性腺激素<1.2mIU/ml,心电图和胸部X线片均正常。术前诊断为左侧精索肿瘤。结果 行阴囊切口手术摘除肿瘤,术中见肿瘤切面灰红结节状,冰冻切片提示精索梭形细胞肿瘤,待免疫组化明确病变性质。术后病理HE染色瘤细胞呈长梭形,束状排列。细胞核呈杆状,异型性较大,核大深染,可见核分裂象,免疫组化显示Desmin、SMA、Vimentin阳性,Ki-67(40%),而EMA,CD68为阴性。诊断符合精索平滑肌肉瘤,遂二期行经腹股沟切口根治性睾丸切除术。术后行局部放射治疗。术后1年未见肿瘤复发。结论 精索平滑肌肉瘤是一种罕见的男性泌尿生殖系统肿瘤,临床表现缺乏特异性。诊断该病主要依据病理HE染色及免疫组化标志物,并且需与其他梭形细胞肿瘤鉴别,根治性睾丸切除术后辅助放射治疗是一种有效的治疗方法。
精索; 平滑肌肉瘤; 病例报告
原发性精索平滑肌肉瘤是一种罕见的男性泌尿生殖系统肿瘤,其中大部分为间叶组织来源的恶性肿瘤。Patel和Chalier于1907年首先报告了1例精索平滑肌肉瘤,此后在文献中逐渐增多,但多数是个例报道。根据陈礼的描述:1972年Jenkins收集了世界文献共有26例精索平滑肌肉瘤,1976年Deluise报告了6例精索和附辜平滑肌肉瘤,其中两例是精索平滑肌肉瘤,1978年Sogani总结精索平滑肌肉瘤的总数才达到30例(未包括Deluise的两例)[1]。而同时期国内公开发表的杂志中,少有报道,1981年陈礼金等人报道了国内第1例精索平滑肌肉瘤[1]。截至2012年11月,国内共报道了10例,其中2012年报道了2例。复习国内文献后发现,10例报道均为个例报道,为积累文献资料,并提高对本病的认识,今将我院2014年11月收治的1例左侧精索平滑肌肉瘤报道如下,并进行文献复习,以供参考。
对象与方法
一、临床资料
男性患者,46岁,左侧阴囊内发现肿物13年。肿物起初约2.0cm×2.0cm大小,无疼痛,无不适症状,以后逐年增大。入我院诊治时肿物约5.0cm×4.0cm大小,仍无疼痛,肿物活动性差,质地中等,较柔韧,透光试验(-),平卧位肿物不缩小,左侧精索静脉迂曲,睾丸、附睾及左侧精索未触及异常,无外伤、手术史。查血常规、尿常规正常,心电图、胸部X线片也未见异常。甲胎蛋白(alpha-fetoprotein,AFP)1.00ng/mL,人绒毛膜促性腺激素(human chorionic gonadotropin,HCG)<1.2mIU/ml(正常范围)。彩色多普勒超声检查提示:左侧阴囊内睾丸的外上方探及低回声团,大小5.2cm×4.0cm×5.2cm,边界清晰,形态欠规整,内回声不均匀,彩色多普勒血流显像(CDFI)其内及周边探及血流信号,见图1A。左侧附睾头大小、形态正常,回声均匀,内部可见无回声,大小0.5cm×0.5cm,边界清晰,后方回声增强(见图1B)。左侧精索区可见多处迂曲扩张的管状无回声,最宽内径0.28cm,CDFI:其内探及静脉血流信号(见图1A),并可随Valsalva动作而血流信号加强。根据超声,肿物附着于左侧精索上,与左侧睾丸及附睾并不关联。

图1 超声所见肿块及患侧附睾头囊肿A: 左侧阴囊内睾丸外上方肿物及精索静脉彩色多普勒血流显像; B: 左侧附睾头囊肿(箭头所示)
二、方法
入院后进行各项相关检查,在联合阻滞麻醉下行左侧阴囊内肿瘤切除术,术中眼观:见肿瘤组织位于左侧睾丸外上方与精索粘连,有完整包膜。肿块大小6cm×5cm×3.8cm,切除后剖开切面呈灰红结节状,质地中等,并有完整包膜(见图2)。术中冰冻切片检查显示为精索梭形细胞肿瘤,待免疫组化明确病变性质。告知家属后,终止手术。术后标本在光学显微镜(200×)下HE染色所见:瘤细胞胞质丰富,嗜伊红,瘤细胞呈长梭形,核呈杆状,细胞核大小不一,核大深染,胞核异型性较大,可见病理性核分裂(图2)。 免疫组化结果:CK(-)、Desmin(+)、Ki-67(40%)、CK68(-)、SMA(+)、EMA(-)、Vimentin(+)、S-100(-)、CR(-)见图3。病理诊断为精索平滑肌肉瘤。征得患者同意后再次手术予以高位游离精索并完整切除肿物及患侧睾丸、附睾。术后行局部放射治疗,恢复顺利。
三、随访
术后1年,电话随访患者未见有肿瘤复发。
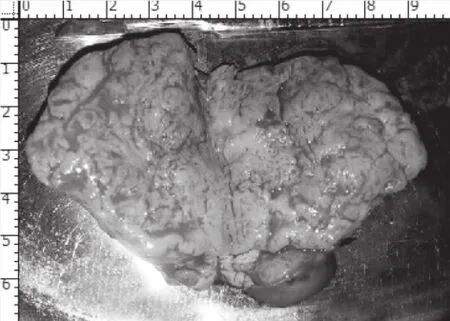
图2 术中肉眼所见肿块(HE×200)肿块已剖开, 切面灰红结节状, 并有完整包膜
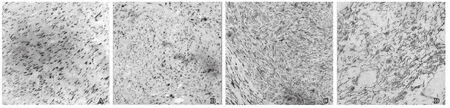
图3 精索平滑肌肉瘤病理切片(HE×200)肿瘤细胞免疫组化(×200)A: 瘤细胞呈长梭形, 束状排列; B: 细胞核呈杆状, 异型性较大, 核大深染, 可见核分裂象(箭头所示); C: 瘤细胞表现为Desmin阳性; D: SMA阳性, SP法
讨 论
平滑肌肉瘤占软组织肉瘤的5%~10%[2],而精索平滑肌肉瘤则更为罕见,至今全球仅有110余例的报道[2]。在成年人群中回顾分析了10种阴囊内、睾丸以外的肉瘤显示:在组织学的多变性方面,平滑肌肉瘤是最多见的。其高发年龄为60至70岁[2]。也有文献指出,多数良性和恶性平滑肌瘤发生于40~70岁患者。90%睾丸外肿瘤发生在精索上。精索肿瘤中,30%为恶性,70%为良性。恶性中,多数是间叶细胞肉瘤[3]。通过检索国内文献关于精索平滑肌肉瘤的报道,结合本病例,共有11例患者,其中有6例年龄超过60岁,有2例分别为55岁和50岁,最小年龄为22岁。本例特点:(1)发病年龄偏低;(2)增值指数(Ki-67)中等阳性,瘤细胞增值较活跃;(3)肿瘤生长缓慢,较少淋巴转移和血行转移;(4)手术行高位切除,术后放射治疗。Pankaj Dangle与其同事的研究发现:平滑肌肉瘤可起源于精索、阴囊以及附睾。其中,最常见的是起源于提睾肌和输精管未分化间充质细胞的精索型平滑肌肉瘤,其次是起源于周围平滑肌包裹的附睾管基底膜的附睾型平滑肌肉瘤,最后是起源于阴囊肉膜的阴囊型平滑肌肉瘤。精索型平滑肌肉瘤和附睾型平滑肌肉瘤可经淋巴转移到腹膜后淋巴结,相比之下,阴囊型平滑肌肉瘤可转移到腹股沟、髂内及髂外淋巴结[4]。值得注意的是,本例患侧附睾头囊肿(图1B),目前附睾囊肿具体发病机制还不十分清楚,可能与输精管道的感染、梗阻有关,其内容物主要为精液,经B超检查常可确诊。本病例附睾头囊肿可能就是起源于输精管未分化间充质细胞的精索平滑肌肉瘤引起输精管梗阻所致。
根据Dangle等回顾分析后可以确定精索平滑肌肉瘤最主要的转移途径是淋巴系统转移,其次是血行途径转移,最后是局部扩散[4],其转移方式与附睾型平滑肌肉瘤相同[5]。精索平滑肌肉瘤可通过淋巴传播至髂外、下腹部、髂血管、主动脉旁淋巴结,而血行传播最常累及到肺部,而局部扩散可至阴囊,腹股沟或是沿着输精管进入骨盆[4]。而一些学者的观点则认为血源性转移和经淋巴道转移的比例为6:2。血源性传播与经淋巴传播都是经常发生的[3]。
术前对精索平滑肌肉瘤的诊断是困难的,常常是要通过组织学检查诊断。组织学上可以与以下梭形细胞肉瘤鉴别:(1)梭形细胞横纹肌肉瘤;(2)多形性脂肪肉瘤;(3)多形性恶性纤维组织细胞瘤;(4)恶性蝾螈瘤;(5)纤维肉瘤[6]。而分化较好的平滑肌肉瘤和平滑肌瘤很难明确区分,可依据以下几点加以鉴别:平滑肌肉瘤常有浸润性生长,而平滑肌瘤界限清楚;平滑肌肉瘤有明显的异形性,且较常有坏死灶,平滑肌瘤则较少有坏死;平滑肌肉瘤核分裂象丰富,并且出现病理性核分裂象,这是两者鉴别的重要标准[7]。结合本病例,术中冰冻切片未指明肿瘤良、恶性,我们总结出可能是病理医生在取材时观察不够细致,未能仔细找出病理性核分裂象导致的诊断不确切。查阅文献发现,术中冰冻切片虽然恶性肿瘤确诊率较高,但是仍会出现一定概率的假阴性,假阴性指未能诊断出的恶性肿瘤[8]。临床上的精索平滑肌肉瘤表现出的是无痛、偏硬、不与睾丸粘连的阴囊内肿物,因此和其他阴囊内肿瘤有相似的诊断方法。阴囊超声对于这种阴囊内肿物的诊断就是一种有效且重要的方法,同时可以评估肿物和睾丸、附睾的关系,仝墨泽等人在总结了一例附睾恶性肿瘤后表示超声能区别肿块是实质性或是囊性,能明确肿块的位置及与邻近组织的关系。彩超的血流显像可鉴别附睾肿瘤和其他非肿瘤疾病,但对良、恶性肿瘤的鉴别缺乏特异性[9]。一旦手术当中确诊为精索平滑肌肉瘤,那么肿瘤的分期是很重要的,MRI则是一种有效解决该问题的手段,它对于评价阴囊内睾丸以外的实性肿瘤有较好的作用,尤其对肿瘤组织结构程度方面有较大优势[10]。大多数平滑肌肉瘤actin、SMA、ESA均阳性,但是这些抗体是一般的肌标记,不具备平滑肌特异性,所以必须结合形态学作出诊断[11,12]。在临床上,睾丸根治性切除术治疗精索平滑肌肉瘤被当做是“金标准”,术后的辅助放射治疗可以大大降低局部复发的概率。诚然,也有单纯行根治性切除而术后随诊观察的病例。其实上世纪八十年代,Blitzer 等就总结了10例精索平滑肌恶性肿瘤并进行了文献复习,他们发现精索恶性肿瘤患者的5年生存率是50%~80%,并且单纯根治性切除术并非最佳治疗方法,其中在27%的病例中,虽然进行了广泛重复的根治性切除但仍被证明存在镜下肿瘤残余,因此放疗是公认较好的辅助治疗方法[13]。对于局部淋巴结肿瘤的高复发率,目前主要有两种治疗方法:腹膜后淋巴清扫术和放疗。支持腹膜后淋巴结清扫的学者也认为大约有29%的概率转移到局部淋巴结。而Banowsky和Schultz在回顾分析了101例罹患精索恶性肿瘤的患者后发现其中有29例患者有淋巴转移且做了腹膜后淋巴清扫术,之后的术后随访通过查体或尸检发现有17例出现了肿瘤的淋巴扩散[14]。可以看出精索恶性肿瘤的淋巴扩散概率非常高,而关于根治性睾丸切除外加腹膜后淋巴清扫术使患者受益的报道却非常少见。
麻省总医院的Fagundes等做了一项重要的实验,从而证明了对于精索肉瘤,睾丸根治性手术外加放疗可使患者受益。他们把18例罹患精索肉瘤的患者分为两组,每组9例。一组行单纯睾丸根治术治疗,而另一组行根治术外加放疗,前者有5例肿瘤局部复发,2例淋巴转移而治疗失败。作为对照,接受放疗的一组则在根治术后行区域淋巴结的放疗,最终无一例局部复发[15]。Catton及其研究员也在回顾分析了21例成年人睾丸外肉瘤后发现放疗可以有效地遏制镜下肿瘤残余,这和麻省总医院的实验结论相符合[16]。
精索平滑肌肉瘤属于罕见病例,但是也应在精索实性肿瘤中首先鉴别诊断出来。其临床表现为无痛性肿块,生长缓慢,易与其他类型间叶组织源性肿瘤相混淆,主要靠病理检查确诊。其次,精索平滑肌肉瘤起源于输精管的未分化间充质细胞,治疗方面可行睾丸根治性切除术加辅助放疗,这可以使患者获益,尤其是可以防止局部的肿瘤淋巴转移复发,而对于有局部淋巴肿瘤转移患者我们倾向于放疗而非腹膜后淋巴结清扫。结合本例,患者接受术后放射治疗,至今没有发现肿瘤复发转移。最后,要提高病理科医生病理识别水平,二次手术会造成病患的痛苦,且可能会影响疗效。
1 陈礼金, 洪元康, 刘世沧. 精索平滑肌肉瘤一例报告. 四川医学院学报 1981; 12(1): 78
2 Weiss SW, Goldblum JR. Leiomyosarcoma, In: Enzinger and Weiss's Soft tissue Tumors. 4th ed. St. Louis (MI):Mosby Inc 2001: 727-748
3 魏恩, 等. 坎贝尔-沃尔什泌尿外科学. 第九版. 北京大学医学出版社, 2009: 966
4 Dangle P, Basavaraj DR, Bhattarai S, et al. Leiomyosarcoma of the spermatic cord: case report and literature review. Can Urol Assoc J 2007; 1 (1):55-58
5 谢宇, 梁剑平. 附睾原发性平滑肌肉瘤1例报告并文献复习. 中国男科学杂志 2010; 24(12): 43-44
6 张国勇, 叶明福, 王亚丽, 等. 精索原发平滑肌肉瘤1例.临床与实验病理学杂志 2009; 25(6): 674-675
7 岳林先, 陈琴. 阴囊超声诊断(附: 睾丸超声造影图谱).成都: 四川科学技术出版社, 2013: 179-180
8 张剑红, 成日青, 林媛媛, 等. 1091例手术中冰冻切片病理诊断准确性分析. 河北北方学院学报·医学版 2007;24(1): 41-43
9 仝墨泽, 刘见辉, 于干, 等. 原发性附睾横纹肌肉瘤1例报告并文献复习. 中国男科学杂志 2014; 28(7): 53-54
10 Woodward PJ, Schwab CM, Sesterhenn IA. Extra testicular scrotal masses. Radiographics 2003; 23(1): 215-240
11 Flercher CDM, Unni KK, Merten F. World Health Organization Classification of tumors. Pathology and genetics of tumors of soft tissue and bone. Lyon: IARC Press, 2002: 131-134
12 罗晓青, 杨光华, 郭立新, 等. 48例软组织平滑肌肉瘤的病理及免疫组化研究. 临床与实验病理学杂志 2000;16(1): 11-14
13 Blitzer PH, Dosoretz DE, Proppe KH, et al. Treatment of malignant tumors of the spermatic cord: a study of 10 cases and a review of the literature. J Urol 1981; 126(5):611-614
14 Banowsky LH, Schultz GN. Sarcoma of spermatic cord and tunics: review of literature, case report and discussion of role of retroperitoneal lymph node dissection. J Urol 1970; 103(5): 628-631
15 Fagundes MA, Zietman AL, Althausen AF, et al. The management of spermatic cord sarcoma. Cancer 1996;77: 1873-1876
16 Catton CN, Cummings BJ, Fornasier V, et al. Adult paratesticular sarcomas: a review of 21 cases. J Urol 1991; 146(2): 342-345
(2015-04-30收稿)
Leiomyosarcoma of the spermatic cord: one case report and literature review
Wang Yiyun, Fu Qizhong*, Liu Ying, Lv Guangyao, Dong Shengfang, Yang Jianxun, Liu Xianfeng
Department of Urology,the Zhong Shan Hospital Affi liated to Dalian University, Dalian 116001, China
Corresponding author: Fu Qizhong, Email:fuqizhong@163.com
Objective To discuss the imageological, pathological features, and treatments of leiomyosarcoma of the spermatic cord. Methods A case of the leiomyosarcoma of the spermatic cord was reported in November 2014. A 46 -yearold male patient presented with a 13 years history of painless lump in the left hemiscrotum. Physical examination revealed that a fi rm-to-hard lump with the size of 5.0cm×4.0cm on the left hemiscrotum, and the transillumination test was negative. B-ultrasound examination demonstrated a solid lump of uniform homogeneity that attached to the left spermatic cord. And the lump separated from the left testis and epididymis, with the left spermatic cord augmented and rich blood supply. The serum alpha-fetoprotein was 1.00ng/mL, serum human chorionic gonadotropin and chest X-ray were both normal. The preoperative diagnosis was the tumor of left spermatic cord. Results The patient underwent operation after scrotum incision under general anaesthesia. During operation the tumor section with grey-red nodular can be seen,and the frozen section indicated spindle cell type tumor, to know the tumor was benign or malignant after identifying immunohistochemical lesion characters. Postoperation histopathology HE staining indicated that the tumor cells showed long fusiform,and arranged in fascicles.The cell nucleus with atypia was rod-shaped and hyperchromatic,after then mitotic could be seen more. Immunohistochemical examination revealed positive for Desmin,SMA and Vimentin, Ki-67(40%), negative for EMA and CD68. The results accorded with the leiomyosarcoma of spermatic cord,so two-stage radical orchidectomy for this patient after inguinal incision. Then continue to the local radiotherapy. During the follow-up period for one year, no recurrence occurred. Conclusion The leiomyosarcoma of the spermatic cord is a very rare malignant tumor in the male reproductive system tumor, and this kind of disease has no special feature in clinical manifestation.The diagnosis mainly depends on histopathology HE staining and special marks in immunohistochemistry, the differentces of this disease and spindle cell type tumor should be identifi ed. The radical orchidectomy and the postoperation local radiotherapy is a kind of effective therapeutic method.
spermatic cord; Leiomyosarcoma; case reports
10.3969/j.issn.1008-0848.2015.10.010
R 737.2
*通讯作者, E-mail: fuqizhong@163.com

