Ag-TiO2复合纳米光催化剂制备及降解溶液中甲醛研究
吴永军
(马鞍山师范高等专科学校软件与食品工程系,安徽马鞍山243041)
Ag-TiO2复合纳米光催化剂制备及降解溶液中甲醛研究
吴永军
(马鞍山师范高等专科学校软件与食品工程系,安徽马鞍山243041)
以钛酸丁酯为前驱体,通过sol-gel法制备Ag-TiO2复合纳米粉体,采用SEM、XRD、XPS对样品进行结构表征,Ag-TiO2纳米粉体为立方体形锐钛矿型,平均粒径约为20~50nm。在避光条件下考察不同Ag掺量、甲醛初始浓度、pH对光催化降解甲醛的影响。结果表明,本实验条件下最佳的掺Ag量为8%,Ag-TiO2对于低浓度甲醛溶液具有较高的降解率;随着甲醛溶液pH的升高,Ag-TiO2复合纳米粉体的光催化活性逐渐降低;在200mL浓度为0.1mg/mL甲醛水溶液中,添加0.20g掺Ag量8%的Ag-TiO2光催化剂,调节溶液pH=2,紫外灯辐照300min,甲醛降解率可达到93.1%;Ag-TiO2光催化降解甲醛符合朗格缪尔-欣伍(Langmuir-Hinshelwood)一级反应动力学模型。
TiO2,Ag掺杂,甲醛,光催化,降解
甲醛是一种具有较高毒性的挥发性有机物,是公认的变态反应源、潜在的强致突变物与疑似致癌物质,在我国有毒化学品优先控制名单上高居第二位[1]。大量研究表明,除人工非法添加外,食品中的甲醛多数为天然本底,或在食品加工中某些复杂生化反应的中间产物或代谢产物[2],统称为内源性甲醛。当前,食品中甲醛残留的相关研究主要集中在检测技术及迁移规律上,内源性甲醛的无害化处理研究尚处于起步阶段,现有文献报道的消除内源性甲醛方法主要有:控制甲醛的生成途径,激活甲醛分解代谢途径,使用甲醛捕获剂等[3]。随着食品安全标准的提高,食品中游离甲醛的无害化处理技术必将成为食品、环境、材料、分析等学科交叉的研究热点。
光催化反应是一种新型污染物净化方法,其特点是能够在常温常压下将环境污染物有效降解为二氧化碳和水等无毒产物。TiO2因具有性能稳定、价格低廉、安全无毒、易掺杂改性、耐酸碱、抗磨损等诸多优点,被认为是一种理想的光催化材料。但是TiO2禁带宽约为3.28ev,需要接收高能(近)紫外光辐射才能激发出电子-空穴对(e-h),其光利用率不高;此外,由于TiO2在ns(纳秒)至ps(皮秒)范围内电荷载流子的复合率比较大,致使光催化活性较低[4],上述缺陷限制了TiO2作为光催化载体的实际应用。就相关领域的研究趋势而言[5-6],TiO2具有掺入食品包装材料、或作为功能涂层用于光催化降解食品中游离甲醛的应用前景,但前提必须大幅提高TiO2的光催化活性,目前比较切实可行的方法是对其进行表面修饰,如:掺杂过渡金属、表面沉积贵金属等。表面修饰能够增强TiO2的吸附能力,有利于光生电子激发到导带并与光生空穴有效分离,降低禁带宽度、扩大吸收波长范围,增强光催化活性。
本研究以钛酸丁酯为原料,采用溶胶-凝胶法(Sol-Gel)制备具有光催化活性的Ag-TiO2复合粉体,考察了Ag掺量、甲醛初始浓度、pH对光催化降解甲醛的影响,并初步分析了催化反应的动力学特征。
1 材料与方法
1.1材料与仪器
钛酸丁酯国药化试,CP;无水乙醇、冰乙酸、甲醛南京化试;AgNO3国药化试;丙酮、乙酰丙酮国药化试;醋酸铵宿州化试,以上试剂均为AR;去离子水。
S-4800型扫描电镜Hitachi;Y-4Q型X射线衍射仪丹东射线;PHI QuanteraⅡ型X射线光电子能谱仪ULVAC;UV765CRT紫外可见分光光度计上海精科;F1004B电子天平上海越平;SX-5-12型马弗炉天津泰斯特;DZF-6020A型真空干燥箱北京中兴;90-1型恒温磁力搅拌器上海沪西;101-1A型鼓风干燥箱金坛汉康;PS-20AL超声波清洗机上海之信;TGL-16A离心机常州中捷;HHS-21-6恒温水浴锅金坛新航;紫外灯40W,365nm,杭州科旭。
1.2实验方法
1.2.1TiO2粉体的制备首先将0.5mL冰乙酸、5.5mL无水乙醇、0.5mL去离子水混合,室温下搅拌均匀得A溶液;再将5.0mL 0.1mol/L钛酸丁酯溶解于10.0mL无水乙醇中,用恒温磁力搅拌器在30℃下以1000r/mim搅拌1h,随后缓慢滴入A溶液,使其与前驱体钛酸丁酯反应形成螯合物;静置一段时间出现凝胶,放入真空干燥箱80℃下干燥1h,固形物取出后简单研磨,随后置于马弗炉中在500℃下活化4h,即可得到白色TiO2粉体。
1.2.2Ag-TiO2复合纳米光催化剂的制备将10.0mL丙酮、10.0mL无水乙醇、10.0mL去离子水在室温下混合均匀制得B溶液,加入0.04g AgNO3,以及0.50g自制TiO2粉体,用恒温磁力搅拌器在30℃下以1000r/mim搅拌1h,产物用无水乙醇采用静置法清洗3次,离心后固形物加无水乙醇分散倒入烧杯,置于超声波清洗机内,利用固定于超声清洗机上方15cm的紫外灯照射烧杯中的Ag-TiO2复合物,超声1h后取出,产物放入鼓风干燥箱120℃下干燥24h,即可得到8%(mAgNO3∶mTiO2)掺杂Ag的TiO2复合纳米粉体[7],用于后续实验。
1.2.3光催化降解甲醛以新配制的200mL一定浓度甲醛溶液作为目标降解物,加入250mL烧杯中。以1g/L的用量加入0.20g新制Ag-TiO2复合纳米催化剂,超声分散后放入自制的暗室内,30℃下以1000r/min转速磁力搅拌60min以促使复合纳米催化剂达到吸附平衡。随后打开固定在烧杯上方15cm处的40W 365nm波长紫外灯,激发光催化反应。每隔30min用移液管吸取10mL混合液,离心去除催化剂,提取上清液。采用乙酰丙酮分光光度法(SC/T3025-2006)[8-9],以UV765CRT紫外可见分光光度计在413nm波长下测定上清液的吸光度,根据溶液吸光度的变化计算甲醛降解率η。

式中:A0为光催化反应开始前甲醛溶液的初始吸光值;A为光催化降解一段时间后溶液的吸光值。
通过改变反应条件,考察Ag掺量、甲醛初始浓度、溶液pH对光催化降解甲醛的影响。
1.2.3.1Ag掺量对光催化降解的影响改变Ag(NO)3的掺入量,分别加入0.01、0.02、0.03、0.04、0.05、0.06g的Ag(NO)3制备掺Ag量为2%、4%、6%、8%、10%、12%的TiO2粉体,采用1.2.3反应流程以不同掺Ag量的Ag-TiO2复合纳米粉体光催化降解200mL 0.1mg/mL甲醛溶液,以反应3h后甲醛降解率为指标考察Ag掺量对TiO2粉体光催化能力的影响。
1.2.3.2甲醛浓度对光催化降解的影响按照1.2.2制备流程制取8%Ag掺杂的TiO2复合纳米粉体,采用1.2.3光催化降解甲醛实验方法,30℃下以0.2g Ag-TiO2复合纳米粉体分别光催化降解浓度为0.1、0.2、0.3、0.4、0.5mg/mL甲醛溶液,用乙酰丙酮分光光度法测量溶液吸光度并计算甲醛降解率。
1.2.3.3溶液pH对光催化降解的影响采用1.2.3光催化降解甲醛实验方法,在超声分散前通过加入HCl与NaOH调节0.1mg/mL甲醛降解液的pH,考察30℃下pH(pH=2、4、6、8)对于Ag-TiO2复合纳米粉体降解甲醛行为的影响。
1.2.4检测条件SEM检测采用Hitachi S4800型扫描电镜,粉体样品用酒精分散滴于铜片上并经喷金处理。检测条件为:加速电压5kV、工作距离9.4mm对应放大倍率为70000、工作距离9.1mm对应放大倍率100000、使用二次电子检测器成像。
XRD检测采用丹东射线Y-4Q型X射线衍射仪。检测条件为:铜靶,Kα辐射源,扫描范围10°≤2θ≤80°,扫描速率8°/min,扫描步长0.02°,扫描模式theta/ 2theta。
XPS检测采用PHI QuanteraⅡ型X射线光电子能谱仪。检测条件为:X射线源为Al Kα(hν=1486.6eV),全谱扫描范围为360~380eV,扫描步长为0.2eV,分析通能为30eV,以C的1s峰(289.6eV)校正样品表面的荷电效应。
1.3数据处理
XRD检测数据使用Convx 1.0、Origin 6.0软件进行数据转换与峰型分析;XPS检测数据使用Xps peak 4.1软件进行分峰处理;使用Origin6.0软件进行光催化降解反应的线性拟合分析。
2 结果与分析
2.1Ag-TiO2粉体的结构表征

图1 TiO2与Ag-TiO2粒子的SEM形貌Fig.1 SEM image of TiO2and Ag-TiO2
如图1所示,本实验条件下制备的TiO2纳米晶为不规则的颗粒,存在一定的粘黏,平均粒径约为80~120nm;Ag掺杂后,Ag-TiO2复合纳米粒子呈现不规则球形,粒径减小至20~50nm,粒径均匀,分散性较好。此种变化的产生,原因在于Ag粒子会干扰TiO2晶体表面Ti-O键重排,限制了TiO2锐钛矿型中离子的接触和聚合,减慢锐钛矿晶相生长[10];此外由于Ag-O键键能要小于Ti-O键及Ag-Ag键的键能,且Ag粒子表面自由能要低于TiO2表面自由能,这就使得Ag在TiO2表面的具有很高的扩散速率,有利于原子间重排,同时高温活化处理会进一步加速重排,从而使反应生成的Ag-TiO2粒径大幅减小[7]。

图2 Ag-TiO2粉体的XRD图谱Fig.2 XRD pattern of Ag-TiO2

图3 Ag-TiO2中Ag的XPS谱Fig.3 XPS spectrum of Ag in Ag-TiO2
如图2所示,本实验条件下制备Ag-TiO2复合纳米粒子在2θ为38.20°、44.40°、64.40°、77.30°处有4个强吸收峰,对应于标准衍射谱图(JCPDS 04-0784)中立方晶系Ag的(111)、(200)、(220)、(311)晶面,说明复合粒子中的Ag为面心立方晶系的单质Ag,结晶良好;衍射角2θ为25.30°、38.10°、48.90°、54.38°、55.06°处的四个吸收峰,对应标准衍射谱图(JCPDS 84-1285)中锐钛矿相TiO2的(101)、(111)、(200)、(105)、(211)晶面,其中2θ为38.1°处吸收峰与立方晶相Ag的38.2°(111)晶面吸收峰部分重叠。除此之外,复合粒子中的锐钛型TiO2粒子其他弱衍射峰没有显现,原因可能是Ag掺杂阻碍了锐钛矿TiO2晶粒中Ti与O离子间的重排,晶粒的生长因此受到抑制,结晶不完善[11]。由以上分析可以确定Ag-TiO2粉体是由立方晶系单质Ag和锐钛型TiO2组成的。
使用X射线光电子能谱仪(XPS)对以上制备的Ag-TiO2粉体进行Ag的化学价态分析,以C在289.6eV处的1s峰作为结合能参考值,结果如图3所示。Ag谱图中,在368.2eV和374.2eV处出现了对应于Ag的3d5/2和3d3/2两个光电子峰,说明本实验制备的Ag-TiO2复合纳米粉体中Ag为金属态的单质Ag[12];结合XRD分析,Ag与TiO2间没有明显的化学作用,粉体中的单质Ag具有很高的化学稳定性。
2.2Ag掺量对光催化降解的影响
按照1.2.3.1实验方法,采用掺Ag量分别为2%、4%、6%、8%、10%、12%的Ag-TiO2复合纳米粉体光催化降解目标甲醛溶液,结果如图4所示。
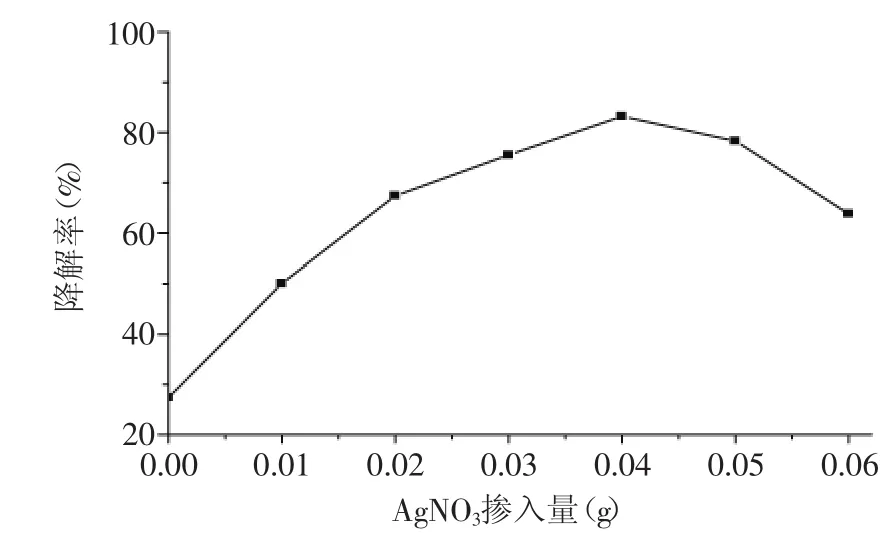
图4 Ag掺量对甲醛降解率的影响Fig.4 The influence of doped quantity of Ag on photocatalytic degradation rate
由图4可以看出,Ag掺杂可以明显提高TiO2粉体的光催化活性,甲醛降解率随着Ag掺量的增加呈现先升后降的变化趋势。本实验条件下,当Ag(NO)3掺入量为0.04g(8%Ag)时,Ag-TiO2复合纳米粉体的光催化活性最高。产生上述变化的主要原因是:Ag掺杂量较少时,掺入Ag使得TiO2能级中产生附加能级,电子从附加能级上向价带或导带跃迁相对容易,降低了TiO2的禁带宽度,从而增加其光催化活性;当Ag的掺杂量超过某一极限时,过量的Ag开始在TiO2堆积并使电子在Ag上发生积累、形成电场并吸引空穴,此时堆积在TiO2表面的Ag成为电子和空穴的复合中心,增大了电子空穴的复合几率[13],从而降低TiO2的光催化活性。
2.3甲醛浓度对光催化降解的影响
按照1.2.3.2实验方法,采用8%Ag掺杂的TiO2复合纳米粉体光催化降解浓度为0.1、0.2、0.3、0.4、0.5mg/mL甲醛溶液,结果如图5所示。

图5 不同初始浓度对甲醛降解率的影响Fig.5 The influence of different initial concentrations of HCHO on photocatalytic degradation rate
由图5可见,定量的Ag-TiO2复合纳米粉体对于低浓度甲醛溶液具有较高的降解率。这是由于溶液中甲醛的光催化降解过程包括吸附和光催化两个过程[14],高浓度甲醛易在催化剂表面达到饱和,随着甲醛浓度增大会造成过量吸附,进而抑制光催化反应并降低甲醛降解率;此外,在相同反应条件下,单位时间内催化剂光激发产生的高活性光生空穴(h+)和光生电子(e)数目一定,甲醛浓度越低,反而有助于增大单位甲醛的光催化反应率,提高降解率。单位质量Ag-TiO2催化剂的甲醛去除量随着溶液中甲醛浓度的升高而增大,实验条件下反应420min后,浓度为0.1、0.2、0.3、0.4、0.5mg/mL甲醛溶液的甲醛去除量分别为88.4、163.8、230.4、274.4、293.5mg/g。
2.4溶液pH对光催化降解的影响
按照1.2.3.3实验方法,不同pH(pH=2、4、6、8)对于Ag-TiO2复合纳米粉体降解甲醛行为的影响如图6所示。实验中pH系指反应物混合后用HCl和NaOH调节的溶液初始pH,而随反应的进行,溶液酸性会逐渐增强。这是由于价带上空穴h+可将OH-氧化成为·OH、同时氧化H2O成为·OH和H+,使得降解液的酸性增强、pH缓慢下降[15]。

图6 pH对甲醛降解率的影响Fig.6 The influence of pH of formaldehyde solution on photocatalytic degradation rate
如图6所示,当调节降解液的初始pH=2时,反应300min后0.1mg/mL甲醛溶液的降解率即达93.1%;对比2.3反应中,未调节降解液初始pH的同浓度甲醛溶液,在相同的反应时间降解率仅为77.2%。pH=2时甲醛的降解率增幅为20.6%,说明H+可以提高Ag-TiO2复合纳米粉体的光催化活性。随着溶液pH的上升,Ag-TiO2复合纳米粉体的光催化活性逐渐降低,尤其是当溶液pH=8时,甲醛降解率大幅下降。究其原因,溶液中锐钛矿相TiO2的等电点为6.1,当催化反应体系的pH从6逐渐降低时,吸附于TiO2表面的电势决定离子(H+)间的静电斥力增大,使得溶液中TiO2颗粒相互排斥、分散性增强,Ag-TiO2催化剂的比表面积增大,有助于提高甲醛吸附量,加快光催化反应速率[16]。而在碱性条件下,TiO2表面的Ag+会与溶液中的OH-作用生成沉淀吸附在复合纳米催化剂表面,降低其光催化活性。
2.5光催化降解甲醛反应的动力学分析
为了研究Ag-TiO2复合纳米粉体光催化降解甲醛反应的动力学行为,依据1.2.3.2不同甲醛初始浓度对光催化降解率的影响实验,以ln(C0/C)对反应时间t作图,其中C0为甲醛初始浓度、C为催化反应一段时间后的甲醛剩余浓度,如图7所示;相应的动力学方程如表1所示。

图7 光催化降解反应的一级动力学拟合曲线Fig.7 First order reaction kinetic liner fitting of photocatalytic degradation reaction

表1 不同初始浓度甲醛光催化降解的一级动力学方程Table 1 First order reaction kinetic equations of the effect of different initial concentration on photocatalytic degradation
如表1所示,ln(C0/C)对反应时间t进行线性拟合的相关系数R2均值大于0.99,回归方程线性良好,符合朗格缪尔-欣伍(Langmiur-Hinshelwood)模型的一级动力学特征[17],说明Ag-TiO2复合纳米粉体光催化降解甲醛为一级反应,甲醛在Ag-TiO2复合纳米催化剂表面的吸附是影响反应速率的主要因素。
3 结论
采用溶胶-凝胶法制备了具有良好分散性的Ag-TiO2复合纳米粉体,平均粒径20~50nm。XRD及XPS检测表明,Ag-TiO2粉体是由立方晶系单质Ag和锐钛型TiO2组成,Ag掺杂未明显改变TiO2的晶格结构,Ag-TiO2粉体中Ag具有很高的化学稳定性。
掺杂少量Ag将有助于提升Ag-TiO2复合纳米粉体光催化降解甲醛的反应活性,但掺Ag量超过一定值时反而会降低甲醛的降解率。实验条件下,8%Ag掺量的Ag-TiO2复合纳米粉体具有最高的光催化活性;定量的Ag-TiO2复合纳米粉体对于低浓度甲醛溶液具有较高的降解率,而高浓度甲醛易于造成催化剂过量吸附,进而抑制光催化反应;甲醛溶液pH减小将提高Ag-TiO2复合纳米粉体分散性,增大催化剂的比表面积,提高甲醛吸附量,进而加快光催化反应速率。
Ag-TiO2复合纳米粉体光催化降解溶液中甲醛反应符合L-H模型的一级动力学特征,属于一级反应。
Ag-TiO2复合纳米粉体具有良好的光催化活性,可以有效清除水溶液中的甲醛。在200mL浓度为0.1mg/mL甲醛水溶液中,添加0.20g掺Ag量8%的Ag-TiO2光催化剂,调节溶液pH=2,磁力搅拌下预吸附60min,随后使用40W 365nm紫外灯辐照300min,甲醛降解率即可达到93.1%,初步具有应用前景。
[1]张瑾.甲醛毒性的研究进展[J].职业与健康,2006,22(23):2041-2044.
[2]励建荣,朱军莉.食品中内源性甲醛的研究进展[J].中国食品学报,2011,11(9):247-257.
[3]俞其林,励建荣.食品中甲醛的来源与控制[J].现代食品科技,2007,23(10):76-78.
[4]Craig A Grimes,Gopal K.MorTiO2Nanotube Arrays[M].New York:Springer-Verlag Inc,2009.
[5]李清春,张景强.食品抗菌包装纸的研究[J].食品工业科技,2008,29(8):228-230,247.
[6]Naik K,Kowshik M.Anti-quorum sensing activity of agcl-tio2 nanoparticles with potential use as active food packaging material[J].J Appl Microbiol,2014,117(4):972-983.
[7]郑红娟,张爱民,石瑞成.Ag/TiO2纳米粒子的制备与表征[J].四川大学学报:工程科学版,2009,41(6):137-140.
[8]SC/T3025-2006水产品中甲醛的测定[S].北京:中国标准出版社,2006.
[9]程春梅,朱军辉.食品中甲醛的来源及其检测方法研究进展[J].食品科技,2008,23(1):208-210.
[10]杨昕宇,向卫东.掺杂Ag对TiO2粉末晶型结构的影响[J].硅酸盐通报,2007,26(3):478-481,493.
[11]Khanna P K,Singh N,Charan S.Synthesis of nano-particles of anatase-TiO2and preparation of its optically transparent film in PVA[J].Mater Lett,2007,61(25):4725-4730.
[12]Hongyuan Wang,Junfeng Niu,Xingxing Long,et al. Sonophotocatalytic degradation of methyl orange by nano-sized Ag/TiO2particles in aqueous solutions[J].Ultrason Sonochem,2008(15):386-392.
[13]王丹军,郭莉,李东升,等.载银TiO2光催化剂的合成及活性研究[J].环境科学与技术,2010,33(4):15-19,83.
[14]齐虹,孙德智,迟国庆.光催化降解甲醛的影响因素及动力学研究[J].哈尔滨工业大学学报,2006,38(7):1051-1054.
[15]阎建辉,黄可龙,刘素琴,等.银沉积纳米TiO2光催化剂的制备及活性[J].应用化学,2005,22(2):132-137.
[16]高濂,郑珊,张青红.纳米氧化钛光催化材料及应用[M].北京:化学工业出版社,2002.
[17]Chen J,David O F.Kinetic processes of photocatalytic mineralization of alcohols on metalized titanium dioxide[J].Wat Res,1999,33(5):1173-1180.
Preparation of Ag-TiO2nanocomposite photocatalyst and research on its degradation to formaldehyde from aqueous solution
WU Yong-jun
(Maanshan Teacher’s College,Software and Food Engineering Department,Ma’anshan 243041,China)
Ag-TiO2nanocomposite photocatalyst were prepared by the sol-gel method with Ti(OBu)4as precursor. The samples had been characterized by SEM,XRD and XPS techniques.Test results showed that Ag-TiO2nanoparticles were cubic anatase phase and the average particle size was in the range of 20~50nm.Removal rate of formaldehyde with different Ag doping quantity,initial formaldehyde concentration and solution pH were studied in the absence of light.The results showed that the optimal doped quantity under the experimental condition was 8%,Ag-TiO2nanocomposite photocatalyst had higher degradation rate to low concentration formaldehyde solution,and the photocatalytic activity of Ag-TiO2gradually reduced with the increase of solution pH.Under the optimal conditions,0.20g Ag-TiO2photocatalyst with Ag-doping content was 8%was added in 200mL 0.1mg/mL formaldehyde,the solution pH was adjusted to 2,formaldehyde degradation rate could reach 93.1%after UV irradiation for 300min.The kinetics of formaldehyde degradation by Ag-TiO2nanocomposite photocatalyst could be described by Langmuir-Hinshelwood first-order kinetics model.
TiO2;Ag doped;formaldehyde;photocatalytic;degradation
TS201.2
B
1002-0306(2015)12-0249-05
10.13386/j.issn1002-0306.2015.12.044
2014-09-01
吴永军(1978-),男,硕士,副教授,研究方向:功能材料、食品工程。
安徽省高校省级自然科学重点研究项目(KJ2014A246)。

