乙醇胁迫对啤酒酵母生长及蛋白表达的影响
何英英,尹 花,缪锦来,杜 宁,郑 洲,*
(1.啤酒生物发酵工程国家重点实验室,山东青岛266061;2.国家海洋局生物活性物质重点实验室,山东青岛266061)
乙醇胁迫对啤酒酵母生长及蛋白表达的影响
何英英1,2,尹花1,+,缪锦来2,杜宁2,郑洲2,*
(1.啤酒生物发酵工程国家重点实验室,山东青岛266061;2.国家海洋局生物活性物质重点实验室,山东青岛266061)
研究了乙醇胁迫对啤酒酵母生长的影响,应用光镊拉曼光谱(LTRS)技术获得并分析酵母单细胞拉曼光谱,从分子水平分析酿酒酵母细胞内的蛋白质组变化。结果表明乙醇可抑制酵母生长,随着乙醇浓度的提高,酵母细胞直径变小、稳定期推迟、生物量和蛋白质含量也呈减少趋势;通过光镊拉曼光谱分析可了解酵母细胞内的乙醇浓度和生化组成的相对含量等信息;在不同乙醇浓度下,采用SDS变性凝胶电泳(SDS-PAGE)共检测到22个明显的差异条带,并对其中7个差异条带进行质谱鉴定,发现这7个差异蛋白的功能主要与端粒稳定性、细胞自溶及代谢相关;不同乙醇浓度可诱导酵母特定蛋白质表达发生变化,如HSP104等蛋白质,说明这些蛋白质所参与的代谢途径在啤酒酵母乙醇耐性中具有普遍作用。
啤酒酵母,乙醇胁迫,蛋白质组
啤酒因其具有的营养和保健作用而备受人们推崇,是当前最受欢迎的饮料之一。啤酒酵母的生物学特性是决定啤酒质量和特色的重要因素之一,直接决定着啤酒的特点、风味及质量。啤酒厂家高度重视啤酒酵母的质量控制,把啤酒酵母的优化、选育工作放在极其重要的位置。在啤酒高浓度发酵时,高浓度底物相应地也会生成较高浓度的酒精,过高的酒精浓度对酵母有毒性,会抑制细胞的生长及发酵活性,酵母的发酵能力在很大程度上取决于其自身酒精耐受力的大小[1-2],酿酒酵母对生理胁迫的耐受机理一直是研究者们研究的热点。随着科技进步,诸如蛋白质组学、代谢组学等一些新技术已被逐渐应用于酿酒酵母对乙醇耐受性及相关问题的研究[3-4],这将极大促进人们对酿酒酵母乙醇耐受性方面的相关研究。
目前高浓度发酵是啤酒工业的主要工艺。尽管啤酒酵母对酒精的耐受力很强,但还是有一个乙醇的耐受力极限,超过一定的限度时,乙醇对啤酒酵母就有毒害作用。乙醇对啤酒酵母的影响是啤酒质量控制关键环节之一,但乙醇含量对啤酒酵母生长及蛋白表达影响的研究较少。王祥余等建立了酿酒酵母胞外和胞内蛋白双向电泳图谱制作方法,赵绍辉等完成了酿酒酵母蛋白质双向电泳条件优化及图谱建立,但均未对差异蛋白进行分析[5-6]。本文以啤酒酵母为对象,研究了乙醇对啤酒酵母生长和体内蛋白表达的影响,并应用光镊拉曼光谱技术(laser tweezers Raman spectroscopy,LTRS)获得酵母单细胞拉曼光谱,以期为啤酒酵母的优选和发酵提供科学依据。
1 材料与方法
1.1材料与仪器
啤酒酵母菌株国家海洋局海洋活性物质重点实验室保存;YPD培养基酵母膏10g、蛋白胨20g、葡萄糖20g,加水至1000mL;无水乙醇、碳酸氢铵、盐酸均购自北京化工厂;小牛血清白蛋白、蛋白Marker购自北京全式金生物技术有限公司;考马斯亮蓝R-250、乙腈、胰蛋白酶(250U/mg)、三羟甲基氨基甲烷(Tris)、三氟乙酸均购自Amresco公司;丙烯酰胺、β-巯基乙醇、十二烷基磺酸钠(SDS)、二硫苏糖醇(DTT) 均购自Amersham Pharmacia Biotech公司。
YXQ-LS-50S立式压力蒸汽灭菌锅上海博迅实业有限公司;PHS-3C雷磁精密pH计上海精密科学仪器有限公司;超净工作台上海新苗医疗器械制造有限公司;752SP紫外可见光分光光度计上海棱光技术有限公司;XSZ-3C相差显微镜上海博迅实业有限公司;TGL-16B台式离心机上海安亭科学仪器厂;2-16K高速冷冻离心机德国Sigma公司;PAC1000电泳仪BIO-RAD;FluorChem5500紫外分析仪Alpha Innotech;激光镊子拉曼光谱系统广西科学院;ABI 4700基质辅助激光解吸离子飞行时间质谱仪美国应用生物系统公司。
1.2实验方法
1.2.1细胞大小的测定将菌种接入液体培养基中,30℃、170r/min培养18h(对数期)进行活化,然后分别转接到乙醇浓度为0%、2.5%、5%、7.5%、10%、15%的摇瓶中培养(30℃、170r/min),分别在1h(延滞期)、8h(对数期)和16h(稳定期)时取样,在显微镜下根据标尺测量啤酒酵母细胞大小。
1.2.2生长曲线的测定将菌种接入液体培养基中,30℃、170r/min,培养18h(对数期)进行活化,然后分别转接到乙醇浓度为0%、2.5%、5%、7.5%、10%、15%的摇瓶中培养(30℃、170r/min),每隔1h取样,测OD600。
1.2.3单细胞拉曼光谱测定收集培养20h后的啤酒酵母细胞,利用激光镊子拉曼光谱系统采集和分析其拉曼光谱,实验条件是激光波长780nm,激光功率10mW,光谱收集时间20s。所有数据均以ASCII形式输入Micro Origin 7.0进行统计分析。为获得每个样品的平均光谱,在样品内部每个细胞的拉曼光谱先减去其各自背景光谱后进行平均,然后进行相邻五点平滑处理。
1.2.4啤酒酵母蛋白的提取发酵液离心(4℃、12000×g离心10min)收集菌体,用0.85%NaCl溶液离心(4℃、12000×g离心10min)洗涤两次,弃上清液;按1∶3(v/v)加SDS提取液(64mmol/L Tris-HCl,10%甘油,2%SDS,5%β-巯基乙醇),对菌体进行液氮研磨破碎菌体,每次研磨5min,研磨两次;再进行超声波破碎(超声3s,间隙3s,全程2min,功率600W);12000r/min、4℃冷冻离心10min,取上清-20℃备用;蛋白质含量采用Bradford法测定[7],用小牛血清白蛋白(BSA)作标准蛋白。
1.2.5SDS-PAGE采用Laemmli法[8],分离胶为15%的丙烯酰胺,浓缩胶为5%的丙烯酰胺,恒流先以4mA电泳、进入分离胶后再以10mA电泳,完成后剥离胶用考马斯亮蓝R-250进行染色。采用紫外分析仪进行图像采集,并用配套软件Alpha 2200对SDS-PAGE图谱进行条带的采集和分析。
1.2.6蛋白质质谱鉴定用干净的刀片将蛋白条带从胶上切割下来,放入1.5mL的离心管内,加少量的双蒸水后将离心管放入4℃冰箱保存。将胶块清洗几次后用50%乙腈-50mmol/L碳酸氢铵(pH8.0)溶液浸泡胶块,振荡20min后弃去溶液,重复1~2次至胶块中颜色褪尽;用100%乙腈100μL对胶进行干燥,然后移去其中的乙腈,将胶块放入37℃烘箱中5~10min;加入5~10μL浓度12.5ng/μL的胰蛋白酶溶液,4℃冰箱中约30min,取出后在37℃烘箱中酶解过夜;50%乙腈-0.1%三氟乙酸60μL处理30~40min后,将溶液转移到新的96孔板内,重复2~3次。将肽段溶液在N2气流下吹干浓缩,采用基质辅助激光解吸电离飞行时间质谱技术(MALDI-TOF-MS/MS)的质谱方法进行鉴定。
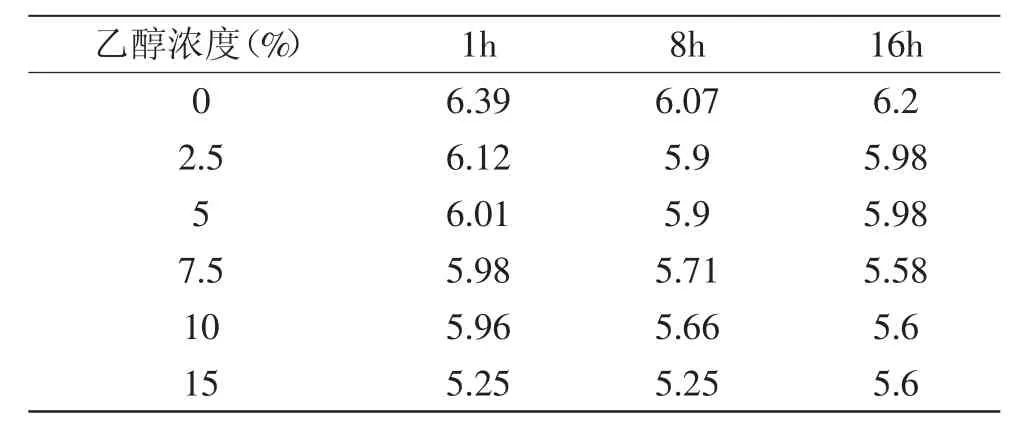
表1 啤酒酵母细胞直径(μm)Table 1 The cell diameter result of S.cerevisiae protein(μm)
2 结果与分析
2.1不同浓度乙醇对啤酒酵母细胞形态的影响
在不同浓度乙醇作用下,乙醇浓度越高啤酒酵母菌体直径越小(表1);而且随着乙醇浓度的增大,细胞形态也发生一定的改变,乙醇浓度高时细胞呈椭圆形(15%时尤其明显)(图1)。这是乙醇胁迫下啤酒酵母细胞的表观反应,也说明乙醇的存在对酵母细胞的生长起抑制作用。

图1 不同浓度乙醇对啤酒酵母细胞形态的影响(10×40)Fig.1 Effect of different concentrations of ethanol on the morphology of S.cerevisiae(10×40)
2.2不同浓度乙醇对啤酒酵母生长的影响
随着乙醇浓度的提高,酵母达到稳定期时的生物量明显减少,而且稳定期逐渐推迟(图2)。在没有乙醇的培养条件下,酵母细胞在2h时进入对数期,10h时基本达到稳定期,18h时出现了二次生长现象。在2.5%乙醇培养下的酵母细胞,生长曲线趋势基本与无乙醇时一致,只是细胞数量有所减少。在5%乙醇胁迫下,酵母细胞在5h左右进入对数期,进入稳定期的时间也有所推迟,大约在13h左右。在7.5%乙醇的胁迫下,细胞停留在迟滞期的时间进一步延长,6h时才进入对数期,15h左右进入稳定期。在10%乙醇下,该现象更加明显,7h达到对数期,17h进入稳定期,二次生长现象不明显,细胞数量明显减少,证明乙醇胁迫下细胞生长受到抑制。

图2 不同浓度乙醇对酵母细胞生长的影响Fig.2 Effect of different concentrations of ethanol on the growth of S.cerevisiae
2.3不同浓度乙醇对啤酒酵母细胞蛋白质含量的影响
由图3可以看出,随着培养时间的增长,啤酒酵母细胞的总蛋白含量逐渐增加;而随着培养时加入乙醇含量的增高,蛋白量呈减少趋势,这种减少趋势与乙醇胁迫下的啤酒酵母生长曲线的变化趋势一致。

图3 不同浓度乙醇对酵母细胞蛋白质含量的影响Fig.3 Effect of different concentrations of ethanol on the protein content of S.cerevisiae
2.4啤酒酵母单细胞拉曼光谱分析
LTRS是将光学囚禁技术与显微拉曼光谱技术相结合用于单细胞探测的新技术[9],应用LTRS系统得到啤酒酵母单细胞的平均拉曼光谱(图4),光谱曲线反映了细胞内的生化组成及其相对含量。图4中有蛋白质、脂类、DNA、糖类和乙醇等对应的信号峰[10-11];其中881cm-1峰对应是乙醇,峰强显示发酵后的乙醇浓度接近8%。因此,可通过实时观察单个细胞的生物化学过程,分析拉曼光谱特征峰的位置、强度等可以获知掩盖在群体平均信息下的个体生命信息和实时生命物质变化的信息,从而有效地了解细胞的真实生理变化。

图4 啤酒酵母的平均拉曼光谱图Fig.4 Mean Raman spectrum of single S.cerevisiae
2.5蛋白质谱分析
不同时期、不同浓度乙醇胁迫下的啤酒酵母细胞蛋白质SDS-PAGE见图5,可见其蛋白表达具有差异,其中22个酵母蛋白条带表达差异明显;且不同乙醇浓度可诱导酵母相同蛋白质表达发生变化,如蛋白条带4,说明这些蛋白质所参与的代谢途径在啤酒酵母乙醇耐性中具有普遍作用。选取7个差异比较明显的条带(编号依次为1~7)进行质谱鉴定,结果如表2所示,其中5个蛋白与啤酒酵母应激乙醇胁迫有关。

表2 啤酒酵母蛋白质肽质量指纹图谱鉴定结果Table 2 Peptide mass fingerprinting appraisal result of S.cerevisiae protein

图5 啤酒酵母蛋白电泳Fig.5 Protein profile of S.cerevisiae on 15%SDS-PAGE
蛋白条带1:Yef3p是一种重要的蛋白质,具有维持端粒结构的作用,它在细胞受到营养物质而胁迫时,会引导细胞进行最优化的转录,它还与核糖体的作用相关联,并涉及酵母细胞生长的中枢控制因子TOR(target of rapamycin)信号通路,外界营养因素可通过TOR信号通路的作用控制酵母细胞的生长[12]。
蛋白条带2:缬氨酰-tRNA合成酶(valyl-tRNA synthetase)的作用主要是催化如下反应[13]:ATP+L-valine+tRNA(Val)=AMP+diphosphate+L-valyl-tRNA(Val)。说明酵母在乙醇胁迫的过程中,细胞对缬氨酸的利用大幅上调与应对乙醇胁迫相关。
蛋白条带3:异亮氨酸-tRNA合成酶(isoleucyltRNA synthetase)它具有两方面的作用,一方面它作为异亮氨酸合成酶;另一方面它是Reveromycin A特定的抑制位点,而Reveromycin A会导致细胞自溶[14]。
蛋白条带4:热激蛋白104(heat shock protein 104,HSP104)可能作为一种通用的保护蛋白质,在酵母细胞受到生理胁迫时进行过量表达[15]。它的作用很可能让濒临逆境胁迫的酵母细胞逐渐适应新的环境而得以继续生存。
蛋白条带5:乙酰转移酶(acetyl transferase)是酵母细胞中一类重要的蛋白质,它参与酵母细胞中半数以上蛋白质N末端的乙酰基化[16]。乙酰转移酶活性是发酵过程中影响酯类生成的最重要的因素,与啤酒的风味密切相关。
蛋白条带6:ATP结合蛋白(ATP binding protein)与蛋白质的折叠以及向液泡转送蛋白质相关,它还与分子伴侣的T复合物相关,在细胞质、液泡及细胞壁中都有出现[17]。
蛋白条带7:丙酮酸脱羧酶(pyruvate decarboxylase isozyme)是酿酒酵母代谢途径中的关键调节酶,它催化的反应是利用丙酮酸生成乙醛,其活性直接影响酿酒酵母发酵产物。
3 结论
乙醇可抑制啤酒酵母细胞生长,随着乙醇浓度的提高,酵母细胞的直径变小,酵母达到稳定期时的生物量明显减少,稳定期逐渐推迟,蛋白质含量也呈减少趋势。利用LTRS技术获得了酵母细胞内的乙醇浓度和生化组成的相对含量,可通过实时观察单个酵母细胞的生物化学过程,更有效地了解酵母细胞的真实生理变化。在不同乙醇浓度下,采用SDS-PAGE检测到22个表达差异条带,并对其中7个进行质谱鉴定,发现其蛋白的功能主要与端粒稳定性、细胞自溶及各种关键代谢有关。不同乙醇浓度可诱导酵母特定蛋白质表达发生变化,如HSP104等蛋白质,说明这些蛋白质所参与的代谢途径在啤酒酵母乙醇耐性中具有普遍作用,可为啤酒酵母的优选和发酵提供科学依据。
[1]Skory CD.Lactic acid production by Saccharomyces cerevisiae expressing a Rhizopus oryzae lactate dehydrogenase gene[J].J Ind Microbiol Biot,2003,30(8):22-27.
[2]凌猛,祖国仁,曹磊.高耐性优良啤酒酵母茵的选育及其高浓发酵后啤酒风味的研究[J].中国酿造,2010,223(93):92-95.
[3]Son HS,Hwang GS,Kim KM,et al.1H NMR-based metabolomicapproachforunderstandingthefermentation behaviors of wine yeast strains[J].Anal Chem,2009,81(3):1137-1145.
[4]Ye Y,Zhu Y,Pan L,et al.Gaining insight into the response logic of Saccharomyces cerevisiae to heat shock by combining expression profiles with metabolic pathways[J].Biochem Biophys Res Commun,2009,385(3):357-362.
[5]王祥余,朴永哲,翟明昌,等.酿酒酵母FFC2146胞内蛋白及胞外蛋白双向电泳条件优化及图谱建立[J].微生物学通报,2011,32(8):270-274.
[6]赵绍辉,周景文,堵国成,等.酿酒酵母蛋白质双向电泳条件优化及图谱建立[J].食品与生物技术学报,2014,33(3):235-240.
[7]Bradford MM.A rapid and sensitive method for the quantitationof microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976,72:248-254.
[8]Laemmli UK.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[9]Xie C,Dinno MA,Li YQ.Near-infrared Raman spectroscopy of single optically trapped biological cells[J].Opt Lett,2002,27(4):249-251.
[10]Stone N,Kendall C,Smith J,et al.Raman spectroscopy for identification of epithelial cancers[J].Faraday Discuss,2004,126:141-157.
[11]Singh GP,Volpe G,Creely CM,et al.The lag phase and G1 phaseofasingleyeastcellmonitoredbyRamanmicrospectroscopy[J].J Raman Spectrosc,2006,37:858-864.
[12]Buchan JR,Stansfield I.Halting a cellular production line:responses to ribosomal pausing during translation[J].Biol Cell,2007,99(9):475-487.
[13]Fukai S,Nureki O,Sekine S,et al.Structural basis for double-sieve discrimination of L-valine from L-isoleucine and L-threonine by the complex of tRNA(Val)and valyl-tRNA synthetase[J].Cell,2000,103(5):793-803.
[14]Miyamoto Y,Machida K,Mizunuma M,et al.Identification of Saccharomyces cerevisiae isoleucyl-tRNA synthetase as a target of the G1-specific inhibitor Reveromycin A[J].J Biol Chem,2002,277(32):28810-28814.
[15]Glover JR,Lindquist S.Hsp104,Hsp70,and Hsp40:a novel chaperone system that rescues previously aggregated proteins[J]. Cell,1998,94(1):73-82.
[16]Verstrepen KJ,Van Laere SD,Vercammen J,et al.The Saccharomyces cerevisiae alcohol acetyl transferase Atf1p is localized in lipid particles[J].Yeast,2004,21(4):367-377.
[17]Burgess S1,Couto JR,Guthrie C.A putative ATP binding protein influences the fidelity of branchpoint recognition in yeast splicing[J].Cell,1990,60(5):705-717.

图6 超声波处理对矢车菊素在β-胡萝卜素-亚油酸体系中的抗氧化活性影响Fig.6 Effectofultrasonictreatmentonthetheantioxidantactivities of cyanidin measured by β-carotene-linoleic acid system
3 结论
随着超声波处理时间的延长、功率增大,桑葚中花色苷矢车菊素的稳定性显著(p<0.05)降低,即超声波会使花色苷发生降解,抗氧化能力降低,整个溶液体系的FRAP和DPPH均下降。由于花色苷具有多种对人体有利的生理功能,而超声波在加工应用中会降低花色苷的稳定性,造成其部分降解,降低商品价值,因此为降低其对花色苷的破坏程度,应尽量选用低功率,短时间处理。
参考文献
[1]陈小全,周鲁,左之利,等.超声波作用下桑葚红色素的提取及其稳定性实验[J].西南民族大学学报:自然科学版,2004,30(4):458-459.
[2]张志强,杨清香,孙来华.桑葚的开发及利用现状[J].中国食品添加剂,2009,4:65-68.
[3]陈亮,辛秀兰,袁其朋.野生桑葚中花色苷成分分析[J].食品工业科技,2012,33(15):307-310.
[4]Mazza G,Miniati E.Anthocyanins in fruits,vegetables,and grains[M].CRC press,1993.
[5]D’Amico D J,Silk T M,Wu J R,et al.Inactivation of microorganisms in milk and apple cider treated with ultrasound. Journal of Food Protection,2006,69(3):556-563.
[6]张永林,杜先锋.超声波及其在粮食食品工业中的应用[J].西部粮油科技,1999,24(2):14-16.
[7]Farid C,Zill-e-Huma,Khan M K.Applications of ultrasound in food technology:Processing,preservation and extraction[J]. Ultrasonics Sonochemistry,2011,18:813-835.
[8]宋国胜,胡松青,李琳.超声波技术在食品科学中的应用与研究[J].现代食品科技,2008,24(6):609-612.
[9]陈健,孙爱东,高雪娟,等.蓝莓花青素的提取及抗氧化性的研究[J].北京林业大学学报,2011,33(2):126-130.
[10]Kong J M,Chia L S,Goh N K,et al.Analysis and biological activities of anthocyanins[J].Phytochemistry,2003,64(5):923-933.
[11]曹霞敏,孙建霞,廖小军,等.加工方法对草莓中抗氧化活性物质与抗氧化活性的影响[J].食品工业科技,2010(9):390-393.
[12]张燕.高压脉冲电场技术辅助提取树莓花色苷研究[D].北京:中国农业大学,2007.
[13]董楠,雷丹丹,刘嘉,等.花色苷的热稳定性及其影响因素研究[J].食品工业科技,2012,33(7):393-396.
[14]李颖畅,孟宪军,周艳,等.金属离子和食品添加剂对蓝莓花色苷稳定性的影响[J].食品科学,2009,30(9):80-84.
[15]Siddhuraju P,Becker K.The antioxidant and free radical scavenging activities of processed cowpea seed(Vigna unguiculata(L.)Walp.)extracts[J].Food Chemistry,2007,101(1):10-19.
[16]Thaipong K,Boonprakob U,Crosby K,et al.Comparison of ABTS,DPPH,FRAP,and ORAC assays for estimating antioxidant activity from guava fruit extracts[J].Journal of Food Composition and Analysis,2006,19(6-7):669-675.
[17]黄海兰,赵祖亮,王斌贵.磷钼络合物法与β-胡萝卜素-亚油酸法测定海藻脂类成分抗氧化活性的比较[J].中国油脂,2005,30(3):32-35.
Effect of ethanol stress on the growth and protein expression of Saccharomyces cerevisiae
HE Ying-ying1,2,YIN Hua1,+,MIAO Jin-lai2,DU Ning2,ZHENG Zhou2,*
(1.State Key Laboratory of Biological Fermentation Engineering of Beer,Qingdao 266061,China;2.Key Laboratory of Marine Bioactive Substance,State Oceanic Administration,Qingdao 266061,China)
This paper studied the effect of ethanol stress on the growth situation of Saccharomyces cerevisiae,the Raman spectroscopic of its cells were got and analyzed by laser tweezers Raman spectroscopy(LTRS),and the proteomic changes in its cells were analyzed at the molecular level.The results showed that the ethanol could inhibit yeast growth.With the ethanol concentration increasing,the yeast cell diameter decreased,stable period delay,biomass and protein content also showed a decreasing trend.The relative content of alcohol concentration and biochemical composition in Saccharomyces cerevisiae cells could be obtained used LTRS as tool.22 differential bands were detected in different concentrations of ethanol by SDS-PAGE,of which 7 differential bands were identified by mass spectrometry.The 7 proteins function mainly related to telomere stability,cell autolysis and key metabolic.Different concentrations of ethanol could induce the same protein expression changes,such as HSP104 protein,which indicated the metabolic pathway of these proteins participate play a universal role in yeast ethanol tolerance.
Saccharomyces cerevisiae;ethanol stress;proteome
TS261.1
A
1002-0306(2015)12-0147-05
10.13386/j.issn1002-0306.2015.12.022
2014-08-29+并列第一作者
何英英(1989-),女,硕士研究生,研究方向:应用微生物。尹花(1972-),女,硕士,应用研究员,研究方向:发酵工程。
郑洲(1978-),男,博士,副研究员,研究方向:应用微生物。
国家重点实验室开放基金(K2012003;K2014003)。

