枫香叶正丁醇提取物抑菌效果及其抗氧化活性研究
刘宏丁,刘亚敏,刘玉民,阎 聪,尚艳双
(西南大学资源环境学院,西南大学三峡库区生态环境教育部重点实验室,重庆400715)
枫香叶正丁醇提取物抑菌效果及其抗氧化活性研究
刘宏丁,刘亚敏*,刘玉民,阎聪,尚艳双
(西南大学资源环境学院,西南大学三峡库区生态环境教育部重点实验室,重庆400715)
采用打孔法测定抑菌圈大小和试管连续稀释法测定最小抑菌浓度(MIC),研究了枫香叶正丁醇提取物抑菌效果,并测定其对DPPH自由基、超氧阴离子自由基和羟自由基的清除活性。结果表明:枫香叶正丁醇提取物对7种实验菌均有抑制作用,不同浓度间、不同菌种间存在极显著(p<0.01)差异;且对细菌的抑制作用强于真菌,对革兰氏阴性菌的抑菌效果比革兰氏阳性菌好;对大肠杆菌、枯草杆菌、金黄色葡萄球菌、四联球菌、黄曲霉、黑曲霉、青霉的MIC分别为3.1、12.5、12.5、6.25、12.5、25、12.5mg/mL。枫香叶正丁醇提取物具有较强的的抗氧化活性,可作为功能性食品资源开发利用。
枫香,提取物,抑菌活性,抗氧化活性
近来频发的食品安全事件,使得食品安全问题日益凸显,备受关注。化学食品添加剂存在的安全隐患,也让人们对天然植物活性成分越来越重视[1]。使用安全、高效的天然食品添加剂,是人们的迫切需求。植物提取物是采用适当的方法,以植物为原料提取或加工的物质,具有抑菌、杀菌[2-5]、抗氧化及抗肿瘤[6-7]功效,目前已应用于果蔬保鲜[8]、化妆品、饲料添加剂、兽药和植物农药领域[9]。
枫香(Liquidambar formosana Hance)是金缕梅科(Hamamelidaceae)枫香属(Liquidambar L)代表植物,产于秦岭、淮河以南,至海南、西南、台湾[10]。具有药用[11]和观赏价值,也是建筑、家具和胶合板等的理想材料,因此也被广泛用作工业用材[12]。然而调查发现,用于工业木材的枫香主要是利用其主干和粗大侧枝,而剩余细枝和叶则没有得到合理利用。这不仅影响人们的生活环境,从资源的高效利用和经济的角度来看都是极不科学的。如何提高枫香的综合利用,是亟待解决的问题。当前也有研究表明枫香含有抑菌及抗氧化活性成分[13]。因此,本文选择7种常见的对食品卫生、临床医学和生物材料有较大影响的菌种,研究枫香叶正丁醇提取物对7种菌的抑菌作用及抗氧化效果,旨在为枫香的进一步研究提供基础数据,也为枫香的综合开发利用开阔思路。
1 材料与方法
1.1材料与仪器
枫香叶于2012年9月采自北碚茅庵林场幼年树,经西南大学林学教研室鉴定为枫香(Liquidambar formosana Hance)的叶;G-:大肠杆菌(Escherichia coli),G+:金黄色葡萄球菌(Staphylococcus aureus)、枯草杆菌(Bacillus subtilis)、四联球菌(Micrococcus tetragenus),真菌:青霉(Penicillium oxalicum.)、黄曲霉(Aspergillus flavus)、黑曲霉(Aspergillus niger)均由西南大学资源环境学院微生物实验室提供;牛肉膏蛋白胨培养基(培养细菌) 牛肉膏3g,蛋白胨5g,NaCl 5g,蒸馏水500mL,琼脂15~20g,调节pH至7.4~7.6(用NaOH调节),然后121℃蒸汽灭菌30min;马铃薯培养基(培养真菌)取去皮马铃薯20g,切成小块,在锅中加水500mL煮沸30min,用双层纱布过滤,取其滤液,加入蔗糖(或葡萄糖)2g,加琼脂15g,用蒸馏水定容到500mL,pH自然,121℃蒸汽灭菌30min;VC、1,1-二苯基-2-三硝基苯肼、铁氰化钾、邻二氮菲、三氯化铁分析纯。
超净工作台吴江市净化设备厂;LDZX-50KB立式压力蒸汽灭菌器上海申安医疗器械厂;DHP-9082电热恒温培养箱上海将任实验设备有限公司;HY-B大容振荡器金坛市国旺实验仪器厂;DHG-9075A电热恒温鼓风干燥箱北京恒泰丰科实验设备有限公司;WFH-204紫外分析仪上海精密仪器仪表有限公司;T6新世纪紫外分光光度计北京普析通用仪器有限责任公司;TGL-16G恰菲尔高速离心机上海恰菲尔分析仪器有限公司。
1.2实验方法
1.2.1提取物的制备新鲜叶子经杀青后烘干粉碎备用,精确称取枫香叶粉末1kg,以体积分数70%乙醇超声波提取50min,提取三次合并滤液,提取液依次用石油醚、氯仿、乙酸乙酯、正丁醇萃取,减压浓缩蒸干溶剂,得到正丁醇相浸膏。
1.2.2菌悬液的制备将供试菌株于斜面培养基上活化,采用试管连续稀释法,用无菌水将菌和孢子稀释为107~108cfu/mL的菌悬液,在台式振荡器中振荡10min后备用。
1.2.3药液制备取枫香叶正丁醇提取物浸膏0.01、0.03、0.05g,分别溶于1mL二甲基甲酰胺(DMF)中制备成不同浓度的药液。用于抑菌圈的测定。
总而言之,GPS系统具有数据测量的高效性、准确性和科学性,减少了工作流程中浪费的大量人力、财力、物力。现代科学技术的发展推动了GPS技术和地理信息系统的结合,二者的应用也为人们的工作和生活带来了极大的便利。在未来的日子里,研究人员还要不断完善GPS技术,为各行业提供准确有效的数据支持。
取正丁醇提取物浸膏各0.1g,溶于1mL DMF中,作为原液,以牛肉膏液体培养基(真菌用马铃薯液体培养基)倍比稀释成1∶2、1∶4、1∶8、1∶16、1∶32、1∶64、1∶128各7个浓度,即含原液浓度分别为50、25、12.5、6.25、3.1、1.5、0.75mg/mL,用于测定最低抑菌浓度(MIC)。
1.2.4含菌平板制备将新鲜配制的培养基在121℃条件下灭菌30min,当培养基冷至50~60℃时,于超净工作台上将培养基倒入经过干热灭菌的培养皿中,每皿15~20mL的培养基,待平板冷却后,每皿中加入0.3mL菌悬液,用三角玻璃棒均匀涂成薄板备用。
1.2.5抑菌圈的测定[14]打孔器法:将灭菌后冷却至50~60℃的牛肉膏培养基(细菌)和马铃薯培养基(霉菌)倒平板,待培养基凝固后,将各菌种配制的菌悬液加入到平板中制成含菌平板,然后在各平板内打孔,每个平板打四个孔(三个为药物平行,一个为DMF空白对照),按照编号加入样品。细菌37℃培养24h,霉菌28℃培养48h后,测定抑菌圈直径,根据抑菌圈直径大小确定抑菌效果。
1.2.6最低抑菌浓度的测定[14]采用试管稀释法测定最小抑菌浓度,向各管制备好的药液中加入事先制备好的菌悬液40μL,混匀后放于37℃(霉菌28℃)培养箱中培养24h。然后分别从每一试管取一接种环液体点于营养琼脂平板中,培养24h(霉菌培养48h)后确定是否有菌生长。以确定药物抑制待测菌生长的MIC值。每个浓度设三个平行管,并分别设不含萃取液的牛肉膏液体培养基(霉菌用马铃薯液体培养基)为对照管。
1.2.7清除DPPH自由基的测定方法[15]将枫香叶正丁醇提取物稀释成(0.001~0.4mg/mL)的浓度梯度,分别取2mL上述浓度梯度的提取物溶液于试管中,再向其加入4.0mL浓度为0.004mg/mL的DPPH乙醇溶液(1mg的DPPH粉末乙醇定容于250mL棕色容量瓶中),摇匀,于28℃水浴锅中水浴恒温30min,然后在517nm下迅速测其吸光度记为A1,同时测定不含提取物的空白样品记为A0。
DPPH清除率E计算公式为:

式中:A1为试样的吸光度;A0为空白样品的吸光度。

式中:A1为黄酮吸光度;A0为空白吸光度。
1.2.9清除羟自由基(·OH)的测定方法参照文献[17-18]方法,枫香叶正丁醇提取物质量浓度为0.3~1.5mg/mL,以二次蒸馏水定容至刻度后,在37℃水浴中恒温60min,于536nm处测定吸光度,以上每加1次试剂均需摇匀,同时测定不含提取物的空白样品,作自由基清除率-浓度图。
·OH清除率E计算公式为:
E(%)=(A样-A损)/(A未损-A损)×100
式中:A样为加样液的吸光度;A损为样液用溶剂代替的吸光度;A未损为不加样液和H2O2的吸光度(三者均以蒸馏水空白为参比)。
1.3数据处理
提取物抑菌圈直径采用十字交叉法测定。所有指标测定均重复三次,数据均采用Excel做统计分析,采用SPSS 17.0做方差分析和多重比较。
2 结果与分析
2.1枫香叶正丁醇提取物抑菌活性
采用打孔法测定枫香叶正丁醇提取物抑菌活性,结果见表1所示:枫香叶正丁醇提取物三个浓度对各菌种均有抑制效果,且与抑菌效果存在量效关系,其中以0.05g/mL浓度对大肠杆菌的抑制效果最好,抑菌圈达到了22.5mm,而0.01g/mL浓度对黑曲霉的抑制效果最差,只有1.2mm。整体而言,对细菌的抑制作用要明显强于真菌,这与侯美珍等[19]对紫草正丁醇提取物的研究结果一致。在细菌中,对革兰氏阴性菌中的大肠杆菌抑制效果要优于三种革兰氏阳性菌,与侯美珍等[19]的研究结果相反,这可能是因为不同植物提取的活性成分不同。对革兰氏阴性菌与阳性菌抑制效果的差异可能是二者的细胞壁在结构和化学组分上的差异而导致,其具体的原因还有待进一步研究。经方差分析(表2)可知,枫香叶正丁醇提取物对不同菌种抑菌效果及不同浓度提取物的抑菌活性都存在极显著差异(p<0.01),菌种与正丁醇提取物浓度的交互影响差异显著(p<0.05)。
2.2枫香叶正丁醇提取物的最小抑菌浓度
采用试管连续稀释法测定枫香叶正丁醇提取物最小抑菌浓度(表3),其结果与抑菌活性测定结果相符。由表3可知,提取物的浓度对大肠杆菌的影响较小,仅3.1mg/mL就能够抑制其生长,而对于真菌中的黑曲霉,提取物浓度对其影响较大,其MIC为25mg/mL,其余菌种MIC均低于12.5mg/mL。对照对各菌皆无抑制作用,排除了溶剂的干扰。其中,枯草杆菌、金黄色葡萄球菌测定结果与侯美珍等[19]的研究有较大差异,而与赵爱云等[16]的研究结果接近,这可能是因为植物中活性成分的差异引起的。
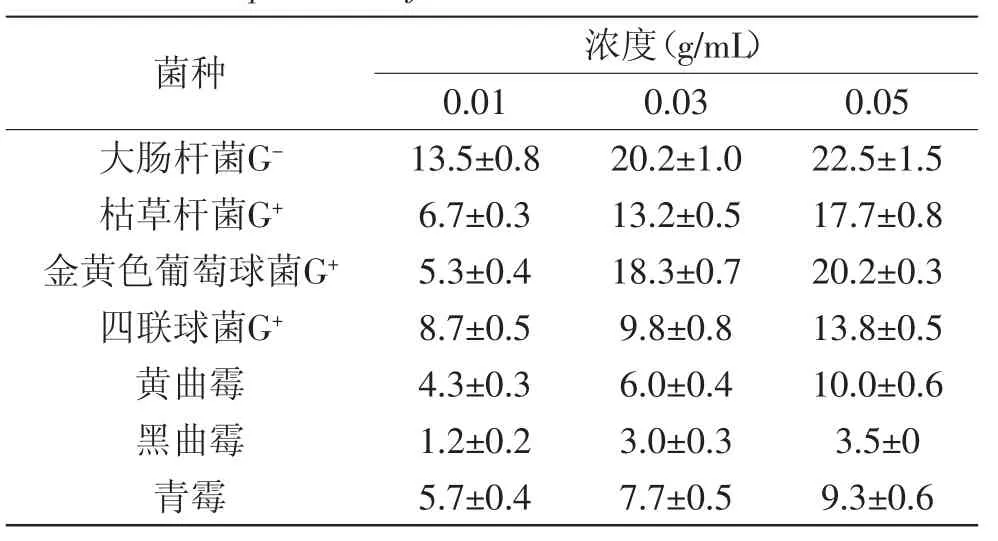
表1 枫香叶正丁醇提取物抑菌活性测定结果Table 1 Antimicrobial activity of the N-butanol extract of Liquidambar formosana Hance leaves

表2 对枫香叶正丁醇提取物抑菌效果的方差分析表Table 2 Variance analysis about antimicrobial activity of the N-butanol extract of Liquidambar formosana Hance leaves
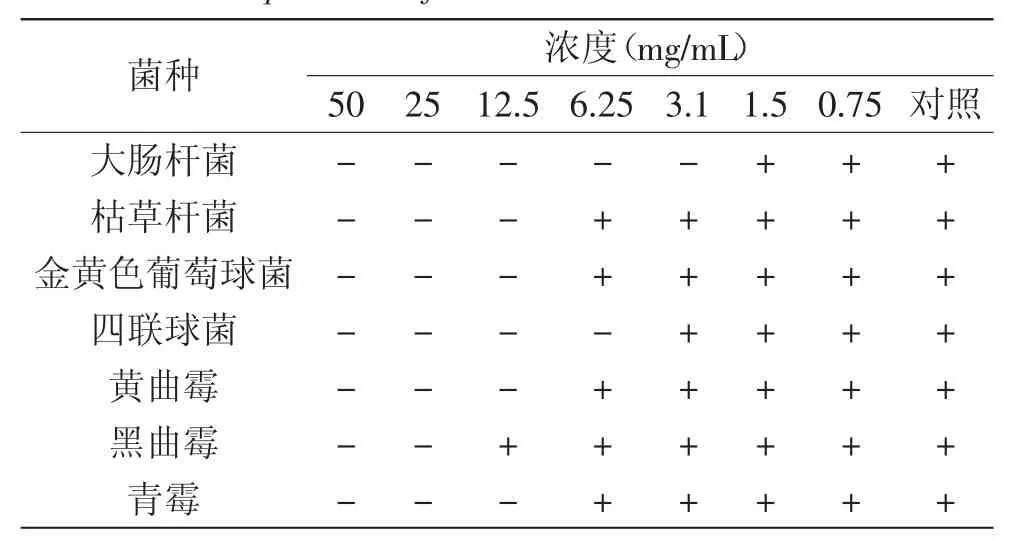
表3 枫香叶正丁醇提取物最小抑菌浓度测定结果Table 3 The results of MIC of the N-butanol extract of Liquidambar formosana Hance leaves

图1 枫香叶正丁醇提取物对DPPH·的清除率Fig.1 DPPH·scavenging rate of the N-butanol extract of Liquidambar formosana Hance leaves
2.3枫香叶正丁醇提物对DPPH·的清除活性
采用DPPH法用于评价枫香叶正丁醇提取物清除自由基的能力,结果见图1,枫香叶正丁醇提取物与VC均对DPPH·表现出很好的清除效果,正丁醇提取物的质量浓度与DPPH·的清除活性呈现明显的量效关系。在质量浓度小于0.3mg/mL时,对DPPH·的清除活性明显增强,此后随着质量浓度的增加,DPPH·的清除活性增强变缓慢。在质量浓度小于0.3mg/mL时,正丁醇与VC的DPPH·的清除活性差异明显,而当质量浓度达到0.4mg/mL时,正丁醇提取物的清除率达到92.07%,与VC清除率差异不明显。说明枫香叶正丁醇提取物达到一定质量浓度后,其对DPPH·的清除效果与VC相似。
2.4枫香叶正丁醇提物对O2-·的清除活性
结果如图2所示,枫香叶正丁醇提取物与VC均对O2-·表现出一定的清除活性,二者的清除率随质量浓度增加而递增的趋势基本一致。当质量浓度小于0.1mg/mL时,二者对O2-·的清除率大小十分接近,清除效果明显增强。而当质量浓度大于0.1mg/mL时,正丁醇提取物的清除率要高于VC,但清除效果增强缓慢。说明枫香叶正丁醇提取物中可能含有与VC相似的活性成分。通过图2可以发现,正丁醇提取物具有较强的O2-·清除活性,对O2-·清除活性的最佳质量浓度在0.2~0.3mg/mL之间。

图2 枫香叶正丁醇提取物对O2-·的清除率Fig.2 O2-·scavenging rate of the N-butanol extract of Liquidambar formosana Hance leaves
2.5枫香叶正丁醇提物对·OH的清除活性
结果如图3所示,枫香叶正丁醇提取物表现出一定程度的清除·OH的能力,并且存在明显的量效关系。其清除率随质量浓度递增的趋势与VC基本一致,在各个浓度下清除率都稍低于VC,但差异并不大,说明枫香叶正丁醇提取物对·OH的清除率要比VC稍弱。
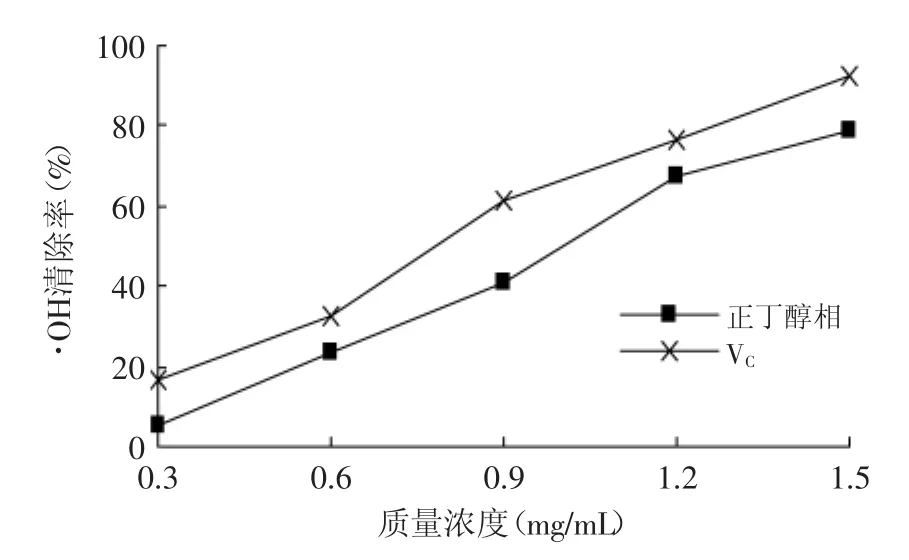
图3 枫香叶正丁醇提取物对·OH的清除率Fig.3·OH scavenging rate of the N-butanol extract of Liquidambar formosana Hance leaves
3 结论
通过对枫香叶正丁醇提取物抑菌活性的研究,发现其各个浓度梯度对7种受试菌均有一定的抑制作用,且存在显著性差异。其中,对细菌的抑制作用要明显强于真菌,对革兰氏阴性菌中的大肠杆菌抑制效果要优于三种革兰氏阳性菌。枫香叶正丁醇提取物对大肠杆菌、枯草杆菌、金黄色葡萄球菌、四联球菌、黄曲霉、黑曲霉、青霉的MIC分别为3.1、12.5、12.5、6.25、12.5、25、12.5mg/mL。但关于枫香叶正丁醇提取物对各菌的抑制机理还不清楚,后期将做进一步的研究。
本研究结果表明,枫香叶正丁醇提取物具有较强的抗氧化活性,其清除自由基能力与VC相似。但由于提取物中活性成分较多,具体是何种成分起到抗氧化作用,还有待进一步的研究。
枫香叶来源便利,但当前利用率不高,其正丁醇提取物对食品中常见微生物都具有较好的抑制效果,同时也具有较强的抗氧化活性,在食品安全、医药卫生方面具有较大的开发潜力,可以作为新的抗菌、抗氧化药源。本研究可为枫香的进一步开发利用提供基础数据。
[1]曹静,李蕴成.食品添加剂应用中存在的问题及相关对策建议[J].安徽农业科学,2013,41(18):7965-7966,7991.
[2]曾维才,贾利蓉.松针提取物抑菌作用的研究[J].食品科学,2009,30(7):89-90.
[3]赵淑艳,呼世斌,吴焕利,等.山茱萸提取物抑菌活性成分稳定性的研究[J].食品科学,2008,29(1):98-101.
[4]翟梅枝,李晓明,林奇英,等.核桃叶抑菌成分的提取及其抑菌活性[J].西北林学院学报,2003,18(4):89-91.
[5]樊明涛,陈锦屏.百里香提取物抑菌特性的研究[J].微生物学报,2001,41(4):499-504.
[6]张巧霞,梁保康,吴建勇,等.人工虫草菌HK_1与天然虫草提取物的抗肿瘤活性比较[J].中草药,2005,36(9):1346-1349.
[7]孙权,崔长旭,全吉淑,等.迷迭香提取物的抗肿瘤作用[J].食品科技,2008,4:156-157,158.
[8]关文强,李淑芬.天然植物提取物在果蔬保鲜中应用研究进展[J].农业工程学报,2006,22(7):200-204.
[9]曾建国.我国植物提取物行业科技发展现状、问题及建议[J].中草药,2006,37(1):2-12.
[10]祁承经,汤国庆.树木学[M].北京:中国林业出版社,2005:198-199.
[11]刘婷,孙玉茹,秦彩玲,等.路路通酸的抗炎镇痛作用[J].中国实验方剂学杂志,2006,12(12):45-47.
[12]江聂,姜卫兵,翁忙玲,等.枫香的园林特性及其开发利用[J].江西农业学报,2008,20(12):46-49.
[13]刘玉民,刘亚敏,李鹏霞,等.枫香叶精油抑菌活性及抗氧化活性研究[J].食品科学,2009,30(11):134-137.
[14]赵爱云,吴神怡.无花果叶提取物的抑菌作用研究[J].食品工业科技,2005,26(11):87-88.
[15]AMAROWICZ R,NACZK M,SHAHIDI F.Antioxidant activity of various fractions of non-tanin phenolics of canola hulls[J].Jagric Food Chem,2000,48:2755-2759.
[16]LIU F,OOIV EC,CHANG S T.Free radicals scavenging activity of mushroom polysaccharide extracts[J].Life Sci,1997,60:763-771.[17]杨方美,王林,胡秋辉.鼠尾藻多糖的制备及其抗氧化活性[J].食品科学,2005,26(2):224-227.
[18]张兰杰,候冬岩,辛广,等.D-氨基葡萄糖盐酸盐的制备及抗氧化特性的研究[J].食品科学,2007,28(4):103-105.
[19]侯美珍,韦红群,潘英明.紫草不同溶剂提取物抑菌活性研究[J].食品工业科技,2006,27(11):52-54.
In vitro antioxidant and antimicrobial activity of N-butanol extract from Liquidambar formosana Hance leaves
LIU Hong-ding,LIU Ya-min*,LIU Yu-min,YAN Cong,SHANG Yan-shuang
(Key Laboratory of the Three Gorges Reservoir Region’s Eco-environments,Ministry of Education,College of Resources and Environment,Southwest University,Chongqing 400715,China)
To explore antioxidant activity and inhibitory effect of N-butanol extract from Liquidambar formosana Hance leaves,in this test determine the size of the inhibition zone using drilling method and the minimum inhibitory concentrations(MIC)with tubes serial dilution method,then detect and evaluate its antioxidation activities by scavenging activity to DPPH·,superoxide anion(O2-·)and hydroxyl(·OH)free radicals.Results showed that N-butanol extract from Liquidambar formosana Hance leaves had inhibition to seven kinds of tested bacterias and significant differences among different concentrations and different strains.In addition,the inhibition of bacterial was stronger than fungal as well as the antibacterial effect on Gram-negative bacteria was better than Gram-positive bacteria.The MIC of Escherichia coli,Bacillus subtilis,Staphylococcus aureus,Micrococcus tetragenus,Aspergillus flavus,Aspergillus niger,Penicillium oxalicum were 3.1,12.5,12.5,6.25,12.5,25,12.5mg/mL,respectively.The results also showed that the extract from Liquidambar formosana Hance leaves,which had strong antioxidant activities,could be developed as a functional food resource.
Liquidambar formosana Hance;extracts;antimicrobial activity;antioxidant activity
TS201.3
A
1002-0306(2015)12-0087-05
10.13386/j.issn1002-0306.2015.12.010
2014-07-21
刘宏丁(1989-),男,硕士研究生,研究方向:植物资源开发利用。
刘亚敏(1976-),女,硕士,副教授,研究方向:植物资源开发利用。
国家自然科学基金面上项目(31170546)。

