膀胱癌组织中肺癌肿瘤抑制物1基因启动子甲基化状态和蛋白表达及其临床意义*
杨永姣 ,刘莉 ,陈业刚 ,王尚任 ,刘晓强 ,陈少峰 ,孙光
(1.天津医科大学第二医院 泌尿外科,天津 300211;2.天津市泌尿外科研究所,天津 300211)
肺癌肿瘤抑制物1(tumor suppressor in lung cancer1,TSLC1),又称细胞黏附分子 1(cell adhesion molecule1,CADM1),是 2001年由 KURAMOCHI等[1]在人类非小细胞肺癌(non-small-cell lung cancer,NSCLC)中发现的一种抑癌基因,定位于染色体11q23.2,翻译生成442个氨基酸残基的跨膜糖蛋白。大量研究显示,TSLC1在一系列人类肿瘤组织和细胞系中呈低表达或缺失,包括食管癌[2]、黑色素瘤[3]、肝癌[4]、卵巢癌[5]、乳腺癌[6]、肺癌[7]、喉鳞癌[8]、结肠癌等[9],其低表达与启动子区CpG岛甲基化相关[6,10]。本课题前期研究发现,膀胱尿路上皮癌组织中TSLC1蛋白表达降低,与病理分级呈负相关[11]。本研究采用甲基化特异性PCR(MSP)检测84例膀胱尿路上皮癌组织和20例正常膀胱黏膜组织中TSLC1基因启动子CpG岛甲基化状态,WB检测TSLC1蛋白的表达,以探讨TSLC1基因启动子区CpG岛甲基化状态和蛋白表达的关系及其意义。
1 资料与方法
1.1 一般资料
选取2013年3月-2014年4月在天津医科大学第二医院泌尿外科行手术治疗的84例膀胱尿路上皮癌患者的癌组织,病理结果均为尿路上皮癌;同时收集同期住院的20例良性前列腺增生患者的正常膀胱黏膜组织,病理结果均为正常膀胱黏膜。84例膀胱尿路上皮癌患者中,男性58例,女性26例;年龄48~82岁,中位数年龄66岁,其中年龄≤65岁33例,>65岁51例;单发肿瘤34例,多发肿瘤50例;肿瘤直径≤3 cm 49例,>3 cm 35例;复发性肿瘤49例,原发性肿瘤35例;病理分级低级别57例,高级别27例;肿瘤分期Ta、Tis及T150例,T2~T434例。所有标本均于术后0.5 h内获得,液氮速冻后置入-80℃冰箱保存备用。
1.2 主要试剂
DNA提取试剂盒、DNA修饰试剂盒购自Omega公司,甲基化转移酶购自Solarbio公司,引物由上海捷瑞生物工程有限公司合成,组织蛋白提取试剂盒购自博士德生物,鼠抗人TSLC1单克隆抗体购自Abnova公司,二抗羊抗鼠单克隆抗体、GAPDH内参抗体及BCA蛋白浓度测定试剂盒购自康为世纪。
1.3 实验方法
1.3.1 TSLC1基因启动子CpG岛甲基化检测 采用E.Z.N.A.TMTissue DNA Kit试剂盒提取基因组DNA,每个样本取30 mg左右的组织至加有200μl Buffer TL的离心管中,剪碎后匀浆处理,加入25μl OB蛋白酶,混匀,55℃水浴至组织完全消化,室温10 000×g离心5 min去除杂质,将上清液转移至另一离心管,加入220μl Buffer BL涡旋混匀,70℃水浴10 min,加入220μl的无水乙醇,高速涡旋15 s混匀,转移混合液至套有收集管的HiBind DNA柱子中,室温下8 000×g离心1 min,弃去滤液,把柱子装在新收集管中,加入 500μl HB Buffer,室温8 000×g离心1 min,弃去滤液,把柱子装在新收集管,加入 700μl DNA Wash Buffer,室温 8 000×g离心1 min,弃去滤液,把柱子重新装回收集管,12 000×g离心空柱2 min以甩干柱子基质,把柱子装在干净的1.5 ml离心管上,加入200μl 70℃预热的Elution Buffer到柱子基质上,室温下静置3 min后室温10 000×g离心1 min以洗脱DNA,保留含DNA的洗脱液。在UV3000紫外分光光度仪上测定吸光度值鉴定DNA纯度,OD260/OD280比值在1.8~2.0。甲基化特异性PCR(MSP):用修饰试剂盒EZ DNA Methylation-Gold KitTM取1μgDNA进行修饰,在PCR管中添加130μl CT Conversion Reagent到每20μl DNA样品中(如果DNA样品的体积<20μl,则用水来弥补差量),98℃放置10 min,64℃放置2.5 h,添加 600μl M-Binding Buffer到 Zymo-Spin ICTM Column中,并将柱放入Collection Tube中,装填样品到含有M-Binding Buffer的Zymo-Spin ICTM Column 中,混匀,全速(≥10 000×g)离心 30 s,弃去滤液,添加200μl M-Wash Buffer到柱中,全速离心30 s,添加200μl M-Desulphonation Buffer到柱中并且室温下放置20 min,全速离心30 s,添加200μl M-Wash Buffer到柱中,全速离心30 s,添加10μl的M-Elution Buffer到柱基质中,将柱放置在1.5 ml的管中,全速离心来洗脱DNA。取修饰好的DNA 4μl进行MSP反应。TSLC1基因甲基化引物M,正向引物:5'-TTTTAATTATTATTTTCGAGTTTATC G-3',反向引物:5'-TCTTTAAAAACGAAAACTATAC G-3';非甲基化引物U,正向引物:5'-TTTTTTAATTA TTTTTGAGTTTATTG-3',反向引物:5'-AAATCTTTA AAAACAAAAACTATAC-3'。反应体系参照PCR试剂盒推荐量50μl:PCR混合液25μl,上下游引物各2μl,模板 4μl,无核酶水 17μl。MSP 循环条件:95℃预变性 10 min,94℃变性 30 s,57℃(甲基化引物)或55℃(非甲基化引物)退火30 s,72℃延伸60 s,共35个循环,72℃继续延伸5 min。为保证检测结果的可靠性,以经甲基转移酶(M SssI)和未经M SssI处理的正常人外周血淋巴细胞DNA分别作阳性和阴性对照组。取PCR产物10μl行2%琼脂糖凝胶电泳,110 V电泳40 min,凝胶成像系统下照相。结果判定标准:只要应用甲基化引物扩增出特异性条带即可认为存在甲基化(M),只有应用非甲基化引物扩增出特异性条带方可认为不存在甲基化(U)。
1.3.2 Western blot检测膀胱癌组织和膀胱正常黏膜组织中TSLC1蛋白的表达水平 按照组织净重(mg)∶裂解液(μl)=1∶10的比例,加入相应体积的裂解液进行匀浆,冰上孵育2 h,直至充分裂解、离心后取少量上清液,根据BCA蛋白浓度测定试剂盒说明书绘制标准曲线并检测样本蛋白浓度,制备SDS-PAGE凝胶,计算取出20μg蛋白经沸水煮5min后上样,设置电压为80 V,电泳1.5 h;把电泳分离的样品从凝胶转移到固相载体PVDF膜上,5%脱脂奶粉封闭1 h,一抗鼠抗人TSLC1单克隆抗体(1∶1 000)4℃孵育过夜、二抗羊抗鼠单克隆抗体(1∶5 000)孵育2 h,以鼠抗人GAPDH作为内参。ECL化学发光试剂加在PCDF膜上反应5 min,凝胶成像分析系统下显影、定影。利用Image-Pro Plus 5.0软件对蛋白表达的灰度值进行分析,蛋白相对表达为目的基因与内参基因的比值。
1.4 统计学方法
采用SPSS 16.0统计软件进行数据分析,膀胱癌患者组及其对照组中TSLC1基因启动子区CpG岛甲基化状态的比较用Fisher’s确切概率法,膀胱癌患者中TSLC1基因启动子甲基化与临床病理特征的关系用四格表χ2检验,膀胱癌组和正常组TSLC1蛋白表达的比较用两独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 TSLC1基因启动子区CpG岛甲基化状态及其与临床病理特征的关系

图1 膀胱癌组织中TSLC1基因启动子甲基化状态

附表 TSLC1基因启动子甲基化与膀胱癌临床病理特征的关系 例(%)

续附表
MSP结果显示,20例正常膀胱黏膜组织中未检测到TSLC1基因启动子甲基化;84例膀胱尿路上皮癌组织中43例检测到TSLC1启动子区CpG岛甲基化(见图 1),甲基化率为 51.2%(43/84),表明膀胱尿路上皮癌组织中TSLC1基因启动子甲基化率明显高于正常膀胱黏膜组织,TSLC1基因启动子甲基化与膀胱癌的发生有关。膀胱尿路上皮癌组织中TSLC1基因启动子甲基化与患者的性别、年龄、肿瘤数目无关(P>0.05),而与肿瘤是否复发、肿瘤直径病理分级和临床分期有关,差异有统计学意义(P<0.05)。见附表。
2.2 TSLC1蛋白表达及TSLC1基因启动子甲基化与蛋白表达的关系
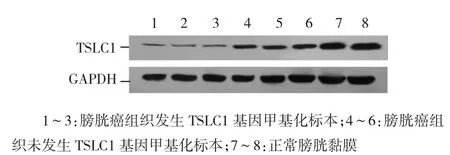
图2 膀胱癌组织中TSLC1蛋白的表达
Western blot检测结果表明,84例膀胱尿路上皮癌组织中TSLC1蛋白的表达水平为(0.2613±0.1405),明显低于20例膀胱正常黏膜组织[(0.695 7±0.092 4)(t=7.457,P<0.01)](见图2)。43例发生TSLC1基因启动子甲基化的膀胱癌组织TSLC1蛋白表达水平为(0.114 3±0.044 3),明显低于41例未发生TSLC1基因启动子甲基化[(0.3756±0.0439)](t=11.763,P<0.01)。
3 讨论
膀胱癌是泌尿系统中最常见的恶性肿瘤,其发生、发展是一个多因素相互作用的复杂过程,既有内在遗传因素,又有外在环境因素。虽然近年来膀胱癌的诊治取得一些进展,但仍未能十分有效地阻止疾病的进展和改善患者的预后,因此有必要对其发生、发展的相关因素进行深入研究。DNA甲基化是一种表观遗传修饰,该修饰影响着DNA和其他分子的相互作用,并且通过细胞分裂和增殖遗传,在胚胎的早期发育、干细胞的分化和特定的基因表达中起重要作用[12]。近年来,DNA甲基化研究成为肿瘤学研究的一个热点。
TSLC1是一种在NSCLC中发现的肿瘤抑制基因,TSLC1可通过抑制增殖和促进凋亡来抑制肿瘤的生长,并可介导同种或异种细胞间的相互黏附,在抑制上皮组织来源的恶性肿瘤中起重要作用[13],TSLC1功能丧失可导致癌细胞浸润及转移[14],一系列人类肿瘤组织和细胞系中TSLC1呈低表达或缺失,且其低表达与启动子区CpG岛甲基化相关[2-9,15-16]。TSLC1基因启动子甲基化可以作为一种肿瘤诊断、检测和预后判断的分子标记物。同时有研究发现,去甲基化药物天花粉蛋白处理宫颈癌HeLa细胞后可逆转TSLC1基因甲基化状态,从而诱导其重新表达发挥抑制肿瘤细胞增殖的作用[17]。本实验应用MSP同时检测20例膀胱正常黏膜组织和84例膀胱尿路上皮癌组织中TSLC1基因启动子甲基化状态,发现51.2%(43/84)的膀胱尿路上皮癌组织中存在TSLC1基因甲基化,而在20例正常膀胱黏膜组织中未检测到TSLC1基因甲基化,提示TSLC1基因启动子甲基化有肿瘤特异性,有望作为膀胱尿路上皮癌的诊断标记物。
本实验将TSLC1基因启动子甲基化状态与患者的临床资料进行分析后发现,原发性肿瘤中TSLC1基因甲基化率为37.1%,复发性肿瘤中甲基化率为67.3%;直径≤3 cm的肿瘤中甲基化率为42.9%,直径>3 cm的肿瘤中甲基化率为68.6%;低级别肿瘤中甲基化率为43.9%,高级别肿瘤中甲基化率为74.1%;非肌层浸润性膀胱癌中甲基化率为44.0%,肌层浸润性膀胱癌中甲基化率为76.5%,差异有统计学意义(P<0.05)。该结果提示TSLC1基因启动子甲基化与膀胱尿路上皮癌的大小、是否复发、分化程度和浸润深度等肿瘤的生物学行为有关。
本研究发现在84例膀胱尿路上皮癌组织和20例膀胱正常黏膜组织中,膀胱癌组织中TSLC1蛋白的表达水平明显低于正常组织;43例发生TSLC1基因启动子甲基化的膀胱癌组织TSLC1蛋白表达水平明显低于41例未发生TSLC1基因启动子甲基化的膀胱癌组织,差异有统计学意义(P<0.05),研究结果与前期研究发现膀胱尿路上皮癌组织中TSLC1蛋白表达降低相符[11]。结果提示TSLC1基因启动子CpG岛甲基化可能是导致其蛋白表达下调的主要原因之一。
本研究结果表明,在膀胱尿路上皮癌组织中,TSLC1基因具有较高的甲基化率,并且与膀胱癌的发生、发展密切相关。因此有必要进一步研究TSLC1在膀胱癌中的功能及其可能机制,为膀胱癌早期诊断、判断预后及基因治疗提供新的理想靶点奠定研究基础。
[1]KURAMOCHI M,FUKUHARA H,NOBUKUNI T,et al.TSLC1 is a tumor suppressor gene in human non-small-cell lung cancer[J].Nat Genet,2001,27(4):427-430.
[2]LIANG QL,CHEN GQ,LIU QL,et al.Tumor suppressor TSLC1 inhibits growth,proliferation,invasivenessand angiogenesisin nude mice xenografted tumor of Eca109 cells[J].Int J Clin Exp Med,2014,7(6):1507-1515.
[3]YOU Y,ZHANG J,LIY,etal.CADM1/TSLC1inhibits melanoma cell line A375 invasion through the suppression of matrix metalloproteinases[J].Mol Med Rep,2014,10(5):2621-2626.
[4]HE G,LEI W,WANG S,et al.Overexpression of tumor suppressor TSLC1 by a survivin-regulated oncolytic adenovirus significantly inhibits hepatocellular carcinoma growth[J].J Cancer Res Clin Oncol,2012,138(4):657-670.
[5]YANG G,HE W,CAI M,et al.Loss/Down-regulation of tumor suppressor in lung cancer 1 expression is associated with tumor progression and is a biomarker of poor prognosis in ovarian carcinoma[J].Int J Gynecol Cancer,2011,21(3):486-493.
[6]TAKAHASHI Y,IWAI M,KAWAI T,et al.Aberrant expression of tumor suppressors CADM1 and 4.1B in invasive lesions of primary breast cancer[J].Breast Cancer,2012,19(3):242-252.
[7]LEI W,LIU HB,WANG SB,et al.Tumor suppressor in lung cancer-1(TSLC1)mediated by dual-regulated oncolytic adenovirus exerts specific antitumor actions in a mouse model[J].Acta Pharmacol Sin,2013,34(4):531-540.
[8]LU B,DI W,WANG H,et al.Tumor suppressor TSLC1 is implicated in cell proliferation,invasion and apoptosis in laryngeal squamous cell carcinoma by regulating Akt signaling pathway[J].Tumour Biol,2012,33(6):2007-2017.
[9]ZHANG J,NING J,GENG J,et al.Down-regulation of tumor suppressor in lung cancer 1(TSLC1)expression correlates with poor prognosis in patients with colon cancer[J].J Mol Histol,2012,43(6):715-721.
[10]CHEN K,WANG G,PENG L,et al.CADM1/TSLC1 inactivation by promoter hypermethylation is a frequent event in colorectal carcinogenesis and correlates with late stages of the disease[J].Int J Cancer,2011,128(2):266-273.
[11]武立伟,刘晓强,张霖,等.肺癌肿瘤抑制因子1在膀胱尿路上皮癌中的表达[J].现代泌尿生殖肿瘤杂志,2009,1(5):298-301.
[12]YIM RL,KWONG YL,WONG KY,et al.DNA methylation of tumor suppressiv-e miRNAs in non-hod-gkin's lymphomas[J].Front Genet,2012,3(233):1-8.
[13]GOMYO H,ARAI Y,TANIGAMI A,et al.A 2-Mb sequence-ready contig map and a novel immunoglobulin superfamily gene IGSF4 in the LOH region of chromosome 11q23.2[J].Genomics,1999,62(2):139-146.
[14]MAO X,SEIDLITZ E,TRUANT R,et al.Re-expression of TSLC1 in a non-small-cell lung cancer cell line induces apoptosis and inhibits tumor growth[J].Oncogene,2004,23(33):5632-5642.
[15]FUKUHARA H,KURAMOCHI M,FUKAMI T,et al.Promoter methylation of TSLC1 and tumor suppression by its gene product in human prostate cancer[J].Jpn J Cancer Res,2002,93(6):605-609.
[16]OCHIAI H,TAKENOBU H,NAKAGAWA A,et al.Bmi1 is a MYCN target gene that regulates tumorigenesis through repression of KIF1Bbeta and TSLC1 in neuroblastoma[J].Oncogene,2010,29(18):2681-2690.
[17]王艳华,黄利鸣.TSLC1基因甲基化与宫颈癌HeLa细胞凋亡相关性的研究[J].中国现代医学杂志,2007,17(21):2575-2578.

