保健食品企业标准制定与执行是保障质量的根本(下)
◆文 李晨光 武贵勉
北京市昌平区食品药品监督管理局
(接7 月上)
通过调查,昌平区现有的56 种自主保健食品中有胶囊产品27 种,茶剂9 种。胶囊产品企业标准中重金属检测方法均引用了国家标准,砷按GB/T5009.11 的规定测定,铅按GB/T5009.12 的规定测定,汞按GB/T5009.17 的规定测定,限量值也与GB16740-1997 完全一致。但9 种茶剂的企业标准中重金属的规定差别很大,只有3 种茶剂的测定方法和限值完全引用了国家标准,另外6 种茶剂与国家标准相比都有差异,见附表2。农药残留方面,对于中药材为原料的保健食品需测六六六、DDT;以茶叶为原料的保健食品要求测有机氯农药残留。企业标准均引用了《食品中有机氯农药多组分残留量的测定》(GB/T5009.19)中的测定方法,在六六六、DDT 限量上,企业标准规定的略有差异,大部规定为0.2mg/kg,有的规定为0.1mg/kg、0.06 mg/kg 、0.05mg/kg、0.01mg/kg 等。
在保健食品出厂检测项目方面,除型式检验每年进行一次,需要检测企业标准规定的全部项目外,各企业生产的保健食品必须逐批进行出厂检测,检测合格后方可出厂,但不一定要检测全部项目,具体检测项目一般由各生产企业结合实际自行制定。通过调查发现,各生产企业除感官指标、净含量(允许短缺量)项目按规定进行出厂检测外,标志性成分、理化指标和微生物指标的出厂检测项目差异较大。有的生产企业把标准检测项目笼统地写成理化指标和微生物指标,但出于对品质的保证,各生产企业应检测相应指标中的所有项目,即理化包括铅、砷等重金属在内的企标规定的所有理化指标,微生物包括致病菌(指沙门氏菌、志贺氏菌、金黄色葡萄球菌和溶血性链球菌)、菌落总数、霉菌和酵母菌、大肠菌群在内的所有微生物项目,见附图5、6。

▲附图5 出厂检测项目中理化指标的规定情况
保健食品企业标准制定中存在的典型问题
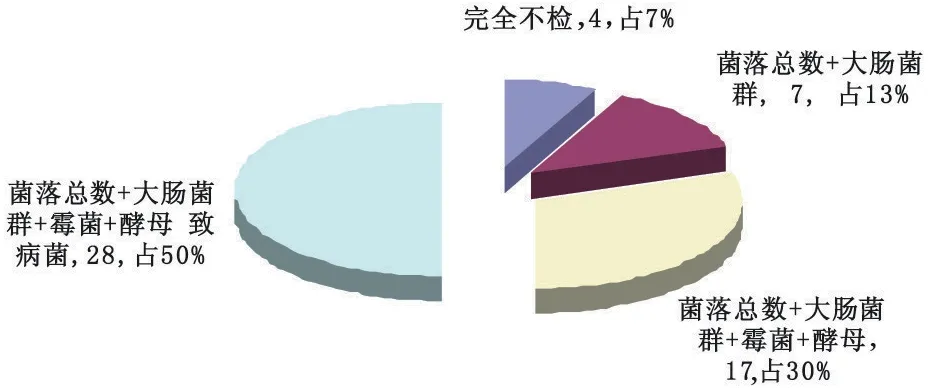
▲附图6 出厂检测项目中微生物指标的规定情况
企业标准技术复杂,法规性强,必须依据生产场所、生产设备、出厂检验设备等特点及有关规定制定标准,以确保产品能按照企业标准组织生产和检验,确保产品质量的稳定性。通过对昌平区56 种自主保健食品生产企业标准进行分析发现,企业标准在制定过程存在诸多问题,影响了其标准的执行。
个别原料标准制定脱离实际
在昌平区现有的56 种自主保健食品中,有4 种保健食品使用了绞股蓝原料,其企业标准中均规定绞股蓝原料应符合《中华人民共和国药典》的规定。但实际上《中华人民共和国药典》中并没有对绞股蓝原料进行规定,该问题应引起保健食品生产企业和监管部门的重视。
出厂检测项目标准高低不一
产品的出厂检测是质量控制的关键环节,但从对出厂检测项目的调查结果看,生产企业制定的出厂检测项目标准差异太大。有的标准制定过高,例如:规定出厂检测项目包括致病菌、总黄酮、人参皂苷和重金属等。而有的出厂检验项目标准制定过低,个别生产企业产品出厂检验甚至对基本的卫生学检测项目都未作要求。
某些标准表达不明确
个别企业标准表达不明确,致使产品在实际生产过程中根本无法操作。如原料要求,只规定原料应符合国家相关规定及标准的要求,并没有具体指明哪种原料应符合哪个国家规定或标准的要求。
对留样量和批次的确定标准不一
《保健食品良好生产规范》规定:每批产品均应有留样,留样应存放于专设的留样库(或区)内,按品种、批号分类存放,并有明显标志。但具体留样量国家标准没有规定,一般由生产企业根据产品的实际检测用量来确定。通过查阅56 份企业标准发现,只有21 份企业标准对留样量有规定,一般为3 ~7 盒/瓶/袋。可见,与药品生产企业相比,保健食品生产企业对留样的重视程度远远不够。此外,生产批次具有重要意义,批号可以追溯和审查该批产品的生产历史。监管部门可以依据该批产品的抽检情况及生产、使用中出现的情况进行产品质量监督,一旦抽检不合格,整批产品都必须召回、销毁。《保健食品良好生产规范》要求生产批次的划分应当能确保同一批次产品质量和特性的均一性,应当建立编制生产批号和确定生产日期的规程。通过查阅56 份企业标准发现企业制定的组批规则不尽相同,见附表3。
不同生产企业生产的同类保健食品,其企业制定的标准存在差异。例如,有的生产企业制定的标准中对功效成分含量的规定与其保健食品批准证书不一致,其企业标准与批准证书附件1、附件2 中对功效成分含量规定不一致。事例见附表4、5、6。
保健食品生产企业标准执行中存在的问题
保健食品生产企业制定的企业标准只有通过全面的贯彻实施,才能真正发挥控制产品质量的作用。因此,企业标准的执行显得非常重要。企业应该按照企业标准中有关原料、成品、包材等要求组织生产,执行过程中不能打折扣或与企业标准相偏离。
未严格执行原辅料入库检验标准
关于原辅料入库检验,企业标准中一般这样规定:入库前应由质量监督检验部门按原辅料要求进行检验,合格后方可入库使用。原辅料要求在企业标准中有专门的章节进行规定,企业采购的所有辅料都应保证符合企业标准的规定。但实际上,并非所有企业都能做到这一点。
生产企业在采购原料时尤其注重对供货方的审核,基本都会保留供货方资质,向供货方索取原料检测报告。在原料入厂检测方面,鉴于企业检测能力不同,入厂检测项目差别很大,除个别企业比较重视外,大部分企业均不能严格按照企业标准规定的原辅料要求进行全项检验,见附表7、8。
出厂检测项目执行力不足
各生产企业对其产品出厂检测项目标准不一,标准过高而生产企业实际检测能力较低的问题比较突出,生产企业无法对出厂全部项目进行检测,而委托检验费用又较高,为逃避检测费用,有的生产企业未按标准完成成品检验即出厂,造成隐患产品流入市场。此类问题在委托加工的产品中尤为严重,委托加工企业本身限于没有检测设备无法进行出厂检测,在寻找受托加工企业过程中也不将实验室检测能力作为考察重点,考虑更多的是加工费用等因素。受托加工企业则未依据委托加工协议约定的检测项目进行检测,导致出厂检测项目不能被完全执行。

附表2 以茶类为原料的保健食品企业标准中在关重金属限量的规定

附表3 企业标准中不同的组批规则
附表4 两个不同厂家的冻干蜂王浆胶囊企业标准对比
生产企业对企业标准的制定和执行应给与足够重视
企业自身对企业标准的重视力度不够是引发上述问题的主要原因之一。保健食品企业的企业标准中涉及的技术标准和法律法规较多,但企业本身并不具备足够的技术力量和经济力量,一些企业标准的编制人员专业知识不够,更导致企业标准存在漏洞;由于保健食品技术转让或委托加工等原因,导致生产厂家的变更,使企业标准很难与实际生产场所的设备、检测能力相适应,加大了企业标准的执行难度;企业标准的制定与执行脱节。执行者对企业标准理解不透彻,没有意识到企业标准的重要性。使用中药材的原辅料及常规的水分、灰分装量等的测定方法,企业标准中一般规定参照《中国药典》,但检查中发现配备有《中国药典》的企业并不多。
目前,昌平区除少数企业配备了高效液相色谱仪、原子吸收分光光度计等检测有效成分、重金属含量、致病菌的设备外,大部分企业实验室设备还局限于崩解、水分测定、菌落总数、大肠菌群、酵母计数、霉菌检测设备。实验室建设能力不足也阻碍了企业标准的执行,制约了企业自身的发展。
监督部门应发挥自身优势帮助生产企业保障产品质量
明确企业标准备案的法律地位
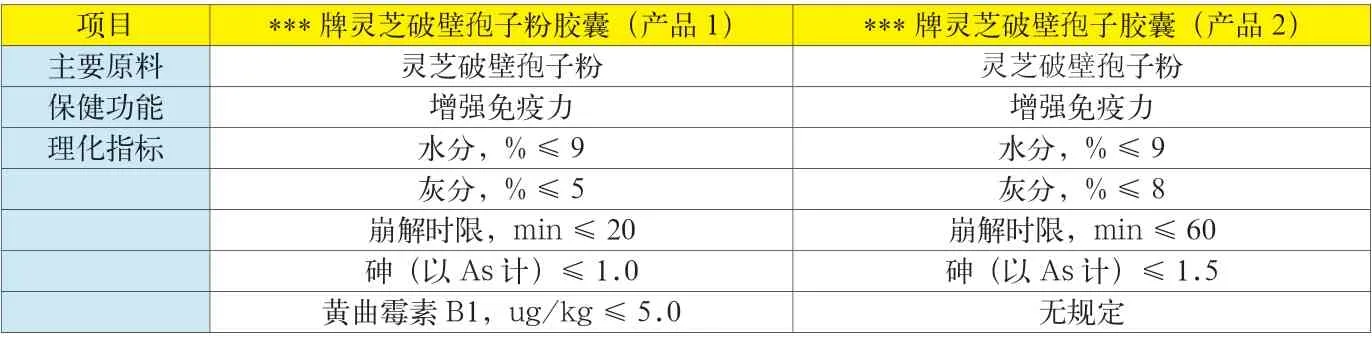
附表5 两个不同厂家的灵芝破壁孢子胶囊企业标准对比

附表6 企业标准与保健食品批准证书中对功效成分含量的规定

附表7 16 家在产保健食品生产企业的主要原料入厂检验情况

附表8 13 家以中药材及植物提取物为原料的保健食品生产企业的原料入厂检验情况
毫无疑问,保健食品注册批件的附件2(主要质量标准)是具有法律效力的证明文件,可作为执法的依据。但由于历史原因,现阶段的部分保健食品批件并没有附件2,在这种情况下,只能依据备案的企业标准来检查,那么备案的企业标准是否能作为判定产品质量的法定依据呢?换句话说,除监督抽检可依据备案的企业标准直接判定产品是否合格外,日常监督检查中发现未按企业标准要求进行出厂检测,或不按企业标准要求进行留样、组批的企业,是否也可依据企业标准对其进行处罚呢?
通过培训提高生产企业对企业标准的重视程度
企业在标准制定与执行中出现的问题,一方面反映了企业对保健食品管理的不熟悉,理解不透彻;另一方面也反映出一些保健食品企业对标准的不重视。长此以往则既不利于保健食品的发展,也不利于保健食品的管理。通过培训可使企业意识到了企业标准的重要性,增强了对企业标准的执行力,对提高企业质量管理水平起到促进作用。
承认企业采用委托检验可作为落实法律规定实施出厂检验的一种方式
监管部门应要求生产企业加强自检实验室建设和运行,重点加强原料购进验收、半成品生产过程及成品出厂检验等关键环节的实验室检验工作,确保产品符合法规及标准要求,提高质量安全水平。现阶段,要求每一生产企业的自检实验室都能执行企业标准的检测项目非常困难。因此,监管部门在鼓励建立自检实验室的前提下, 可以允许并承认企业采用委托检验来落实法律规定实施出厂检验标准。同时,监管部门定期开展现场监督检查,采取查看检验原始记录和检验报告、检查仪器设备的配备及运转情况以及现场提问、操作等方法对企业的检验检测能力进行全面考核。
企业标准将作为监管的重要依据
作为监管部门,在敦促企业严格落实原料供应商审核制度、索证索票和采购查验制度的同时,还应要求企业加强原料进厂检验工作。因为在原料入厂环节多增加一道质量控制的关卡,控制住了原料,也就控制了保健食品质量安全的源头。在原料管理缺乏统一的标准给监管带来困难的现实背景下,昌平区食药监管局重点将企业标准中有关原料执行的标准作为监督检查的依据,以此为突破口,要求企业严格按照企业标准中的原辅料质量要求进行入厂检验,没有检验能力的,可委托第三方检验,但必须有原料入厂检测报告,方能投入使用。尤其是对没有国家标准,只有企业自行制定内控标准的,要求企业采购时必须按照企业的内控标准进行原料入厂检验。
我国保健食品原料标准体系不健全的问题应当引起足够的重视。许多原料既无国家或地方的统一标准,也无行业的统一标准,企业实际上处于自定标准的状态,如氨基酸、红景天提取物、拟黑多蚁、蜂胶、蜂王浆冻干粉、葡萄籽提取物等原料。这种状况既不利于消费者法律权益的保护,也不利于保健食品产业的标准化、规范化。

