马克斯克鲁维酵母对发酵乳中糖代谢的影响
范 维,张咚咚,张 彧,姜铁民,陈历俊,*
(1.大连工业大学食品学院,辽宁 大连 116034;2.北京市乳品工程技术研究中心,北京三元食品股份有限公司,北京 100076)
马克斯克鲁维酵母对发酵乳中糖代谢的影响
范 维1,2,张咚咚2,张 彧1,姜铁民2,陈历俊1,2,*
(1.大连工业大学食品学院,辽宁 大连 116034;2.北京市乳品工程技术研究中心,北京三元食品股份有限公司,北京 100076)
采用高效液相色谱等方法,对乳酸菌单独发酵和向其中添加马克斯克鲁维酵母这两种发酵乳中乳糖代谢主要产物及关键酶活力的变化情况进行对比分析,以确定添加酵母菌对乳糖无氧代谢产生乳酸途径的影响。结果表明:添加酵母菌后乳糖降解速率明显加快(P<0.05),贮藏期间马克斯克鲁维酵母可以对积累的半乳糖进行利用;发酵过程中,由于酵母菌的添加使β-半乳糖苷酶及乳酸脱氢酶活力有显著提高(P<0.05),糖酵解途径关键限速酶--己糖激酶和丙酮酸激酶活力增加(P<0.05);含有酵母菌的发酵乳pH值下降(滴定酸度上升)较乳酸菌单菌发酵快(P<0.05),这与添加酵母菌后发酵乳中乳酸含量显著增加(P<0.05)有关;丙酮酸含量变化不显著(P>0.05)。该研究揭示了马克斯克鲁维酵母的添加对乳糖酵解具有一定促进作用。
乳糖代谢;马克斯克鲁维酵母;发酵乳;酶活力;代谢产物
一直以来,国内的乳制品主要以乳酸菌(保加利亚乳杆菌和嗜热链球菌)发酵为主,关于酵母菌在乳制品中应用的研究很有限,尤其是酵母菌作为一种益生菌发酵剂[1]方面的研究还不够深入。但东欧、非州、亚洲等很多传统发酵乳制品(如开菲尔乳、非洲自然发酵乳、马奶酒等)中,酵母和乳酸菌起着同样重要的作用[2]。马克斯克鲁维酵母(Kluyveromyces marxianus)作为一种广泛存在于传统发酵乳中的酵母,不仅可以发酵乳糖[3],更能对半乳糖进行利用[4],它的介入使得混合菌形成了一个复杂的微生态环境,赋予了产品独特的风味及营养特性[5-6]。乳糖作为乳粉中唯一的碳源,在微生物发酵过程中起到至关重要的作用,故本实验从糖代谢角度出发,通过研究添加马克斯克鲁维酵母后乳糖分解代谢过程中主要代谢产物(乳糖、葡萄糖、半乳糖、丙酮酸、乳酸)含量变化以及代谢关键酶(β-半乳糖苷酶、己糖激酶、丙酮酸激酶、乳糖脱氢酶)活力的变化情况,来反映马克斯克鲁维酵母和乳酸菌混菌发酵的具体过程,以期为新型乳制品的研究与开发提供理论依据。
1 材料与方法
1.1材料与试剂
1.1.1菌种
保加利亚乳杆菌菌粉(Lactobacillus bulgaricus,简称LB)、嗜热链球菌菌粉(Streptococcus thermophilus,简称ST)YOMIX-611 丹尼斯克公司;马克斯克鲁维酵母(Kluyveromyces marxianus) 北京三元食品股份有限公司实验室保藏。
1.1.2试剂
全脂乳粉 新西兰西部乳粉厂;乳糖、葡萄糖、半乳糖标准品、邻硝基苯酚(o-nitrophenol,ONP)、邻硝基苯β-D-半乳糖吡喃糖苷(o-nitrophenyl-β-D-galactoside,ONPG)、烟酰胺腺嘌呤二核苷酸(reduced form of nicotinamide-adenine dinucleotid,NADH)、丙酮酸钠、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA) 美国Sigma公司;乳酸、丙酮酸标准品 阿拉丁(中国)试剂公司;AG501-X8(D)混合床树脂美国Bio-Rad公司;溶菌酶(2 000 U/mg)、己糖激酶(hexokinase,HK)试剂盒、丙酮酸激酶(pyruvate,PK)试剂盒 北京索莱宝科技有限公司。
1.2仪器与设备
XT-120A型分析天平 瑞士普利赛斯公司;Sigma 3K-15型高速冷冻离心机 德国Sigma公司;LC-10Avp型高效液相色谱 日本岛津公司;Milli-Q Advantage A10型超纯水仪 美国Millipore公司;KQ-500DE型医用数控超声器 昆山市超声仪器有限公司;PB-10型标准型电化学pH计 德国赛多利斯集团;Cintra20型双光束紫外-可见分光光度计 澳大利亚GBC公司;Polystat K6-1型循环式精密恒温水浴锅 德国Huber公司。
1.3方法
1.3.1样品采集
准备两份12 g/100 mL的全脂乳培养基,分别命名A、B。A培养基中按106CFU/mL接菌量接种活化好的乳酸菌(LB与ST活菌数比1∶1),按乳酸菌与酵母菌活菌数为30∶1的比例接种马克斯克鲁维酵母;B培养基按以上接种量只接入LB和ST。将接种好的两份培养基于35 ℃条件下进行恒温发酵,分别于发酵3、4、4.5、5、5.5、6 h取一次样,6 h时约为凝乳终点。后将两份培养基转至4 ℃条件下进行贮藏,分别于第1、3、5、7、10、14、21天进行取样。
将马克斯克鲁维酵母按上述接种比例单独接入12 g/100 mL全脂乳培养基中,在28 ℃、180 r/min条件下进行培养,分别于6、24 h和48 h进行取样,测定其β-半乳糖苷酶和乳酸脱氢酶活力。
1.3.2pH值及总酸度的测定
pH值采用PB-10型酸度计进行测定。
总酸度测定:根据国家标准GB 5413.34—2010《乳和乳制品酸度的测定》[7],用0.1 mol/L的NaOH溶液进行电位滴定法测定总酸度值。
1.3.3糖类代谢产物测定
1.3.3.1高效液相色谱(high-performance liquid chromatography,HPLC)条件
色谱柱:Aminex HPX-87C分离柱(300 mm× 7.8 mm,9 μm);保护柱:Aminex hydrogen-form(30 mm×4.6 mm);流动相:超纯水;流速:0.3 mL/min;柱温:75 ℃;进样量:10 μL。
1.3.3.2标准曲线的绘制
配制5 组混标溶液,使乳糖质量浓度分别为2、4、6、8、10 mg/mL;葡萄糖质量浓度分别为1、2、3、4、5 mg/mL;半乳糖质量浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL。配好后进行色谱测定,以峰面积(Y)对其质量浓度(X,mg/mL)绘制工作曲线,获得回归方程、相关系数、检出限见表1。
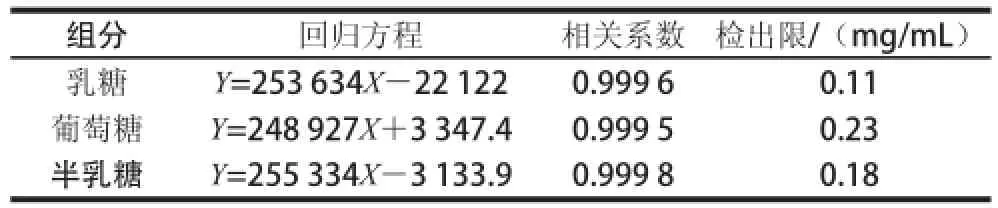
表1 HPLC法检测发酵乳中各种糖的回归方程和相关系数及检出限Table 1 Regression equations, correlation coefficients and limits of detection for lactose, glucose and galactose
1.3.3.3样品前处理[8-9]
准确称取3.000 g样品,加入15 g双蒸水溶解。加入亚铁氰化钾溶液和乙酸锌溶液各1 mL。充分混匀,超声20 min。在4 ℃条件下,10 000 r/min离心10 min。收集的上清液用1 mol/L NaOH调节pH值为6~7,并定容到25 mL。取出5 mL上清液,加入0.25 g的AG501-XB(D)树脂,振荡1 h。再用0.22 μm滤膜进行过滤。
1.3.4关键酶活力测定
1.3.4.1酶液提取
采用溶菌酶破壁法,参照Greenberg等[10]的方法,略作改动。准确称取3.000 g样品于50 mL离心管中,向其中加入1 g/100 mL的EDTA 100 μL,于4 ℃条件下,11 000 r/min离心10 min,保留沉淀;将沉淀用pH值为7.0的0.1 mol/L磷酸钾缓冲液洗2 次,离心弃上清后将沉淀悬浮于10 mL磷酸钾缓冲溶液中;向溶液中加入0.2 g/100 mL的溶菌酶2 mL,于37 ℃水浴1 h后加入4 mol/L NaCl溶液2 mL,充分混匀后得到粗酶液。
1.3.4.2β-半乳糖苷酶活力测定
参照郭清泉等[11]的方法,以ONPG为酶的底物,生成黄色产物ONP,通过比色法测定β-半乳糖苷酶活力。以吸光度(420 nm)作为纵坐标,ONP质量浓度作为横坐绘制标准曲线,获得回归方程Y=0.006 5X-0.019,相关系数为0.997 9。一个酶活力单位(U)定义为在37 ℃条件下,每分钟释放1 μmol ONP所需的酶量[10]。
1.3.4.3乳酸脱氢酶活力测定
参考李琦等[12]的方法略作改动。将混合反应液即0.03 mol/L丙酮酸钠0.1 mL、0.006 mol/L NADH 0.1 mL、0.1 mol/L磷酸钾缓冲液(pH 6.5)2.7 mL在25 ℃条件下预热5 min,于340 nm波长处测定初始吸光度,加入0.1 mL酶液启动反应,立即计时,每间隔1 min测定一次吸光度,连续测定5 min。根据每分钟吸光度降低值(ΔA340nm)可以计算出酶活力。空白样为3 mL磷酸钾缓冲溶液。一个酶活力单位(U)定义为在25 ℃条件下,每分钟氧化1 μmol NADH所需酶量[13]。酶活力按下式计算。
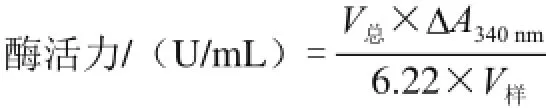
式中:V总为反应体系总体积/mL;V样为样品体积/mL。
1.3.4.4糖酵解(Embden-Meyerhof-Parnas,EMP)途径限速酶活力测定
己糖激酶和丙酮酸激酶活力测定方法遵照试剂盒说明书进行,实验中每个样品测定3 次,取平均值。蛋白质含量采用考马斯亮蓝法进行测定。
1.3.5丙酮酸含量的测定
1.3.5.1标准曲线绘制
采用2,4-二硝基苯肼比色法[14]对发酵乳中丙酮酸含量进行测定。以吸光度(520 nm)为纵坐标,丙酮酸质量浓度(μg/mL)为横坐标绘制标准曲线,获得回归方程Y=0.022 3X-0.032 3,相关系数为0.998 6。
1.3.5.2样品测定
准确称取样品3.000 g,加入10 g/100 mL三氯乙酸2 mL,超声15 min,10 000 r/min离心10 min,获得上清液定容到10 mL,从中取出1 mL按标准曲线测定方法操作,记录吸光度,测定3 次取平均值,计算丙酮酸含量。1.3.6 乳酸含量的测定
1.3.6.1标准曲线绘制
采用对羟基联苯比色法[15]对发酵乳中乳酸含量进行测定。以吸光度(565 nm)作为纵坐标,乳酸质量浓度(μg/mL)作为横坐标,绘制标准曲线,获得回归方程为Y=0.011 5X+0.118 3,相关系数为0.998 3。
1.3.6.2样品测定
准确称取样品1.000 g,用15 mL双蒸水进行稀释,再加入10 g/100 mL三氯乙酸2 mL,超声15 min后10 000 r/min离心10 min,获得上清液定容到100 mL,从中取出1 mL按标准曲线测定方法操作,记录吸光度,测定3 次取平均值,计算乳酸含量。
1.4数据分析
运用SPSS 17.0软件进行数据统计分析。数据之间的比较采用t检验,检验水平α=0.05,以P<0.05为有统计学意义。
2 结果与分析
2.1pH值及总酸度测定结果
按规定的时间点进行取样,分别测定添加酵母菌和不添加酵母菌两种发酵乳的pH值和总酸度随时间的变化。结果如图1所示,两种发酵乳pH值均呈下降趋势,而滴定酸度呈上升趋势,这符合发酵乳应有的特性。从图中还能看出,含有酵母菌的发酵乳酸度较高(P<0.05),存在两种可能的原因,其一是酵母菌促进乳酸菌生长,加速了乳酸菌产酸[6],其二是酵母菌本身发酵乳糖产酸、产CO2所致。
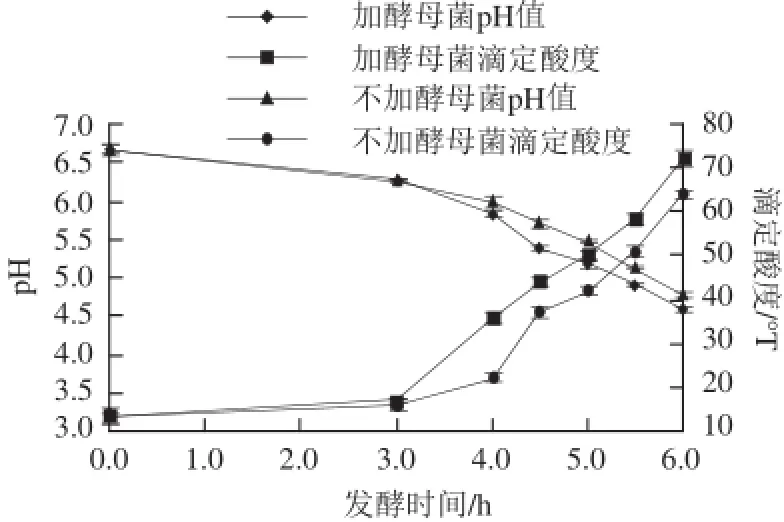
图1 不同发酵时间发酵乳中酸度及pH值变化Fig.1 Changes in acidity and pH in fermented milk at different fermentation times
2.2糖类代谢产物测定结果
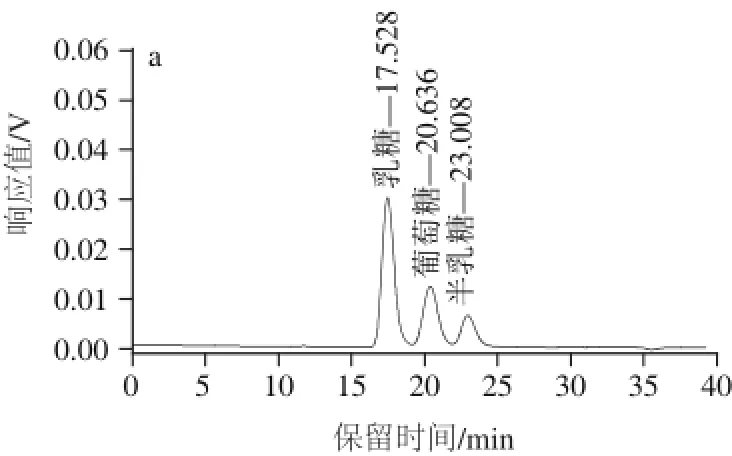
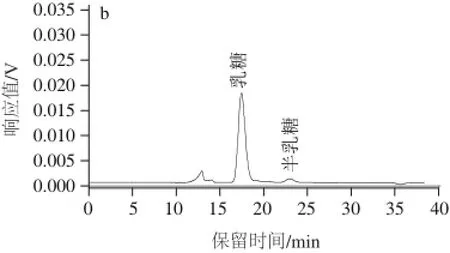
图2 标准品(a)和样品(b)糖类的HPLLCC图Fig.2 HPLC chromatograms of mixed sugar standards (a) and sugars in fermented milk (b)
按1.3.3节方法对糖类代谢产物进行检测,获得混合标准品和样品HPLC图见图2。由图2a可知,乳糖、葡萄糖、半乳糖的出峰时间分别为17.528、20.636、23.008 min。由图2b可以看出样品分离效果较好。
2.2.1发酵期间各糖含量变化
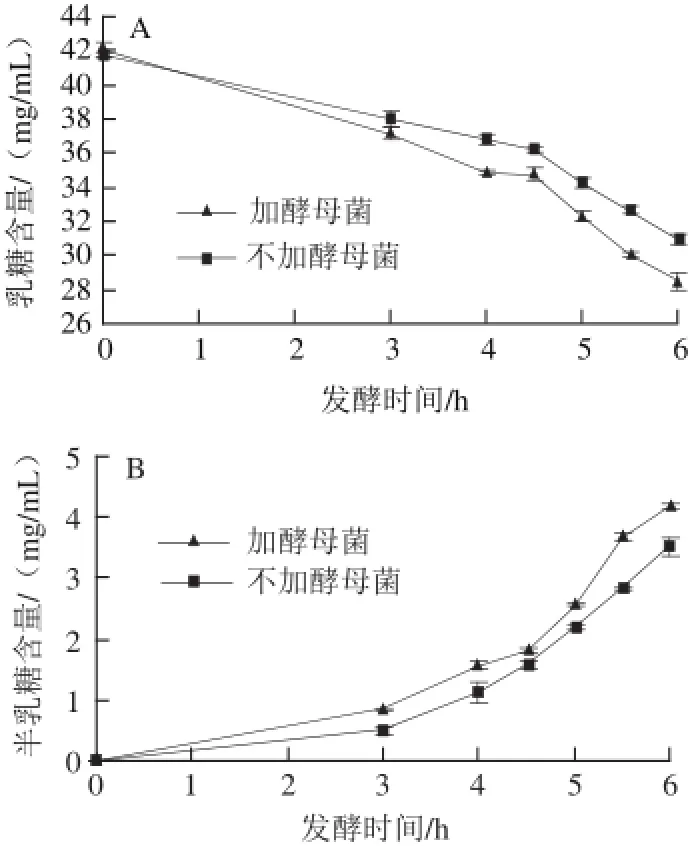
图3 发酵期间乳糖(A)和半乳糖(B)含量变化Fig.3 Changes in lactose (A) and galactose (B) contents during fermentation
按样品前处理方法对各采样点采集的样品进行处理,通过HPLC法对样品中乳糖、葡萄糖、半乳糖含量进行测定,结果如图3所示。如图3A所示,接种后随着发酵时间的延长乳糖含量呈不断下降趋势(P<0.05),含有酵母菌的发酵乳中乳糖从42.081 mg/mL下降到28.549 mg/mL,下降了32.4%,而乳酸菌单独发酵乳糖下降25.8%,说明含有酵母菌的发酵乳中乳糖代谢速率明显快于乳酸菌单独发酵(P<0.05),这是由于酵母菌自身可以利用乳糖所致[16]。
由图3B可知,半乳糖含量在发酵期间呈不断上升趋势(P<0.05)。单独乳酸菌发酵不会对半乳糖进行利用,因为在乳酸菌体内半乳糖激酶含量极低,不足以使半乳糖通过Leloir途径发生代谢,半乳糖最终在乳糖透膜酶的作用下排放到胞外[17]。而混菌发酵中,虽然马克斯克鲁维酵母可以利用半乳糖,但其含量并没有减少,可能是由于葡萄糖的生成量足以满足酵母菌的生长,半乳糖没有被利用或半乳糖的合成代谢大于分解代谢,这与Gonzalez-Andrada等[17]的研究相似。
发酵过程中葡萄糖未被检出是由于葡萄糖在乳糖代谢产生时通过EMP途径瞬间转化而不会排放到胞外,因此含量极低未达到HPLC检出限,这与Samona等[18]的研究结果相似。
2.2.2贮藏期间各糖含量变化
对贮藏期间各糖含量进行测定,结果如图4所示,贮藏过程中乳糖的含量随贮藏天数的增加仍在减少(P<0.05),但趋 势逐渐变缓,21 d内含有酵母菌和不含酵母菌的发酵乳中乳糖分别下降了36.8%和22.2%。如图4B所示,两种发酵乳中半乳糖含量变化趋势有明显不同,由于乳酸菌不能利用半乳糖,因此乳酸菌单独发酵乳中半乳糖含量在逐渐升高;而混菌发酵中半乳糖的含量呈先上升后下降的趋势,这是由于贮藏期间,各微生物对乳糖的代谢逐渐减慢,导致生成的葡萄糖不足以维持酵母菌的生存,因此酵母菌开始对之前积累的半乳糖进行利用。在贮藏过程中仍然未检测出有葡萄糖的存在,Richmond等[19]研究表明发酵贮藏直到第50天才可检测到葡萄糖且是痕量。
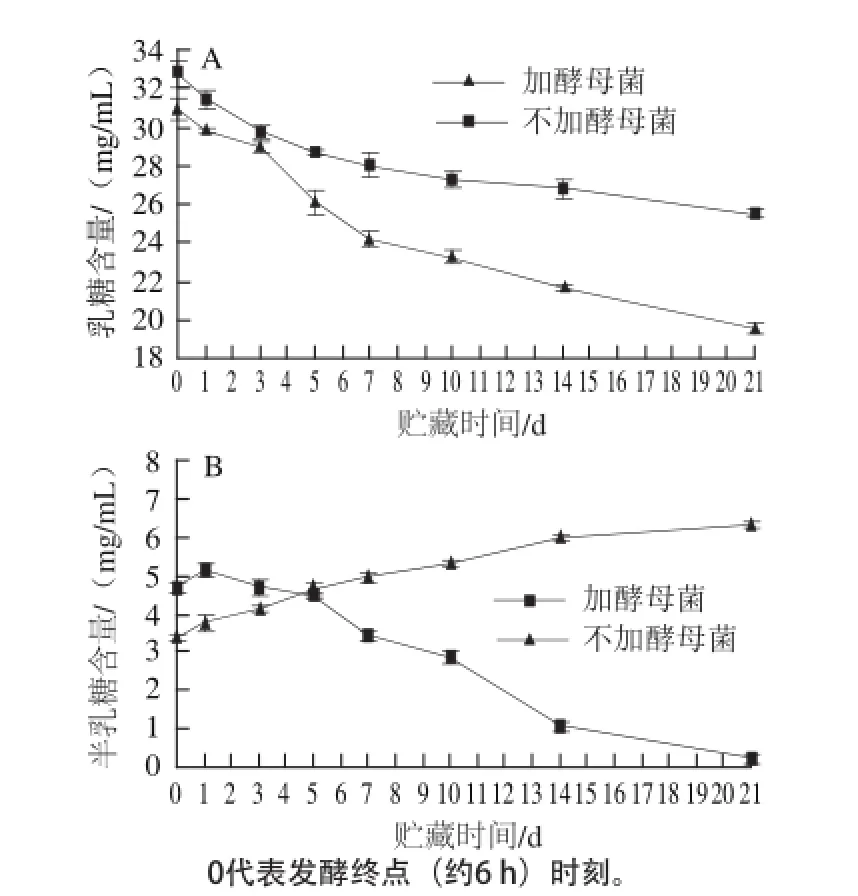
图4 贮藏期间乳糖(A)和半乳糖(B)含量变化Fig.4 Changes in lactose (A) and galactose (B) contents during storage
2.3β-半乳糖苷酶活力测定结果
采用ONPG比色法测定乳糖酶活力。通过单独测定马克斯克鲁维酵母发酵乳中酶活力可知:马克斯克鲁维酵母自身可以产生β-半乳糖苷酶,随培养时间从6 h延长至48 h,β-半乳糖苷酶活力从0.249 U/mL上升到0.543 U/mL,说明其可以自身利用乳糖,进一步验证了2.2.1节中的结论。由图5可知,两种发酵乳中β-半乳糖苷酶活力随发酵时间延长均呈上升趋势,凝乳时两种发酵乳中酶活力分别达到0.966 U/mL和1.677 U/mL,这是由于微生物不断生长繁殖,活菌数的增多导致其产酶量的增加,而酵母菌参与的发酵乳从发酵4 h开始,其β-半乳糖苷酶酶活力高于乳酸菌单独发酵(P<0.05),分析可能原因有两方面:一是酵母菌本身可以产生β-半乳糖苷酶;二是酵母菌促进乳酸菌生长代谢产酶[6]。

图5 不同发酵时间发酵乳中β-半乳糖苷酶酶活力的变化Fig.5 Change in β-galactosidase activity in fermented milk at different fermentation times
2.4EMP途径限速酶活力测定结果
2.4.1HK活力测定结果
HK在糖代谢途径中,起着十分重要的作用,是糖代谢开始的启动因子,它催化葡萄糖磷酸化成为6-磷酸葡萄糖,它是整个糖代谢的限速酶,因此分析了酵母菌的加入对HK的影响,结果如图6所示。随发酵时间延长,两种发酵乳中HK活力都随之升高(P<0.05),是微生物不断生长产酶所致。当发酵4 h后,含有酵母菌的发酵乳中HK活力显著高于单独乳酸菌发酵(P<0.05),由于HK是EMP途径限速酶,因此说明酵母菌的加入对糖酵解进程有一定的促进作用。
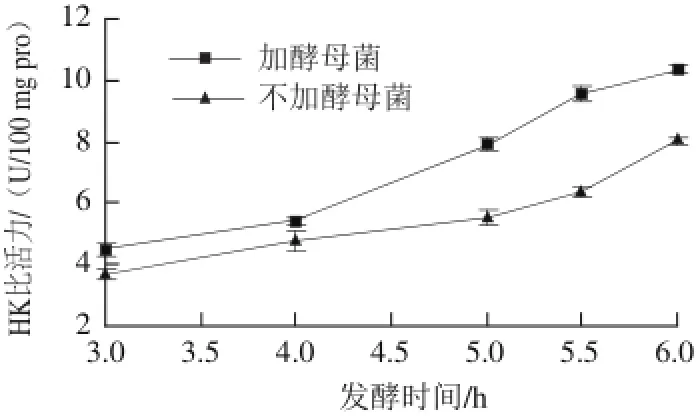
图6 发酵期间己糖激酶活力变化Fig.6 Change in hexokinase activity in fermented milk at different fermentation times
2.4.2PK活力测定结果
PK是糖酵解途径中第三个限速酶,它的作用是催化磷酸烯醇式丙酮酸转化成丙酮酸,同时生成一个ATP。PK活性的提高有利于糖酵解途径的顺利进行。它在细胞内含量的多少直接反映了细胞内流经糖酵解过程的通量的大小。因此分析酵母菌加入对PK活力的影响,结果如图7所示。随着发酵时间的延长,两种发酵乳中PK活力大体呈上升趋势,发酵4.5 h后含有酵母菌的发酵乳中PK活力明显高于乳酸菌单独发酵(P<0.05),说明酵母菌的加入对PK活性有一定促进作用,也侧面反映了马克思克鲁维酵母可以加快EMP进程。

图7 发酵期间丙酮酸激酶活力变化Fig.7 Change in pyruvate kinase activity in fermented milk at different fermentation times
2.5丙酮酸含量的变化
对丙酮酸含量变化进行测定,对比两种发酵乳中丙酮酸含量,结果如图8所示,随着发酵的进行,两种发酵乳中丙酮酸含量均呈现先增加后降低的趋势,可能是因为发酵前5.5 h丙酮酸的合成代谢大于其分解代谢,之后由于快接近发酵终点,较多的丙酮酸转变成乳酸,导致其含量降低。含有酵母菌的发酵乳其丙酮酸含量较高(P>0.05),可能是由于含有酵母菌的发酵乳中PK活力较高或酵母菌自身可以通过EMP途径产生丙酮酸,导致较多的丙酮酸生成。
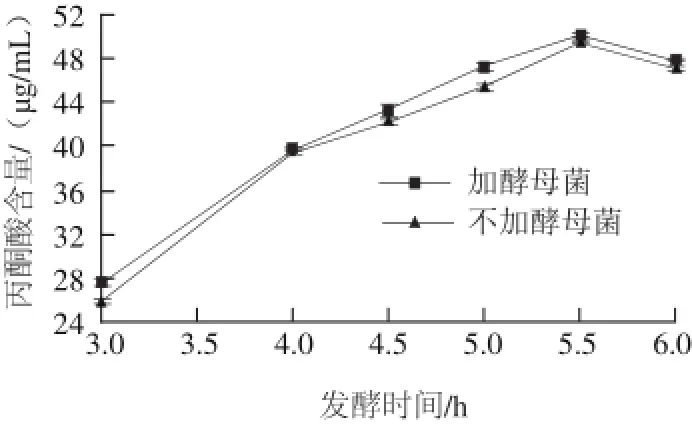
图8 发酵期间丙酮酸含量变化Fig.8 Change in pyruvic acid content during fermentation
2.6乳酸脱氢酶活力测定结果
乳酸脱氢酶可以在无氧条件下催化丙酮酸生成乳酸,因此研究酵母菌对乳酸脱氢酶活力的影响有助于进一步分析其对乳酸生成的作用。结果如图9所示,由于乳酸菌的不断生长繁殖,导致两种发酵乳中乳酸脱氢酶活力均随发酵的进行而增加(P<0.05),凝乳时两种发酵乳中乳酸脱氢酶活力分别达到1.031 U/mL和0.707 U/mL;含有酵母菌的发酵乳中乳酸脱氢酶活力高于单独乳酸菌发酵,从4.5 h后差异具有显著性(P<0.05),由于马克斯克鲁维酵母自身无法产生乳酸脱氢酶或酶的生成量没有达到方法检出限,因此产生这种现象的原因可能有两点:一是酵母菌可以促进乳酸菌生长,加速乳酸菌产酶;二是果糖-1,6-二磷酸为别构激活剂,可大幅度提高乳酸脱氢酶活力,酵母菌的加入可以促进EMP途径的进行,导致其中果糖-1,6-二磷酸产物的增多,进而提高乳酸脱氢酶活力[20]。

图9 发酵期间乳酸脱氢酶活力变化Fig.9 Change in lactate dehydrogenase activity in fermented milk at different fermentation times
2.7乳酸含量测定结果
乳酸作为乳糖发酵终产物不仅可以改善酸乳风味,还决定了乳品保藏过程中后酸化的程度,对发酵乳中乳酸含量的测定可以有利的监控乳品质量,因此对样品中乳酸含量进行测定,结果如图10所示,含有酵母菌的发酵乳中乳酸含量从1.16 mg/mL上升到6.48 mg/mL,乳酸菌单菌发酵乳中乳酸则从1.17 mg/mL上升到5.76 mg/mL,两种发酵乳中乳酸含量均随发酵的进行而增加;从发酵3 h开始,含有酵母菌的发酵乳中乳酸含量显著高于乳酸菌单独发酵(P<0.05),这对之前两组发酵乳pH值测定具有差异性进行了说明,产生这种现象的原因可能是:含有酵母菌的发酵乳中乳酸脱氢酶活力较高,导致产生了较多的乳酸。

图10 发酵期间乳酸含量变化Fig.10 Change in lactate content during fermentation
3 结 论
发酵乳中的糖代谢主要是指微生物代谢乳糖生成乳酸的过程。在乳糖作为唯一碳源的12 g/100 mL全脂乳培养基中,乳糖首先被β-半乳糖苷酶分解为葡萄糖和半乳糖;葡萄糖直接进入EMP途径生成丙酮酸,EMP途径的关键限速酶有己糖激酶、6-磷酸果糖激酶和丙酮酸激等;由于乳酸菌体内没有足够的半乳糖激酶,使得半乳糖不能被利用,但马克斯克鲁维酵母可以弥补这一不足,将半乳糖进行转化,以6-磷酸葡萄糖的形式进入EMP途径,生成丙酮酸;生成的丙酮酸在乳酸脱氢酶的作用下最终生成乳酸,完成发酵。
本实验确定了马克斯克鲁维酵母加入后,整个微生物代谢糖过程中关键代谢产物及酶活力变化规律。1)糖类代谢产物变化规律:发酵期间,酵母菌的加入促进乳糖的分解代谢(P<0.05),由于葡萄糖进入EMP途径被快速转化,因此未检测出其含量,而两种发酵乳中半乳糖均处于积累状态。贮藏期间,两种发酵乳中乳糖降解缓慢,生成的葡萄糖量不足以维持微生物生长,因此酵母菌开始利用积累的半乳糖。2)关键酶活性变化规律:含有马克斯克鲁维酵母的发酵乳中β-半乳糖苷酶、乳酸脱氢酶、己糖激酶、丙酮酸激酶活性均增强(P<0.05),导致乳糖利用率增加,糖酵解进程加快,发酵乳产酸较多。3)有机酸类代谢产物变化规律:马克斯克鲁维酵母的加入可使发酵乳中乳酸含量升高(P<0.05),提前达到凝乳点,缩短工业生产时间。而丙酮酸含量的增加,说明马克斯克鲁维酵母增加糖耗量可能还有其他途径。综上所述,马克斯克鲁维酵母的加入对发酵乳中乳糖代谢起到促进作用。对于酵母菌促进糖代谢的机理还需要更深入的研究,随着各种研究方法的相互借鉴和新的研究手段的出现,有望在不远的将来能更加明确酵母参与糖代谢的整个机理。
[1] HANSEN T K, JAKOBSEN M. Yeast in the dairy industry[D]. Copenhagen: The Royal Veterinary and Agricultural University, 2004.
[2] 贺银凤. 传统发酵乳制品中乳酸菌和酵母菌的互作关系[J]. 中国乳品工业, 2010, 38(10): 43-44.
[3] 李新玲, 顾瑞霞. 马克斯克鲁维酵母的筛选鉴定与应用[J]. 中国奶牛, 2013(15): 44-46.
[4] 卢鑫. 引起酸奶涨包的马克思克鲁维酵母的分离鉴定及特性研究[D].保定: 河北农业大学, 2009: 3-4.
[5] BENNIE C V. The interaction between yeasts and bacteria in dairy environments[J]. International Journal of Food Microbiology, 2001,69: 37-44.
[6] ☒LVAREZ-MART☒N P, FL☒REZ A B, HERN☒NDEZ-BARRANCO A, et al. Interaction between dairy yeasts and lactic acid bacteria strains during milk fermentation[J]. Food Control,2008, 19: 62-70.
[7] GB 5413.34—2010 乳和乳制品酸度的测定[S].
[8] 李琦, 张兰威. 高效液相色谱法测定发酵乳中的乳糖、葡萄糖和半乳糖[J]. 食品科学, 2012, 33(4): 162-165.
[9] INDYK H E, EDWARDS M J, WOOLLARDB D C. High performance liquid chromatographic analysis of lactose-hydrolysed milk[J]. Food Chemistry, 1996, 57(4): 575-580.
[10] GREENBERG N A, MAHONEY R R. Production and characterization of β-galactosidase from Streptococcus thermophius[J]. Journal of Food Science, 1982, 47: 1824-1835.
[11] 郭清泉, 张兰威. 普通酸奶制品在贮存过程中发酵剂菌的β-半乳糖苷酶活性测定及变化规律研究[J]. 食品工业科技, 2002, 23(3):34-36.
[12] 李琦, 张兰威. 破壁方法对嗜热链球菌SP1.1胞内乳糖代谢关键酶活性的影响及其条件优化[J]. 食品科学, 2011, 32(9): 183-185.
[13] LIN Weijin, SAVAIANO D A, HARLANDER S K. A method for determining β-galactosidase activity of yogurt cultures in skim milk[J]. Dairy Science, 1989, 72(2): 351-359.
[14] 胡晓冰, 林标声, 杨生玉. 测定丙酮酸发酵生产产量的几种化学方法的比较[J]. 粮油加工, 2010(12): 165-167.
[15] 杜以文. 几种酒精发酵酵母的乳酸生成动力学[D]. 大连: 大连工业大学, 2011: 11-13.
[16] 李海方, 张涛. 马克斯克鲁维酵母乳糖酶水解和转移性质比较[J].食品工业科技, 2012, 33(25): 123-126.
[17] GONZAILEZ-ANDRADA J I, ROMERO C, MORALES F J, et al. An improved method for determination of the activity of β-galactosidase in yogurt by high-performance liquid[J]. Chromatographia, 1996,43(1/2): 85-88.
[18] SAMONA A, ROBINSON R, MARAKIS S. Acid production by Bifidobacteria and yoghurt bacteria during fermentation and storage of milk[J]. Food Microbiology, 1996, 13(4): 275-280.
[19] RICHMOND M L, HARTE B R, GRAY J I, et al. Determination of sugars in yogurt and microbiological media by high performance liquid chromatography during pocessing and subsequent storage[J]. Journal of Dairy Science, 1987, 70(6): 1140-1147.
[20] 袁剑, 秦浩. 干酪乳杆菌L-乳酸脱氢酶在大肠杆菌中的表达、纯化及酶学性质[J]. 微生物学通报, 2011, 38(10): 1482-1487.
Effect of Kluyveromyces marxianus on Lactose Metabolism in Traditional Fermented Milk
FAN Wei1,2, ZHANG Dongdong2, ZHANG Yu1, JIANG Tiemin2, CHEN Lijun1,2,*
(1. School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China;2. Beijing Dairy Engineering Technology Research Center, Beijing Sanyuan Foods Co. Ltd., Beijing 100076, China)
In order to ascertain the effect of co-fermentation with Kluyveromyces marxianus on the biosynthesis pathway of lactic acid by anaerobic metabolism of lactose, the contents of main lactose metabolites in fermented milks with lactic acid bacteria alone and in combination with Kluyveromyces marxianus were analyzed and compared by HPLC, accompanied by comparative measurement of related key enzymes activities. The results showed that lactose was degraded at a markedly accelerated rate during co-fermentation with Kluyveromyces marxianus and lactic acid bacteria (P < 0.05). Kluyveromyces marxianus could utilize the produced galactose during subsequent storage. Moreover, the presence of the yeast resulted in significantly enhanced activities of β-galactosidase, lactate dehydrogenase, pyruvate kinase and hexokinase during the fermentation process (P < 0.05). As a result, hexokinase and pyruvate kinase, the key rate-limiting enzymes in the Embden-Meyerhof-Parnas (EMP) pathway, were significantly activated (P < 0.05). pH declined faster (P < 0.05) during co-fermentation with Kluyveromyces marxianus than fermentation with single starter culture, which was associated with significantly enhanced production of lactic acid (P < 0.05). However, no significant difference in pyruvic acid content was found between the two fermented milks (P > 0.05). This study reveals that Kluyveromyces marxianus plays an important role in promoting lactose glycolysis.
lactose metabolism; Kluyveromyces marxianus; fermented milk; enzymatic activity; metabolites
TS252.1
A
1002-6630(2015)15-0128-07
10.7506/spkx1002-6630-201515024
2014-09-24
“十二五”国家科技支撑计划项目(2013BAD18B04);2012年度国家星火计划项目(2012GA600001)
范维(1989—),女,硕士研究生,研究方向为食品科学与工程。E-mail:fw837093515@163.com
陈历俊(1967—),男,高级工程师,博士,研究方向为乳品加工。E-mail:chlj@263.net

