miR-34a抑制SW480细胞增殖的机制研究
赖明广 青海涛 王立生 刘圣活
大肠癌是常见的恶性肿瘤之一,其发病率一直呈上升趋势,在全球恶性肿瘤发病率中已上升至第三位,并以每年2%的速度增长[1];在我国,大肠癌死亡率也上升至恶性肿瘤死亡率的第五位[2]。MicroRNA是近10多年来生命领域的研究热点,其中miR-34a是重要的肿瘤抑制生长的因子,它可以调节上皮间质转化过程,已被证实在结肠癌发生、发展中起着非常重要的作用;我们的前期研究也证实miR-34a可以增加SW480细胞对5-FU的敏感性[3-4],但目前对miR-34a在肠癌中的作用仍缺少系统、全面的分析。本文第一部分利用生物信息方法筛选 miR-34a的靶基因,并分析靶基因所参与的信号通路与生物学功能;第二部分通过实验验证miR-34a通过靶向调控SIRT1、NOTCH1基因的表达而抑制SW480细胞的增殖,为明确大肠癌的发病机制提供实验依据。
1 材料与方法
1.1 材料
结肠癌细胞株SW480来源于南方医科大学附属南方医院消化病研究所,miR-34a mimics及其对照均购自上海吉凯基因化学技术有限公司,胎牛血清购自杭州四季青公司,Lipofectamine2000购自 Invitrogen公司;DMEM培养基购自Gibco公司,兔抗人SIRT1、NOTCH1购自Cell Signaling公司,兔抗人β-actin、辣根过氧化物酶标记二抗及发光试剂盒均购自Santa Cruz公司。
1.2 方法
1.2.1 miR-34a靶基因预测及功能网络构建 通过检索miRTarBase 数据库(http://mirtarbase.mbc.nctu.edu.tw)和 miRBase数据库(http://www.mirbase.org/index.shtml),筛选出已经被实验验证了的miR-34a靶基因,使用Cytoscape3.2.1的ClueGo和CluePedia插件和DAVID 6.7数据库对筛选出的靶基因进行GO分析和功能富集分类,KEGG对miR-34a的所有靶基因进行信号通路富集分析。
1.2.2 细胞培养及转染 SW480细胞培养于含10%FBS的RPMI1640培养基,置37℃、5%C02、湿度充分条件下常规培养培养,每2~3 d传代1次,取对数生长期细胞用于实验。转染前1天取生长状态良好的SW480细胞,1.5×106/孔的细胞数铺六孔板,待细胞融合率达 60%时用阳离子脂质体Lipofectamine 2000分别将50 nmol/L miR-34amimic、negative control(对照组)转染细胞,转染方法严格按照说明书进行;转染成功或准备好的细胞分组后进行下一步实验。
1.2.3 Western blot检测基因 SIRT1、NOTCH1蛋白表达 利用Lipofectamine 2000将miR-34a mimics或 mimics的对照转染至SW480细胞,48 h后收集各组细胞,用PBS洗涤细胞2次,加入细胞裂解液裂解细胞。BCA法蛋白定量后以每孔20 μg总蛋白上样,跑胶分离,转膜,兔抗人多克隆一抗 SIRT1(1∶500)和NOTCH1(1∶1 000)4℃孵育过夜,TBST洗膜,二抗 37℃孵育2 h,ECL法显色,凝胶成像仪照相后保存。
1.2.4 MTT法检测miR-34a对 SW480细胞增殖的抑制作用
各组SW480细胞接种于96孔板中培养(5×103个/孔),每组设3个复孔。待检测的细胞每孔加入 MTT(5.0 g/L)20 μl后置孵育4 h,弃去上清,再加入二甲基亚砜150 μl。30 min后用酶标仪检测570 nm处的光密度值,连续5 d。
1.3 统计学分析
实验数据采用 SPSS 17.0统计软件,单因素方差分析,p<0.05为有统计学意义。
2 结果
2.1 miR-34a特异性靶基因及通路富集分析
通过检测miRTarBase和miRBase数据库,筛选出已经验证的 miR-34a靶基因共56个;包括 NOTCH1、SIRT1、BCL2、VEGFA、NOTCH2、FOXP1等,用 DAVID数据库中的 KEGG对筛选出的靶基因进行信号通路富集分析,取p<0.001;FDR<0.05;共富集到8条通路,包含Pathways in cancer,Small cell lung cancer以及本文研究的Colorectal cancer,具体见表1。
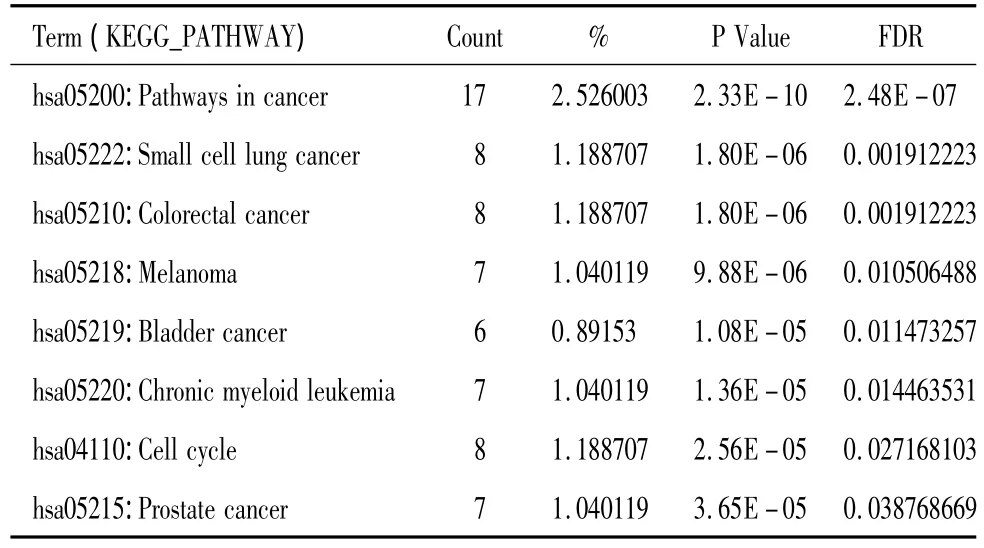
表1 miR-34a靶基因通路富集情况
2.2 靶基因基因基因富集分析与互作网络图
为了探究miR-34a靶基因之间是否存在相互作用,我们将筛选出的56个基因借助 Cytoscape3.2.1软件中的 ClueGo和CluePedia插件进行分析并绘制基因互作网络。分析发现这些基因调控相关的生物学功能,根据参与程度前三位分别为Wnt Signaling Pathway and Pluripotency、Pathways in cancer、MicroRNAs in cancer,也包含Notch signaling pathway(见图1);互作网络图显示了靶基因之间的相互作用和生物学功能分类,其中基因SIRT1、NOTCH1是相互作用网络图中的重要节点,提示他们可能扮演着重要的角色(见图2)。
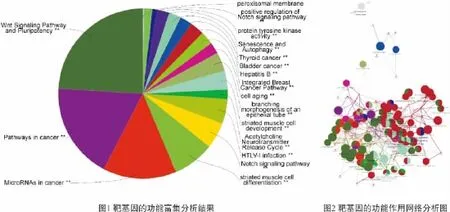
2.3 miR-34a通过负向调控SIRT1、NOTCH1表达阻滞SW480细胞的增殖
Western blot检测结果显示:与对照组相比较,miR-34amimics转染组的SIRT1、NOTCH1蛋白水平明显下降,两者比较差异有显著统计学意义 (p<0.01)(见图3);细胞生长曲线显示miR-34a mimics转染组细胞与对照组细胞相比,长速度明显减慢,在接种5 d后比较两组有显著统计学差异 (p<0.01)(见图4)。结果提示 miR-34a可能通过负性调控 SIRT1、NOTCH1的表达而抑制SW480细胞的增殖。
3 讨论
MicroRNA是一种大小为19-25bp的单链、小分子、非编码RNA,它可以通过与其靶mRNA的3'-UTR区结合,引发mRNA降解或抑制靶基因的表达;miRNA在肿瘤的形成过程中扮演重要角色[5]。miR-34家族是近年来研究较多的一个microRNA家族,包括miR-34a、miR-34b和miR-34c三个成员,他们在多种肿瘤中均表达下调,其表达水平的下调影响了肿瘤干细胞的维持、肿瘤细胞的生长、迁移和化疗抵抗[6]。MiR-34a被认为是潜在的抑制肿瘤生长的因子,miR-34a启动子区存在p53蛋白结合位点而受到p53的直接调控,同时它们又调控p53本身及其下游通路关键基因的表达,参与p53信号通路的调控;在DNA损伤等因素刺激下,p53促进miR-34a表达上调,通过miR-34a抑制多个靶蛋白的表达,从而引起细胞周期阻滞、衰老和凋亡,抑制肿瘤的发生发展[4,7]。最近研究发现,低氧的环境可以促进miR-34a表达的下调,进而促进上皮细胞发生上皮间质转化(EMT)[8];另有报道 miRNA -34a在肝癌、前列腺癌、结肠癌和胰腺癌中低表达,进一步研究提示miRNA-34a的降低可能会改变肿瘤生存的微环境,与肿瘤的发生相关[6,9-11]。本文通过检测miRTarBase和miRBase数据库,筛选出已经验证的miR-34a靶基因共56个,进一步靶基因通路富集分析发现多与肿瘤相关,文中列出富集度高,且FDR较低的8个生物学通路;对miRNA-34a的靶基因功能富集分析结果显示Wnt信号通路富集度最高。Wnt信号通路由一系列癌基因和抑癌基因编码的蛋白质组成,与肿瘤发生、发展等病理生理过程密切相关,预测结果符合miR-34a大多数实验研究结果,同时可以根据预测结果和构建的靶基因相互作用网络图,指导下一步临床和实验研究。
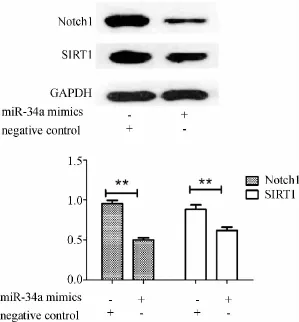
图3 miR- 34a对SW480细胞SIRT1、NOTCH1蛋白表达的影响;两组比较,**p<0.01
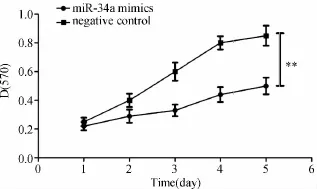
图4 miR-34a对SW480细胞增殖的影响;两组比较,**p<0.01
作为miR-34a的靶基因,SIRT1和NOTCH1均参与了肿瘤的生成和发展过程[4,12]。SIRT1是存在于哺乳动物中与 Sir2同源性最高的依赖NAD+的Ⅲ组蛋白类去乙酰化酶,它在蛋白质转录后修饰及转录调控中起重要作用,它修饰参与信号通路传导的下游蛋白,可调节下游的 P53、NF-kβ、叉头基因家族(FOXO)等蛋白活性,参与细胞衰老、炎症反应及凋亡调节,同时在基因沉默、表观遗传学修饰、转录调控及信号转导调节中发挥重要的生物学功能[13-14]。SIRT1能催化 p53蛋白 c端赖氨酸382残基去乙酰化,参与调节p53的转录因子活性,抑制p53依赖性凋亡途径[11]。NOTCH1属于 NOTCH基因家族成员之一,已知NOTCH1在包括肠道、血液、脑组织、皮肤等组织中均有表达,它通过信号传递调节细胞之间的相互作用[15-16];分子流行病学调查显示NOTCH1功能失活是结直肠癌患者预后不良的重要标志[17]。NOTCH1既是 NOTCH信号通路的核心分子,也是Wnt信号通路中的关键分子,在癌基因的失活或激活中起重要作用[18]。本文结果显示,miR-34a mimics转染后,SW480细胞的SIRT1、NOTCH1蛋白水平明显下降;细胞增殖实验发现miR-34a mimics转染后的SW480细胞的生长速度明显减慢。本文研究结果初步表明,miR-34a可能通过负向调控 SIRT1、NOTCH1而抑制SW480细胞的增殖。
总之,本研究通生物信息学分析发现miR-34a可能通过多个信号通路参与肿瘤的发生、发展;实验研究验证了在大肠癌细胞中miR-34a可能通过负向调控 SIRT1、NOTCH1而抑制SW480细胞的增殖,为大肠癌的发生机制及肿瘤标志物的筛选等研究工作提供了实验基础。
[1]JEMAL A,SIEGEL R,WARD E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71 -96.
[2]陈万青张,曾红梅,郑荣寿,等.中国2010年恶性肿瘤发病与死亡[J].中国肿瘤,2014(1):1-10.
[3]KANG L,MAO J,TAO Y,et al.MiR - 34a Suppresses the Breast Cancer Stem Cell-like Characteristics by Downregulating Notch1 Pathway[J].Cancer Sci,2015,106(6):700 -708.
[4]LAI M,DU G,SHI R,et al.miR -34a inhibits migration and invasion by regulating the SIRT1/p53 pathway in human SW480 cells[J].Mol Med Rep,2015,11(5):3301 -3307.
[5]杨群芳,严伟玲.卵巢恶性肿瘤组织中微小RNA的检测及其临床意义[J].现代医院,2014,14(7):72 -75.
[6]WANG R,MA J,WU Q,et al.Functional role of miR -34 family in human cancer[J].Curr Drug Targets,2013,14(10):1185-1191.
[7]YAMAKUCHI M,LOWENSTEIN C J.MiR -34,SIRT1 and p53:the feedback loop[J].Cell Cycle,2009,8(5):712 -715.
[8]BRABLETZ T.MiR-34 and SNAIL:another double-negative feedback loop controlling cellular plasticity/EMT governed by p53[J].Cell Cycle,2012,11(2):215 -216.
[9]HERMEKING H.The miR -34 family in cancer and apoptosis[J].Cell Death Differ,2010,17(2):193 -199.
[10]DI MARTINO M T,LEONE E,AMODIO N,et al.Synthetic miR-34a mimics as a novel therapeutic agent for multiple myeloma:in vitro and in vivo evidence[J].Clin Cancer Res,2012,18(22):6260-6270.
[11]WANG X,CHANG X,ZHUO G,et al.Twist and miR -34a are involved in the generation of tumor-educated myeloid-derived suppressor cells[J].Int J Mol Sci,2013,14(10):20459 -20477.
[12]JI X,WANG Z,GEAMANU A,et al.Delta-tocotrienol suppresses Notch-1 pathway by upregulating miR-34a in nonsmall cell lung cancer cells[J].Int J Cancer,2012,131(11):2668 -2677.
[13]CHOI H K,CHO K B,PHUONG N T,et al.SIRT1-mediated FoxO1 deacetylation is essential for multidrug resistance-associated protein 2 expression in tamoxifen-resistant breast cancer cells[J].Mol Pharm,2013,10(7):2517 -2527.
[14]FUJINO K,OGURA Y,SATO K,et al.Potential neuroprotective effects of SIRT1 induced by glucose deprivation in PC12 cells[J].Neurosci Lett,2013,557 Pt B:148 -153.
[15]MA J,WU M.The indicative effect of Notch1 expression for the prognosis of T-cell acute lymphocytic leukemia:a systematic review[J].Mol Biol Rep,2012,39(5):6095 -6100.
[16]FENG Q,TAN HH,GE ZZ,et al.Thalidomide-induced angiopoietin 2,Notch1 and Dll4 downregulation under hypoxic condition in tissues with gastrointestinal vascular malformation and human umbilical vein endothelial cells[J].J Dig Dis,2014,15(2):85-95.
[17]CHU D,LI Y,WANG W,et al.High level of Notch1 protein is associated with poor overall survival in colorectal cancer[J].Ann Surg Oncol,2010,17(5):1337 - 1342.
[18]COANT N,BEN MKADDEM S,PEDRUZZI E,et al.NADPH oxidase 1 modulates WNT and NOTCH1 signaling to control the fate of proliferative progenitor cells in the colon[J].Mol Cell Biol,2010,30(11):2636 -2650.

