蔗糖异构酶突变菌株的构建及其应用研究
滕菲,肖华,王宁鹤,李玉,路福平
(天津科技大学生物工程学院,天津300457)
蔗糖异构酶突变菌株的构建及其应用研究
滕菲,肖华,王宁鹤,李玉,路福平
(天津科技大学生物工程学院,天津300457)
蔗糖异构酶是糖苷水解酶13家族的重要成员,可以异构化蔗糖生成异麦芽酮糖和海藻酮糖,同时水解生成少量的葡萄糖和果糖。通过定点突变法对土壤发散菌来源的蔗糖异构酶基因进行定点突变,在大肠杆菌中实现异源表达,获得3例突变菌株R-M1(Q299E),R-M2(Q299D),R-M3(Q299N)。R-M1转化蔗糖的产物当中,异麦芽酮糖的比例从90.28%升至93.16%,海藻酮糖比例从3.09%降低到1.79%。对突变菌株R-M1游离细胞转化蔗糖底物的条件进行了优化,确定了最适转化条件为:30℃条件下,投入浓度为8×109cfu/mL的细胞到蔗糖浓度为50%的10 mL的磷酸柠檬酸缓冲液中,反应90 min,可实现蔗糖最大程度的转化,麦芽酮糖产物浓度达到460 mg/mL。
蔗糖异构酶;土壤发散菌;异麦芽酮糖;全细胞转化
蔗糖异构酶(sucroseisomerase,SIase,EC5.4.99.11)是一类重要的葡萄糖基转移酶,主要有两种作用,一是异构化,可以催化蔗糖异构化反应生成异麦芽酮糖(α-D-吡喃葡糖基-1,6-D-果糖,isomaltulose)和海藻酮糖(α-D-吡喃葡糖基-1,1-D-果糖,trehalulose)两种主要产物;二是水解,异构化的同时水解蔗糖生成少量的葡萄糖和果糖。
SIase以蔗糖为底物,可生成异麦芽酮糖,异麦芽酮糖除具有与蔗糖类似的物理性质和口感外,还有低热量、不致龋、不吸湿、耐酸解等特点,因此在无糖甜食品的生产中具有较好的应用前景[1-2]。不同微生物来源的SIase作用于蔗糖所形成的产物比例各不相同,尤其是异麦芽酮糖和海藻酮糖的比例差别较大,如红色精朊杆菌、普城沙雷氏菌、大黄欧文氏菌、植生克雷伯氏菌、克雷伯氏菌LX3和分散泛菌UQ68J转化蔗糖产物主要是异麦芽酮糖(75%~91%)[4-9];而嗜温嗜酸假单胞菌MX-45和放射形土壤杆菌MX-232转化蔗糖产物为海藻酮糖(88%~90%)[10-11]。
据报道,不同来源的SIase中,土壤发散菌UQ68J来源的SIase催化蔗糖获得异麦芽酮糖产物的比例最高。本实验室已构建了土壤发散菌来源的SIase在大肠杆菌中表达的重组菌R-W(BL21/pET22b-sim),在此基础上,本研究拟通过对蔗糖异构酶基因进行定点突变,构建重组突变株,并对催化产物中异麦芽酮糖比例较高的突变株的转化条件进行优化,为开发细胞催化或酶法催化生产异麦芽酮糖的工业应用提供理论参考。
1材料与方法
1.1菌株和质粒
大肠杆菌重组菌R-W:天津科技大学生物工程学院实验室构建和保存。
1.2试剂与仪器
限制性内切酶SacI、BamHI、T4DNA连接酶、PCR试剂、DNA marker、DNA片段纯化试剂盒:均购自宝生物工程(大连)有限公司;DNA抽提试剂盒和质粒快速抽提试剂盒:均购自上海申能博彩科技有限公司;IPTG、蛋白质相对分子质量标准品:购自美国Bio RAD公司;其他常用试剂均为国产分析纯;异麦芽酮糖标准品:购自Sigma公司。
1.3方法
1.3.1突变菌株的构建
1.3.1.1定点突变引物的设计
根据质粒pET22b-sim的基因序列,和突变位点Q299E,Q299D,Q299N的选择,利用Primer5.0设计出全长扩增引物sim-f、sim-p,重叠引物mid-f1、mid-p1;midf2、mid-p2;mid-f3、mid-p3,如表1所示。

表1 引物序列表Table 1The table of primer sequence
1.3.1.2重叠PCR扩增突变基因及重组突变株的构建
早期构建的重组菌R-W,实现了SIase在大肠杆菌的可溶性表达。本研究以重组表达质粒pET22b-sim为模板,通过定点突变得到突变基因sim1(Q299E),sim2(Q299D),sim3(Q299N),分别克隆于pET-22b表达载体,转入E.coli BL21表达宿主,获得重组菌R-M1(Q299E),R-M2(Q299D),R-M3(Q299N)。
1.3.2突变重组菌的培养及重组酶的诱导表达
LB培养配方参考文献[12];菌体生长量以OD600值表示。挑取重组菌接种于2 mL含100 mg/mL Amp的LB液体培养基中,37℃,200 r/mim培养过夜。取1 mL培养物接种于装有50 mL LB(Amp)液体培养基的250mL摇瓶中,37℃,200 r/mim培养,直到OD600=0.6~0.8,加入0.5 mmol/L的IPTG,于20℃下诱导10h,诱导结束后收集菌体细胞,于6 000 r/min,4℃离心20 min,去除上清,将菌体细胞用缓冲液洗涤重悬。
1.3.3重组酶活力的测定
取经诱导表达后的细胞培养液1 mL,6 000 r/min离心10 min收集菌体,使用pH 6.0的柠檬酸磷酸盐缓冲液洗涤3次,后重悬至1 mL,加入30℃下预热的,体积为5 mL的10%蔗糖浓度的pH 6.0的柠檬酸磷酸盐缓冲液作为底物,在30℃的恒温槽中反应10 min,后沸水浴5 min终止酶促反应,12 000 r/min离心10 min取上清液,同样的方法应用于不含目的基因的大肠杆菌制备空白对照。各取5 mL于50 mL比色管中稀释10倍;各取1 mL稀释液加入0.5 mL DNS溶液,混匀,沸水浴5 min,冷却至室温后加入4 mL蒸馏水;以空白样品作参比,用1 cm比色皿在540 nm测定吸光值;以烘干恒重的葡萄糖标准物代替酶液做标准曲线,将其转化为葡萄糖(还原糖)浓度,可以根据标准曲线查出所测粗酶液转化蔗糖产生还原糖的含量,从而测定SIase的酶活。
酶活力的定义为:1 mL酶液或1 g酶粉在30℃,pH 6.0的条件下,1 min催化可形成相当于1 μmol葡萄糖的还原糖,即为一个酶活力单位,符号为:1 kat/mL或1 kat/g[13]。
1.3.4重组突变株转化产物中异麦芽酮糖的分析检测
取经诱导表达后的细胞培养液5 mL,6 000 r/min离心10 min收集菌体,使用pH 6.0的柠檬酸磷酸盐缓冲液洗涤3次,后重悬至1 mL,在50 mL离心管中加入10 mL,10%蔗糖浓度的pH 6.0的柠檬酸磷酸盐缓冲液,放入30℃的恒温槽中预热5 min,加入1 mL菌体重悬液,摇匀,恒温槽中反应60 min,反应液经离心过膜处理,作为HPLC样品,用于检测各糖组分浓度。
转化产物的HPLC检测条件如下,检测器:RID示差检测器;色谱柱:TSK-gel分析柱;流动相:乙腈∶水= 90∶10(体积比);柱温:80℃;流速:1.0 mL/min;进样量:10 μL。
1.3.5重组菌R-M1(Q299E)合成异麦芽酮糖的条件研究
1.3.5.1细胞浓度对异麦芽酮糖产量的影响
取经诱导表达后的细胞培养液于4℃,6 000 r/min离心10 min获得菌体细胞,用pH 6.0的柠檬酸磷酸盐缓冲液将细胞洗涤3次,以不同的菌体浓度(1×109、2× 109、4×109、6×109、8×109、1×1010cfu/mL)添加到转化液中,用于转化10 mL质量分数为60%蔗糖溶液,考察细胞用量对异麦芽酮糖产量的影响。
1.3.5.2温度对异麦芽酮糖产量的影响
取经诱导表达后的细胞培养液于4℃,6 000 r/min离心10 min获得菌体细胞,用pH 6.0的柠檬酸磷酸盐缓冲液将细胞洗涤3次,以约为8×109cfu/mL的菌体浓度投入到转化液中,在温度分别为30、35、40℃的条件下,用于转化10 mL质量分数为60%蔗糖溶液,考察温度对异麦芽酮糖产量的影响。
1.3.5.3蔗糖质量分数对异麦芽酮糖产量的影响
取经诱导表达后的细胞培养液于4℃,6 000 r/min离心10 min获得菌体细胞,用pH 6.0的柠檬酸磷酸盐缓冲液将细胞洗涤3次,以约为8×109cfu/mL的菌体浓度,在30℃条件下,添加入不同蔗糖浓度的溶液中(40%、50%、60%、70%)进行转化反应,考察蔗糖质量分数对异麦芽酮糖产量的影响。
2结果分析
2.1突变菌株的构建
2.1.1Gln299突变为Glu获得sim1
以质粒pET22b-sim为模板,分别以引物sim-f和重叠引物mid-p1,重叠引物mid-f1和引物sim-p进行PCR,得到PCR产物1和PCR产物2。结果见图1。

图1 重叠PCR产物结果检测图谱Fig.1Agarose gel electrophoresis of recombinant PCR
电泳条带显示一条约900 bp和一条约800 bp的条带分别与产物1和产物2预期大小相当。结果如图1-A所示。然后经过重叠PCR及大量扩增PCR,将PCR产物1和PCR产物2进行重组,得到一条全长约1700 bp的条带,与目的基因sim1大小相符。结果如图1-B所示。
2.1.2Gln299突变为Asp获得sim2,Gln299突变为Asn获得sim3
方法同2.1.1。
2.1.3突变菌株R-M1,R-M2,R-M3的鉴定
SacI和BamHI双酶切,回收sim1,sim2,sim3片段,将其与经相同酶切线性化的pET-22b(+)载体连接,构建重组质粒转入E.coli DH5α,提取转化子酶切验证,获得大小约为1 700 bp和5 500 bp大小的片段,结果正确,如图2所示。将重组质粒转入载体E.coli BL21,获得突变菌株R-M1,R-M2,R-M3。
2.2HPLC定量分析异麦芽酮糖

图2 双酶切鉴定重组质粒Fig.2Identification of recombinant plasmid by digestion with SacI and BamHI
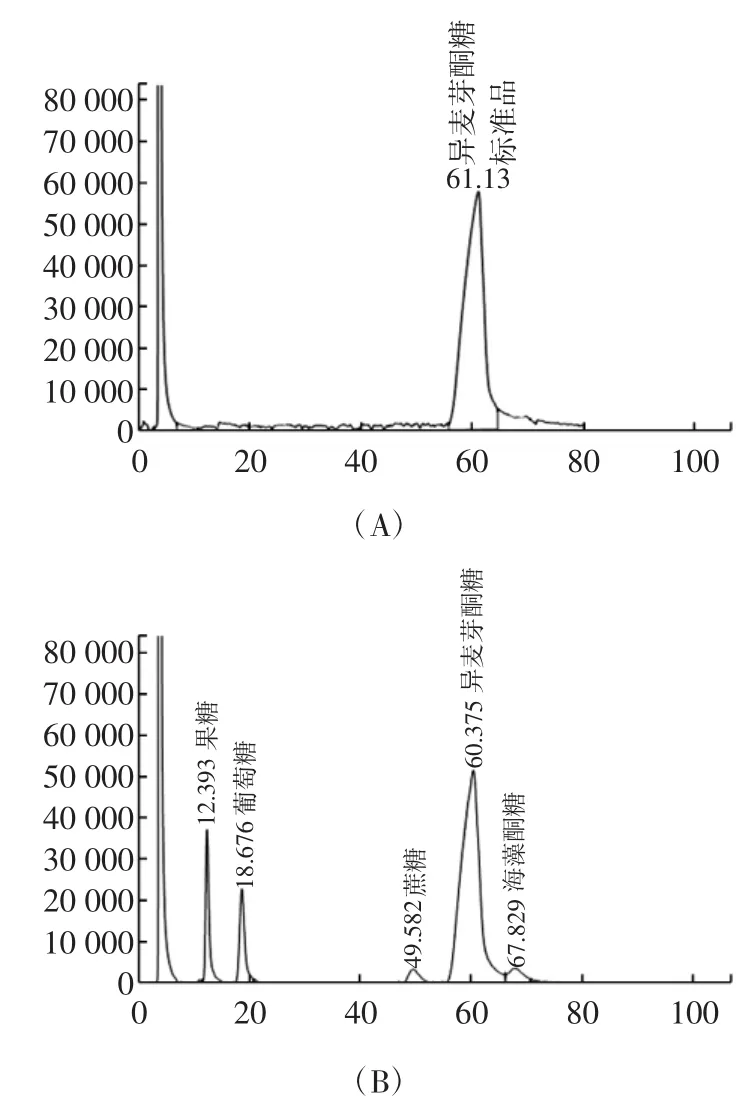
图3 HPLC法对转化产物的分析检测图谱Fig.3HPLC analysis of the sugars converted by SIase
异麦芽酮糖标准品及反应样品的HPLC结果如图3所示(A、B),从色谱图中可以看出,异麦芽酮糖出峰时间为60.375 min,果糖12.393 min,葡萄糖18.676 min,蔗糖49.582 min,海藻酮糖67.829 min。果糖、葡萄糖、蔗糖、异麦芽酮糖、海藻酮糖5者能够完全分开,且峰形较好。反应样品与标准品样品图谱相比,两个主峰形状相似,保留时间一致,该HPLC方法可以对异麦芽酮糖进行有效、同步的定量分析。
2.3突变菌株R-M1,R-M2,R-M3的重组酶活力及催化产物分析
经酶活力检测及HPLC法对转化产物中各糖组分含量的测定,结果如表2所示。
与R-W菌株相比,3株突变株的酶活力均没有显著的变化。而在产物特异性方面,只有R-M1的异麦芽酮糖比例有一定的升高,从野生型的异麦芽酮糖占90.28%升至93.16%,海藻酮糖比例从3.09%下降至1.79%,同时水解作用也有些微的降低。因此,对Q299E突变体转化蔗糖的反应条件进行进一步的优化,提高转化效率,为大规模高效生产异麦芽酮糖提供可能。
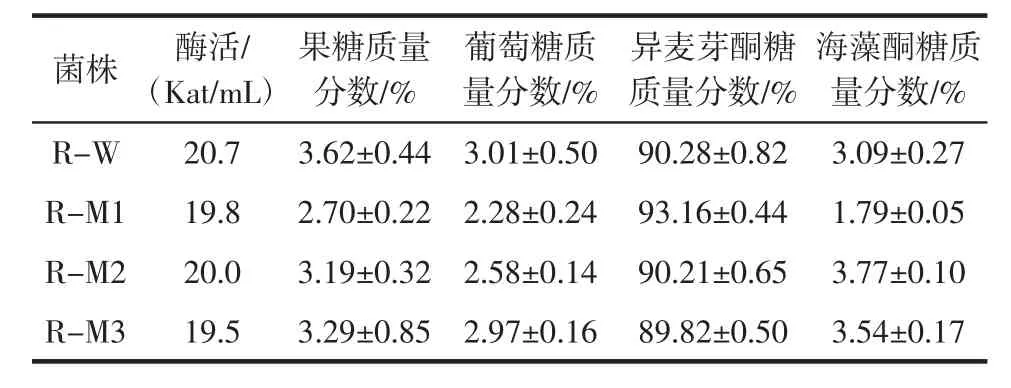
表2 异构酶转化产物中糖组分的分析Table 2Sugar compositions of reaction mixtures of the enzymes
2.4突变菌株R-M1合成异麦芽酮糖的转化条件研究
2.4.1细胞浓度对异麦芽酮糖产量的影响
考察细胞浓度对异麦芽酮糖产量的影响见图4。

图4 细胞用量对异麦芽酮糖产量的影响Fig.4Effects of the amount of cells on isomaltulose production
由图4可见:诱导结束后,将培养基离心获得菌体细胞,缓冲液洗涤3次,以不同的菌体浓度(1×109、2×109、4×109、6×109、8×109、1×1010cfu/mL)添加到转化液中,细胞浓度高异麦芽酮糖生成速率快,但细胞浓度高于8×109cfu/mL时,异麦芽酮糖生成速率变化不大,均能在120 min内转化完全,最终异麦芽酮糖的浓度达到557 mg/mL。因此选择浓度为8×109cfu/mL的细胞用于转化10 mL浓度为60%的蔗糖溶液。
2.4.2温度对异麦芽酮糖产量的影响
温度对异麦芽酮糖产量的影响见图5。
由图5可见:在温度为30、35、40℃时,异麦芽酮糖的生成曲线很相似,反应120 min后,异麦芽酮糖产量均不再升高,其中在30℃条件下,异麦芽酮糖的生成速率相对略快,120 min后达到555 mg/mL,而转化温度为25℃时,反应120min后异麦芽酮糖仅能达到465 mg/mL。因此选30℃作为最佳转化温度。

图5 转化温度对异麦芽酮糖产量的影响Fig.5Effects of the temperature on isomaltulose production
2.4.3蔗糖质量分数对异麦芽酮糖产量的影响
蔗糖质量分数对异麦芽酮糖产量的影响见图6。

图6 底物浓度对异麦芽酮糖产量的影响Fig.6Effects of substrate concentration on isomaltulose production
由图6可见:底物质量分数越小,完全转化所需的时间越短。当蔗糖质量分数分别为40%和50%时,90 min内均能完全转化,异麦芽酮糖浓度达到370 mg/mL和460 mg/mL,随着底物浓度的增大,糖溶液黏度也增大,转化速率降低,当蔗糖质量分数增加至60%或70%时,120 min时转化仍没有实现完全转化,此时异麦芽酮糖浓度分别达到496 mg/mL和521 mg/mL。实验操作过程中发现,底物浓度越大,糖溶液黏度增大不利于产物的提取分离。综合考虑,尽可能在较短的时间内使底物转化完全及产物后期提取的可操作性,选择50%蔗糖溶液作为催化底物。
3结论
1)本文通过定点突变法对已构建的重组菌R-W的蔗糖异构酶基因进行分子改造,获得突变菌株RM1,R-M2,R-M3。其中R-M1与原始基因表达菌株相比产物特异性发生明显变化,异麦芽酮糖的比例从90.28%升至93.16%,海藻酮糖比例从3.09%降低到1.79%。
2)确定了R-M1的最适转化条件为:30℃条件下,投入细胞浓度为8×109cfu/mL的细胞到蔗糖浓度为50%的10 mL溶液中,反应90 min,可实现蔗糖99%以上的最大程度的转化,获得异麦芽酮糖产物浓度达到460 mg/mL。
[1]唐文竹,陈放,李宪臻.蔗糖异构酶催化生产异麦芽酮糖研究进展[J].微生物学通报,2012,39(9):1314-1322
[2]周兴,韦星明,杨祥开,等.大黄欧文氏菌蔗糖异构酶控制产物特异性基序的定点突变[J].基因组学与应用生物学,2011,30(5):556-563
[3]Ooshima T,Izumitani A,Minami T,et al.Trehalulose does not induce dental caries in rats infected with mutans Streptococci[J].Caries Research,1991,25(5):277-282
[4]Cheetham P S.The extraction and mechanism of a novel isomaltulose synthesizing enzyme from Erwinia rhapontici[J].Journal of Biochemistry,1984,220(6):213-220
[5]Ravaud S,Watzlawick H,Haser R,et al.Overexpression,purification,crystallizationandpreliminarydiffractionstudiesoftheProtaminobacter rubrum sucrose isomerase SmuA[J].Acta Crystallographica Section F Structural Biology and Crystallization Communications,2006,62(3):74-76
[6]Krastanov A,Yoshida A.Production of palatinose using Serratia plymuthica cells immobilized in chitosan[J].Journal of Industrial Microbiology and Biotechnology,2003,30(5):593-598
[7]Wu L,Birch R G.Characterization of the highly efficient sucrose isomerase from Pantoea dispersa UQ68J and cloning of the sucrose isomerase gene[J].Applied and Environment Microbiology,2005,71(6): 1581-1590
[8]Kawaguti H Y,Sato H H.Palatinose production by free and Ca-alginate gel immobilized cells of Erwinia sp.[J].Biochemical Engineering Journal,2007,36(3):202-208
[9]Huang J H,Hsu L H,Su Y C.Conversion of sucrose to isomaltulose by Klebsiella planticola CCRC 19112[J].Journal of Industrial Microbiology&Biotechnology,1998,21(2):22-27
[10]Nagai-Miyata J,Tsuyuki K,Sugitani T,et al.Isolation and characterization of a trehalulose-producing strain of Agrobacterium[J].Bioscience Biotechnology and Biochemistry,1993,53(8):2049-2053
[11]Miyata Y,Sugitani T,Tsuyuki K,et al.Isolation and characterization of Pseudomonas mesoacidophila-producing trehalulose[J].Bioscience Biotechnology and Biochemistry,1992,54(3):1680-1681
[12]Sambrook J,Fritsch E F,Maniatis T.Molecular cloning:A laboratory manual[M].NewYork:Cold Spring Harbor Laboratory Press,1989: 234-240
[13]Zhang D,Li N,Lok S M,et al.Isomaltulose synthase(PalI)of Klebsiella sp.LX3.Crystalstructure and implication of mechanism[J].Journal of Biochemistry,2003,278(7):35428-35434
Engineering of Mutant Sucrose Isomerase Producing Strain and Its Application
TENG Fei,XIAO Hua,WANG Ning-he,LI Yu,LU Fu-ping
(The College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China)
Sucrose isomerase was a major member in the glucoside hydrolase family 13.In addition to catalyzing the isomerization of sucrose to isomaltulose,it also produced trehaltulose and small amounts of fructose and glucose.Sim derived from Pantoea dispersa had been subject to site-directed mutagenesis;3 mutants(RM1(Q299E),R-M2(Q299D),R-M3(Q299N))were obtained.Q299E exhibited increased isomaltulose content(from 90.28%to 93.16%)and reduced percentage of trehalulose(from 3.09%to 1.79%).The optimal conditions for sucrose conversion of mutant R-M1 was determined as follows:the culture(substrate concentration was 8×109cfu/mL)was centrifuged and then resuspended in 10 mL of citrate/phosphate-buffered 50%sucrose solutionand incubated for 90 min at 30℃.Sucrose was completely converted under the above conditions and the concentrations of isomaltulose reached up to 460 mg/mL.
sucrose isomerase;Pantoea dispersa;isomaltulose;whole-cell biotransformation
10.3969/j.issn.1005-6521.2015.17.036
2014-05-20
国家高技术研究发展计划(863计划)项目“糖醇合成与功能性糖醇的研制”(2012AA021502);教育部长江学者和创新团队发展计划项目“食品安全与营养关键控制技术研究”(IRT1166)
滕菲(1989—),女(汉),硕士,研究方向:微生物与分子生物学。

