鲤JAK2基因分子克隆及组织表达分析
付 友,高 谦,文春根,吴 平,,刘德立
(1.南昌大学生命科学与食品工程学院,江西 南昌 330031;2.中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,湖北 武汉 430072;3.华中师范大学生命科学学院,湖北 武汉 4300790)
鲤JAK2基因分子克隆及组织表达分析
付友1,2,高谦2,文春根1,吴平2,3,刘德立3
(1.南昌大学生命科学与食品工程学院,江西南昌330031;2.中国科学院水生生物研究所,淡水生态与生物技术国家重点实验室,湖北武汉 430072;3.华中师范大学生命科学学院,湖北武汉 4300790)
采用同源克隆策略和RACE-PCR技术,克隆得到可能的鲤(Cyprinus carpio)两面神激酶2(JAK2)基因的cDNA全长序列,包括3 378 bp的开放阅读框,732 bp的5'-非编码区,529 bp的3'-非编码区,总长度达4 639 bp。开放阅读框可编码1 125个氨基酸,推测分子质量和理论等电点分别为129.33 ku和6.99。同源性分析显示,克隆的鲤鱼基因与斑马鱼(Danio rerio)JAK2同源性最高,其氨基酸序列同一性和相似度分别达89%和95%。结构域预测表明,所编码氨基酸序列包含FERM、SH2及两个酪氨酸激酶结构域,这4个结构域也保守地存在于其他脊椎动物的JAK分子中。高级结构预测显示,鲤JAK2主要包括α-螺旋(α-helix)、β-折叠(β-sheet)和连接环(loop)等3类结构元件。脊椎动物JAK分子系统进化树显示,JAK1、JAK2、JAK3和TYK2等4类JAK分子分别聚类,鲤JAK2处于JAK2支系中,与所有其他的鱼类JAK2聚为一大支,并与两栖类和哺乳类组成的另一大支构成姊妹群,表明它们具有共同的祖先基因,为直系同源关系。实时荧光定量PCR检测结果表明,鲤JAK2在皮肤中表达量最高,其次是肠、血液和脑,而在肌肉、鳃、头肾、心、肝、脾中表达量较低;鲤JAK3在脾中表达量最高,在其他组织中表达量均很低,甚至未检出。
鲤;JAK2;JAK3;基因克隆;组织表达分析
两面神激酶(Janus kinase,JAK)是一种非受体型蛋白酪氨酸激酶。JAK家族有JAK1、JAK2、JAK3和TYK2等4个成员,JAK1和TYK2进化关系较近,JAK2则与JAK3关系较近[1]。除JAK3主要是在造血细胞中起作用,其他3种JAK均广泛存在于各种类型的细胞中,参与多种细胞因子受体的信号转导[2]。经典的JAK-STAT信号通路是细胞表面的受体与相应配体结合后,受体分子发生交叉磷酸化并激活与受体胞内区偶联的JAK激酶,活化的JAK催化受体上特定部位的酪氨酸残基发生磷酸化修饰,形成“停泊位点”(docking site)来募集含SH2结构域的信号转导及转录激活因子(signal transducers and activators of transcription,STAT),所招募的STAT也被JAK磷酸化并形成二聚体,进而转位进入细胞核,启动下游基因转录[3]。JAK2是JAK家族的重要成员,在哺乳动物中,JAK2可分别与STAT3、STAT5等构成多条信号传导途径,参与造血细胞的发育、分化和凋亡,以及与免疫和炎症等相关的多种反应[4-8]。对哺乳类JAK2及其他JAK分子的研究已比较深入,但对鱼类JAK2分子的研究相对较少[9],功能研究尤为滞后。鲤鱼(Cyprinus carpio)是我国重要的淡水经济鱼类,其JAK1[10]和JAK3[11]已有报道,本课题组亦克隆、鉴定了鲤 TYK2基因,并利用实时荧光定量 PCR(Real-time quantitive PCR,RT-qPCR)技术分析鲤TYK2和JAK1在鱼体各组织器官中的分布[12],本研究在此基础上克隆鲤JAK2的cDNA全长序列,分析鲤 JAK2及与其系统发育关系较近的 JAK3(GenBank登录号:AF148993.1)的组织表达模式,以期为系统研究鲤鱼JAKs在JAK-STAT信号通路中的调控机制奠定基础。
1 材料和方法
1.1总RNA提取和cDNA合成
实验所用鲤鱼的获取、暂养,鱼体组织样品,包括血液、肝、脾、肠、头肾、心脏、肌肉、皮肤、鳃和脑组织的采集,以及Trizol试剂盒提取各组织样品总RNA,均同文献[12]。通过质量分数1%的琼脂糖凝胶电泳和 NanoDrop 2000(Thermo Scientific)检测所提取 RNA的质量和浓度。提取RNA的操作步骤除特别注明外,均在冰浴中完成,试剂提前置冰上预冷。实验所用离心管、枪头及溶剂均为无RNase产品。
以鲤鱼组织总RNA为模板,Oligo(dT)18为反转录引物,使用 RevertAidTM First Strand cDNA Synthesis Kit(Thermo Scientific)反转合成cDNA第一链,操作参照试剂盒使用说明。使用 BD SMARTerTM RACE cDNA Amplification Kit(Clontech),利用鲤鱼脑组织总 RNA制备 5' -和3'-RACE SMART cDNA模板,具体步骤参见文献[12]。所有cDNA样品置于-20℃冰箱中保存备用。
1.2鲤JAK2 cDNA全长的分段扩增、克隆与序列测定
参照斑马鱼(Danio rerio)、草鱼(Ctenopharyngodon idellus)、鳜(Siniperca chuatsi)的 JAK基因序列(GenBank登录号分别为 NP_571162、JF825474.1和FJ629182.1)设计JAK2-F1/JAK2-R1和JAK2-F2/JAK2-R2两对引物(表1),分两部扩增鲤JAK2 cDNA的中间片段。PCR反应体系如下:Premix Taq(TaKaRa Taq ver 2.0 plus dye)12.5μL,正反向引物(10 μmol/L)各1μL,脾组织cDNA模板1 μg,用ddH2O补足至25μL。PCR反应程序为:94℃ 5min;94℃ 30s、54℃30s、72℃ 90s,30个循环;72℃ 10min。扩增产物经质量分数1%的琼脂糖凝胶电泳检测后,利用E.Z.N.A.TM Gel Extraction Kit(Omega)纯化目的片段,连接pMD18-T(TaKaRa),连接产物转化大肠杆菌DH5α感受态细胞,涂含氨苄青霉素(100 μg/mL)的LB平板,于37℃条件下约培养10 h,挑取阳性克隆送上海生工生物工程有限公司测序。
根据所获得的中间片段序列,参照 BD SMARTerTM RACE cDNA Amplification Kit(Clontech)的原理和方法,设计用于5' -和3'-RACE的基因特异性引物GSP和NGSP(表1)。分别利用鲤脑组织5' -和3' -RACE SMART cDNA模板,依次进行Touchdown PCR和Nest PCR,扩增鲤JAK2 cDNA的5'-和3'-末端。50μL 的Touchdown PCR体系: cDNA(5' - cDNA模板980 ng/μL,3' -cDNA模板1 037 ng/μL)2.5μL、10 mmol/L UPM 5μL、10 mmol/L GSP 1μL、10×Ex Taq buffer 5μL、10 mmol/L dNTP 1μL、5 U/μL Ex Taq 1μL和ddH2O 34.5μL;50μL 的Nest-PCR体系: Touchdown PCR产物0.5μL、10 mmol/L NUP 1μL、10 mmol/L NGSP 1μL、10×Ex Taq buffer 5μL、10 mmol/L dNTP 1μL、5 U/μL Ex Taq 1μL和 ddH2O 40.5μL。Touchdown PCR程序:94℃ 3min;94℃ 30s、62℃ 30s、72℃ 2min,5个循环;接着94℃ 30s、60℃ 30s、72℃ 2min,5个循环;最后94℃30s、58℃ 30s、72℃ 2min,25个循环。Nest PCR程序:94℃ 3min;94℃ 30s、58℃ 30s、72℃2min,35个循环;72℃ 10min。PCR产物纯化、克隆的方法与前面所述的中间片段克隆相同。
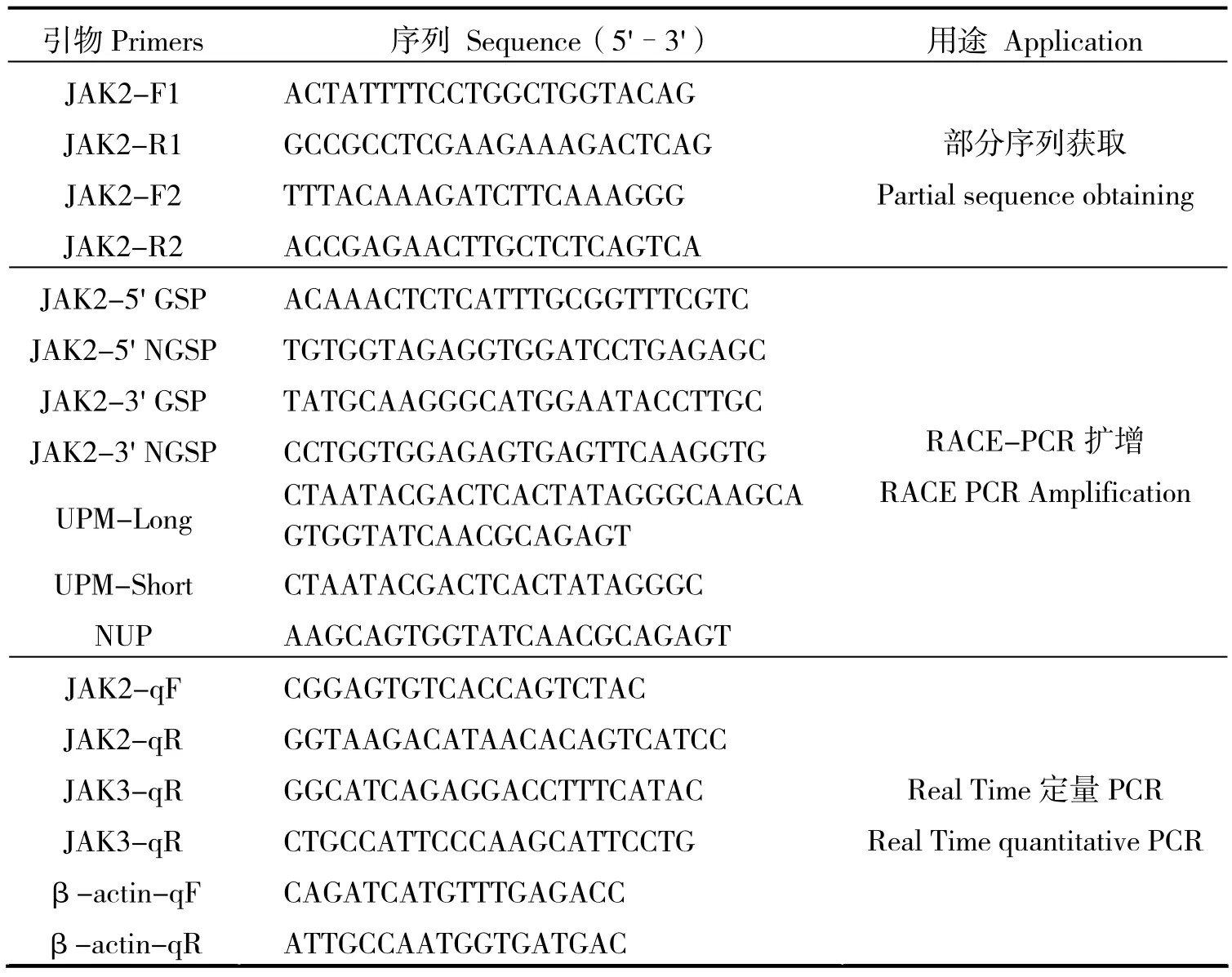
表1 鲤JAK2基因克隆与表达分析所用引物Table 1 Primers used for cloning and expression analysis of JAK2 gene in Cyprinus carpio
1.3序列分析、空间结构预测和分子系统发育树构建
使用NCBI网站(http://www.ncbi.nlm.nih.gov)的BLASTN和BLASTX进行核酸和蛋白序列相似性搜索。通过ExPASy网站(http://expasy.pku.edu.cn)的相关在线软件进行开放阅读框搜索和氨基酸序列推断。使用Protparam软件(http://expasy.org/tools/protparam.html)进行蛋白质理化性质预测。用SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP/)分析蛋白信号肽序列。PSORT II Prediction(http://psort.hgc.jp/form2.html)用于蛋白亚细胞定位预测。用 SMART(http://smart.emblheidelberg.de/)和 Scan Prosite(http://prosite.expasy.org/scanprosite/)工具软件用来预测蛋白结构域。
利用 PredictProtein软件(http://www.predictprotein.org)预测鲤JAK2的蛋白二级结构。首先在Protein date bank(PDB)数据库中通过BLAST查找与鲤JAK2序列相似度最高的目标,进而以其为模板,利用Swiss-Model(http://swissmodel.expasy.org/)进行同源建模,运用PyMol软件对空间结构模型进行分析与显示。在GenBank数据库中搜索JAK基因家族各成员的相关序列,使用 Clustal X和Genedoc软件进行氨基酸序列多重比对和人工校对,采用 MEGA 4.0中的邻接法(Neighbour-Joining,NJ)构建分子系统发育树,通过1 000次自展重复对分支可靠性进行检验。
1.4实时荧光定量PCR分析
随机选取体质量约200g的健康鲤鱼5尾,每尾鱼 10个组织器官样品的总 RNA提取及用于RT-qPCR反应模板的cDNA第一链制备同1.1。以鲤β-actin(GenBank登录号:M24113.1)为内参基因[12-13],采用RT-qPCR技术分析鲤JAK2和JAK3基因(GenBank登录号:AF148993.1)在 mRNA水平的组织表达模式,标准曲线构建参照文献[13]。实时荧光定量反应在 CFX-96(BIO-RAD)定量PCR仪上进行,20μL的反应体系包括:SYBR Green I(Qiagen)10μL,正反向引物(10 μmol/L)各1μL,鲤鱼组织cDNA模板1μL,ddH2O 7μL。反应程序为:95℃ 3min;95℃ 10s,55℃ 20s,72℃ 30s,75℃读板5s,85℃读板5s,40个循环;95℃变性15s,在65~95℃升温区间每隔0.5℃读板5s,进行熔解曲线分析。通过仪器所载CFX Manager软件观察 RT-qPCR检测结果并导出数据,使用Excel工具软件计算目的基因与内参基因的拷贝数比值,来确定鲤JAK2和JAK3基因在mRNA水平的相对表达量,具体分析步骤参见文献[13]。各基因荧光定量PCR所用引物列于表1。
2 结果与分析
2.1鲤JAK2基因cDNA全长和序列特征
拼接所获各段序列,得到鲤JAK2基因cDNA全长达4 639 bp,其中5' 端非编码区(5' -Untranslated region,5' -UTR)732 bp,3' 端非编码区(3' -UTR)529 bp,开放阅读框(open reading frame,ORF)长度为3 378 bp,推测其编码1 125个氨基酸。3' -UTR包含33 bp的Poly(A)尾,在Poly(A)上游发现有两个ATTTA 型mRNA不稳定信号和一个加尾信号(AATAAA)(图1)。
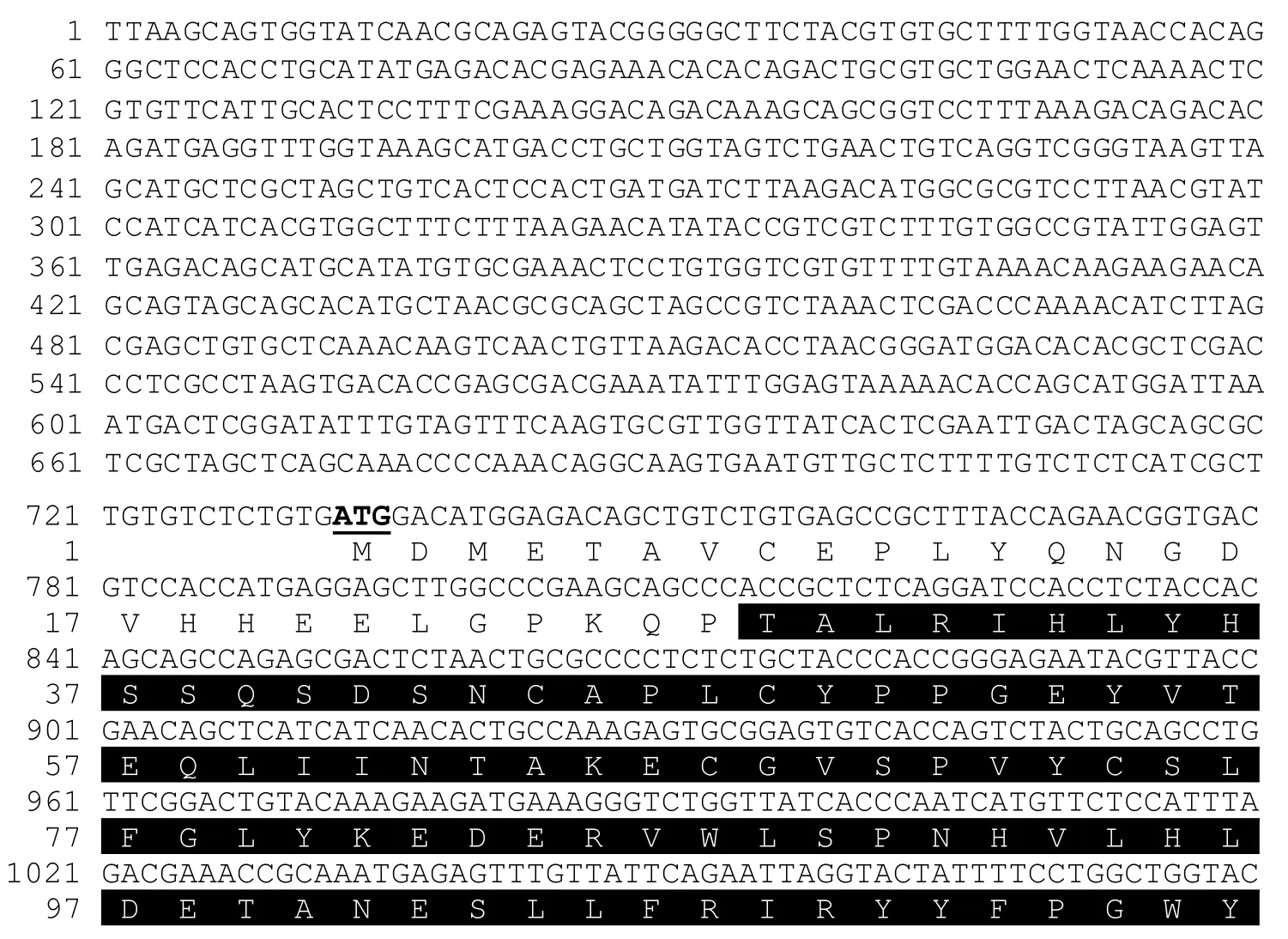
图1 鲤JAK2基因cDNA全长序列及其推导的氨基酸序列Fig.1 Full-length cDNA and predicted amino acid sequences of carp JAK2 gene

续图1 (Continued)

续图1 (Continued)
软件预测该蛋白分子质量为129.33 ku,理论等电点为6.99,包含141个碱性氨基酸(K、R)、146个酸性氨基酸(D、E)、358个疏水性氨基酸(A、I、L、F、W、V)、313个极性氨基酸(N、C、Q、S、T、Y);不稳定系数46.27,为不稳定蛋白。SignalP软件分析显示,该蛋白无信号肽区段。亚细胞定位分析预测,鲤JAK2主要分布在细胞核(47.8%)和细胞质(34.8%),此外也少量存在于分泌性囊泡(4.3%)、质膜(4.3%)、线粒体(4.3%)和内质网(4.3%)。蛋白结构域预测发现,鲤JAK2具有4.1蛋白/埃兹蛋白/根蛋白/膜突蛋白(4.1 protein/Ezrin/Radixin/Moesin,FERM)结构域(T28-H363)、Src 同源区2(Src homology 2,SH2)结构域(Y382-E467)、假激酶结构域(pseudokinase domain)(K523-F793)和激酶结构域(kinase domain)(L833-L1110)(图1)。
Predictprotein软件预测,鲤JAK2蛋白二级结构主要包括 α-螺旋(α-helix)(32.18%)、β-折叠(β-sheet)(15.56%)和连接环(loop)(52.27%)。通过Protein date bank(PDB)数据库搜索,发现JAK家族成员的三级结构信息较少,PDB中与鲤JAK2相似性较高的序列均为人的 JAKs,其中人TYK2的 FERM 和 SH2结构域区域(PDB:4PO6_A)与鲤JAK2的对应区域具有最高的序列相似度(37%);人JAK2的假激酶结构域(PDB:4FVQ_A)和激酶结构域(PDB:3KRR_A)与鲤JAK2的对应区域具有最高的序列相似度,分别为55%和 58%。分别以上述三个多肽的晶体构象为模板,利用Swiss-Model软件进行同源模建,得到图2所示的鲤JAK2三个特定结构域区段的三级结构模型。

图2 鲤JAK2各结构域的三级空间结构Fig.2 The tertiary structure of domains of carp JAK2
2.2鲤JAK2氨基酸序列同源性和分子系统发育关系分析
利用 Genedoc软件进行氨基酸序列同源性分析,结果显示,鲤JAK2与斑马鱼的同源性最高,序列同一性和相似度分别达到89%和95%,与鳜的序列同一性和相似度为74%和86%,与非洲爪蟾(Xenopus laevis)、小鼠(Mus musculus)和人类(Homo sapiens)的序列同一性和相似性也在65%和80%以上。鲤JAK2与鲤JAK3的序列相似性亦达64%,与鲤的JAK1和TYK2的序列[12]相似性均在53%左右,JAK1和TYK2序列相似性为58%。
在以邻接法法构建的脊椎动物JAK蛋白分子系统进化树中,JAK家族四类成员分别聚类,所有物种的 JAK2分子聚为一大支,JAK3、TYK2和JAK1也分别形成各自支系。JAK2和JAK3互为姊妹群,TYK2则与JAK1为姊妹群(图3)。在各大支内部,所有鱼类的相应分子聚为一支,进而与哺乳类和两栖类组成的分支构成姐妹群;鲤JAK2处在鱼类JAK2分支中,与斑马鱼JAK2关系最近(图3)。该分子系统树各个分支支持率均较高,除一支为89%,其他均为100%。
2.3鲤鱼JAK2、JAK3在mRNA水平的组织分布RT-qPCR检测结果显示,鲤JAK2和JAK3基因在所检测的10个组织器官(血液、脑、心、头肾、鳃、肠、肝、肌肉、脾、皮肤)中表达水平有明显差异。鲤JAK2在皮肤中表达量最高,其次是肠、血液和脑,在肌肉、心脏、肝、头肾中表达水平较低,表达量最低的是鳃和脾脏(图4-A)。鲤 JAK3在脾脏中表达水平最高,其次是血液和鳃,在脑、心、肝和肌肉中表达量极低,在皮肤中则检测不到(图4-B)。

图3 依据JAK2分子氨基酸序列构建的分子系统进化树Fig.3 Phylogenetic tree of the JAK2 amino acid sequences from various species

图4 鲤JAK2和JAK3基因在不同组织中的转录水平Fig.4 Tissue expression Analysis of carp JAK2 and JAK3 genes in the level of mRNA
3 讨 论
目前,在鱼类 JAK2方面仅见斑马鱼 JAK2 cDNA全长序列(GenBank登录号NP_571162),而在鳜鱼[14]和斑点绿河豚[9]的研究均非 cDNA全长。本研究克隆到鲤鱼JAK2基因的cDNA全长,5' -和3' -UTR均较斑马鱼的5' -和3' -UTR(685 bp和470 bp)长,且其3' -UTR中有2个ATTTA型mRNA不稳定信号,而在斑马鱼中则未发现该信号序列。同源分析显示,鲤JAK2氨基酸序列与斑马鱼对应序列的同一性和相似度高达 89%和95%,长度上仅少一个氨基酸,与哺乳类JAK2的序列同一性和相似性也在65%和80%以上,由此可见,JAK2基因在进化上高度保守。依据JAK氨基酸序列构建分子系统发育树,其拓扑结构与各物种的进化地位和关系相吻合,支持“鱼类和哺乳类的 JAK分子具有共同的祖先基因”的观点[15],提示JAK分子是研究脊椎动物属及以上类群亲缘关系的潜在分子标记。
蛋白结构域预测表明,和其他脊椎动物 JAK一样,鲤JAK2含有FERM结构域、SH2结构域及 2个酪氨酸激酶结构域。在哺乳动物中,JAK分子的FERM结构域为相互作用分子提供结合位点,FERM突变会导致相关信号分子与JAK的结合受限,进而影响信号转导[16]。JAK假激酶结构域缺少催化活性所必需的氨基酸残基,没有磷酸转移酶活性[17],但该结构域的存在有助于JAK激酶活性充分发挥,并具有一定负反馈调节作用[17]。高度保守的酪氨酸激酶结构域是JAK的催化功能区,其中的D978FG-A1008PE序列为环状活化区域(也称“活化环”),对调节酪氨酸激酶的催化活性至关重要,活化环上的“FWY”基序尤其不可或缺[18]。活化环上另一重要基序“Y992Y993”的两个酪氨酸在JAK家族不同成员中作用不同,第1个酪氨酸磷酸化对JAK1、JAK2和JAK3的活性发挥至关重要,第2个酪氨酸突变不影响JAK1和 JAK2活性,但可显著提高 JAK3的活性[18]。基于序列和结构域保守性,推测本研究中的鲤鱼 JAK2在参与细胞因子信号传导方面可能与哺乳类的功能类似,但鱼类JAK2分子及其各结构域的确切功能还有待研究证实。
SignalP 4.0软件预测,鲤JAK2无信号肽序列,这符合其作为非分泌型蛋白在胞内行使功能的特性。有趣的是,亚细胞定位预测显示,鲤 JAK2最高频分布位点在细胞核,其次为细胞质。一般认为JAK激酶是胞质蛋白激酶,只在细胞质中起作用,但已有研究证实,JAK也存在于细胞核内[19-20],核内JAK可磷酸化STAT之外的转录因子,对基因表达起表观调控作用[19]。关于JAK分子入核机制,目前尚无确切答案,是一个有待研究的重要问题。
人JAK2基因在脾脏、外周血、睾丸、心脏和肌肉组织中表达水平较高,在脑、肺、肝、胰、肠、卵巢组织中仅少量表达[21];大鼠 JAK2基因在脑和脾脏组织中表达量最高,其次是肌肉和睾丸,而在肾、心脏、肺、肝组织中表达量较低[22]。鱼类中的相关研究显示,草鱼JAK2基因在肝、肌肉、脑、心、肠、脾脏中均有表达,肝脏中表达量最高,心脏最低[23];鳜鱼中包括 JAK2在内的四个JAK基因在脑、鳃、性腺、心脏、头肾、肠、肝、皮肤和脾组织中表达量都较高,而在肌肉中表达量很低[14]。本研究结果表明,鲤 JAK2在皮肤中表达水平最高,而在肝、心脏、头肾、脾和鳃组织中表达水平都很低。可见,不论是鱼类与哺乳类之间,还是不同种类的鱼类之间,或是不同哺乳类之间,JAK2基因的组织表达状况都存在一定差异。
Yin等[11]采用Northern blot技术对鲤JAK3的组织分布进行了研究,发现JAK3在脾脏和头肾中高表达,在卵巢、肝、肌肉和皮肤中低表达。本研究中鲤JAK3在脾脏中表达量最高,在表达水平仅次于脾脏的血液和鳃组织中,其表达量也远低于脾脏。可见,鲤鱼中的研究结果大致符合或者说支持“JAK3较之其他三个JAK成员具有更强的组织表达偏好性,JAK3主要存在于造血细胞中”的推断[2]。此外,吴平等[12]研究显示,鲤 TYK2的组织表达模式与鲤JAK2的具有一定相似性,同样是在皮肤中表达水平最高,而在心、鳃、肝、脾和头肾中表达水平较低。鲤JAK1则是在血液、肝和脑中表达水平较高,心脏、皮肤、肠次之,在脾、头肾、鳃和肌肉中相对较低[12]。可见,鲤鱼不同JAKs的组织表达模式各有差异。除特异性表达于造血细胞的JAK3(其在脾脏中的表达水平与管家基因β-actin达到同数量级)外,在JAK1、JAK2和TYK2三者中,JAK1组织表达的总体水平显著较高(其转录本拷贝数相对于内参基因β-actin的归一化认定值与后两者的不在一个数量级),其次是JAK2,TYK2的组织表达水平相对最低。鲤鱼JAKs不同成员组织表达模式和组织表达水平的差异与其生物学功能的关联还有待进一步研究探讨。
[1]Liongue C,O’Sullivan L A,Trengove M C,et al.Evolution of JAK-STAT pathway components:mechanisms and role in immune system development [J].PLoS ONE,2012,7(3):1-16.
[2]Ihle J N.Cytokine receptor signaling [J].Nature,1995,377(6550):591-594.
[3]Aaronson D S,Horvath C M.A road map for those who don't know JAK-STAT [J].Science,2002,296(5573):1653-1655.
[4]Nefedova Y,Huang M,Kusmartsev S,et al.Hyperactivation of STAT3 is involved in abnormal differentiation of dendritic cells in cancer [J].J Immunol,2004,172(1):464-474.
[5]Wei Y F,Zhao T J,Zhang Z W,et al.Stellate cells via JAK2-STAT3 pathway to protect against hepatic fibrosis[J].Trop J Pharm Res,2013,12(5):691-698.
[6]Du W,Hong J,Wang Y C,et al.Inhibition of JAK2/STAT3 signalling induces colorectal cancer cell apoptosis via mitochondrial pathway [J].J Cell Mol Med,2012,16(8):1878-1888.
[7]Lai X,Nikolov S,Wolkenhauer,O,et al.A multi-level model accounting for the effects of JAK2-STAT5 signal modulation in erythropoiesis [J].Comput Biol Chem,2009,33(4):312-324.
[8]Lim J,Jeong S J,Koh W,et al.JAK2/STAT5 signaling pathway mediates bojungbangdocktang enhanced hematopoiesis [J].Phytother Res,2011,25(3):329-337.
[9]Leu J H,Yan S J,Lee T F,et al.Complete genomic organization and promoter analysis of the round-spotted pufferfish JAK 1,JAK 2,JAK 3,and TYK 2 genes [J].DNA Cell Biol,2000,19(7):431-446.
[10]Chang M S,Chang G D,Leu J H,et al.Expression,characterization,and genomic structure of carp JAK1 kinase gene [J].DNA Cell Biol,1996,15(10):827-844.
[11]Yin Z,Kwang J.Molecular cloning of a carp JAK3 from activated leukocytes [J].Vet Immunol Immunopathol,2000,74(3/4):225-236.
[12]吴平,高谦,刘德立,等.鲤鱼TYK2基因的克隆、鉴定及组织表达分析[J].水生生物学报,2015,39(1):237-241.
[13]倪砚,高谦,刘德立,等.鲤鱼 SOCS-4基因克隆、鉴定及表达模式分析[J].水生生物学报,2012,36(3):541-545.
[14]Guo C J,Zhang Y F,Yang L S,et al.The JAK and STAT family members of the mandarin fish Siniperca chuatsi:molecular cloning,tissues distribution and immunobiological activity [J].Fish Shellfish Immuno,2009,27(2):349-359.
[15]Stein C,Caccamo M,Laird G,et al.Conservation and divergence of gene families encoding components of innate immune response systems in zebrafish [J].Genome Biol,2007,8(11):R251.
[16]Haan S,Margue C,Engrand A,et al.Dual role of the Jak1 FERM and kinase domains in cytokine receptor binding and in stimulation-dependent JAK activation [J].J Immunology,2008,180(2):998-1007.
[17]Saharinen P,Takaluoma K,Silvennoinen O.Regulation of the JAK2 tyrosine kinase by its pseudokinase domain[J].Mol Cell Biol,2000,20(10):3387-3395.
[18]Feng J,Witthuhn B A,Matsuda T,et al.Activation of Jak2 catalytic activity requires phosphorylation of Y-1007 in the kinase activation loop [J].Mol Cell Biol,1997,17(5):2497-2501.
[19]Zouein F A,Duhe R J,Booz G W.JAKs go nuclear:Emerging role of nuclear JAK1 and JAK2 in gene expression and cell growth [J].Growth Factors,2011,29(6):245-252.
[20]Dawson M A,Bannister A J,Gottgens B,et al.JAK2 phosphorylates histone H3Y41 and excludes HP1 alpha from chromatin [J].Nature,2009,461(7265):819-824.
[21]Saltzman A,Stone M,Franks C,et al.Cloning and characterization of human Jak-2 kinase:High mRNA expression in immune cells and muscle tissue [J].Biochem Bioph Res Co,1998,246(3):627-633.
[22]吴小凤,李小勤,冷向军,等.草鱼 JAK2基因片段序列的克隆及其组织表达分析[J].上海海洋大学学报,2012,21(1):21-26.
[23]Neubauer H,Huffstadt U,Muller M,et al.Embryonic lethality in mice deficient in Janus kinase 2(JAK2)[J].Immunol Lett,1997,56(1):275.
(责任编辑:刘庆颖)
Cloning and Expression Analysis of JAK2 Gene in Common Carp, Cyprinus carpio
FU You1,2,GAO Qian2,WEN Chun-gen1,WU Ping2,3,LIU De-li3
(1.School of Life Science and Food Engineering,Nanchang University,Nanchang 330031,China;2.State Key Laboratory of Freshwater Ecology and Biotechnology,Institute of Hydrobiology,Chinese Academy of Sciences,Wuhan 430072,China; 3.College of Life Science,Central China Normal University,Wuhan 430079,China)
The full-length cDNA sequence of JAK2 gene from common carp,Cyprinus carpio is obtained by using homology cloning and RACE(rapid amplification of cDNA ends)PCR.The full cDNA sequence of common carp JAK2 in length is 4 639 bp,containing a 3 378 bp complete open reading frame(ORF)which encodes 1 125 amino acids,a 732 bp 5'-untranslated region(5'-UTR),and a 529 bp 3'-UTR,with corresponding molecular mass of 129.33 ku and the theoretical isoelectric point of 6.99.The identity and similarity of its amino acid sequence with the corresponding sequence of zebrafish are 89% and 95%,respectively.Bioinformatics analysis indicated that common carp JAK2 had a FERM domain,an SH2 domain,a pseudokinase domain,and a tyrosine kinase domain.These functional domains are conservative among JAKs from fish,amphibians and mammals,showing thatthey share similar functional mechanism.The spatial structural elements of carp JAK2 are predicted to include α-helixes,β-sheets,and loops.Based on the phylogenetic tree of JAK2 generated by neighbor joining method in MEGA 4.0,it shows that each kind of JAKs forms a large monophyletic group,and that the JAK2 main-clade is a sister group to the JAK3 one,which means JAK2 is more closely related to JAK3.Moreover,all JAK2s from the teleost species,including common carp JAK2 in the present study,cluster together,then form the sister group with the second cluster consisting of all from amphibians and mammals.Thus,it is suggested that they should share a common ancestral gene of JAK2 and have remarkable orthologous relationships.The results of real-time quantitive PCR reveal that JAK2 and JAK3 genes are differentially expressed in various tissues of common carp at the level of mRNA.JAK2 is expressed in skin with the highest level,secondly in intestine,blood and brain,and expressed lowly in muscle,head kidney,heart,liver,gill and spleen.The expression level of carp JAK3 in spleen is particularly high,but relatively lower in other tissues.The results in this study have provided a basis for further evaluation on the regulation role of carp JAK2 in the JAK-STAT signaling pathway.
Cyprinus carpio; JAK2; JAK3; gene cloning; tissue expression analysis
Q78;Q959.46+8
A
1673-9159(2015)01-0008-10
2014-05-19
国家自然科学基金面上项目(31272666);国家科技支撑计划课题(2012BAD25B0202);国家自然科学基金面上项目(30871937)
付友(1988-),男,硕士研究生,主要从事鱼类免疫学研究.E-mail:ncuskfuyou@163.com
文春根,教授。Email:cgwen63@163.com.高 谦,Email:gaoqian@ihb.ac.cn

