营养因子强化麦角硫因生物合成的研究
梅保良,刘琦,姜文侠,*,张维亚,杨萍
(1.天津科技大学,天津300457;2.中国科学院天津工业生物技术研究所,中国科学院系统微生物工程重点实验室,天津市工业生物系统与过程工程重点实验室,天津300308)
营养因子强化麦角硫因生物合成的研究
梅保良1,2,刘琦2,姜文侠2,*,张维亚1,2,杨萍2
(1.天津科技大学,天津300457;2.中国科学院天津工业生物技术研究所,中国科学院系统微生物工程重点实验室,天津市工业生物系统与过程工程重点实验室,天津300308)
以糙皮侧耳CGMCC 6232菌丝体深层发酵制备麦角硫因,通过向发酵培养基中添加不同种类及浓度的无机盐、维生素、生长调节剂、有机酸、氨基酸等营养因子,考察对麦角硫因合成积累的影响,研究可能的前体氨基酸对麦角硫因生物合成的影响规律。结果表明:添加氯化铵、硝酸铵、叶酸、VB1、吲哚丁酸、丙酮酸、柠檬酸、谷氨酸、蛋氨酸、半胱氨酸、组氨酸和甜菜碱对麦角硫因的合成有一定的促进作用,其中以发酵第4天向发酵液中添加15 mmol/L蛋氨酸最利于麦角硫因的合成,发酵液中麦角硫因的含量达192.4 mg/L,比对照组(102 mg/L)提高了88.6%。
麦角硫因;生物合成;发酵强化;营养因子;糙皮侧耳
麦角硫因(L-Ergothioneine,EGT)是一种结构及功能独特的天然稀有手性氨基酸,是一种多功能的细胞生理保护剂[1],在医药、食品和化妆品等行业具有广泛的应用前景。利用食用菌深层发酵制备麦角硫因,具有生产成本低、可通过代谢调控等技术手段提高产物的产量,易于规模化生产等优势,更能够保证产品的安全性,是合成麦角硫因的发展方向[2]。
目前对蕈菌合成麦角硫因的发酵优化研究多限于碳源、氮源和常量营养元素的筛选以及发酵过程的工艺优化[2-5]。麦角硫因是次生代谢产物,前体、维生素、生长调节剂、氨基酸等常常是次级代谢物生物合成的重要营养和调节因子。本文基于对食用菌生物合成麦角硫因途径的推测及对食用菌菌丝体发酵过程的认识,考察了多种营养因子和可能的合成前体对麦角硫因合成积累的影响,强化麦角硫因的发酵积累过程。
1材料与方法
1.1菌种与培养基
菌种:糙皮侧耳(Pleurotus ostreatus)CGMCC 6232。
斜面培养基:PDA培养基。
种子培养基(g/L):玉米粉30.0,豆粕粉15.0,KH2PO43.0,MgSO4·7H2O 1.5,α-淀粉酶80 U/L,自然pH,500 mL三角瓶装液量为150 mL,121℃灭菌20 min。
发酵基础培养基(g/L):甘油50.0,胰酪胨35.0,KH2PO43.0,MgSO4·7H2O 1.5,pH 5.6,500 mL三角瓶装液量为150 mL,121℃灭菌20 min。
1.2仪器与主要试剂
IS-RDV3型卧式恒温振荡器:美国精骐有限公司;Agilent 1260型高效液相色谱仪:Agilent Technologies;TW-20型恒温水浴锅:Julabo公司;WH240型磁力搅拌器:WIGGENS公司;SW-OJ-2F型超净工作台:苏州安泰空气技术有限公司;S20K型台式pH计:梅特勒-托利多仪器有限公司;TGL-16M型台式冷冻离心机:湘仪离心机仪器有限公司;Mill-Q型纯水机、3 ku超滤离心管:Millipore公司;麦角硫因对照品:Biomol International Inc;甲醇(色谱纯):Merck公司;一水甜菜碱:潍坊祥维斯化学品有限公司。
1.3方法
1.3.1摇瓶发酵方法
挑取CGMCC 6232斜面菌种约1 cm2,接种至种子培养基,25℃摇床150 r/min培养96 h,制备种子液。将种子液按体积比5%的接种量接入发酵培养基,25℃摇床150 r/min培养,制备菌丝体发酵液。
1.3.2麦角硫因的定量检测方法
1.3.2.1样品的预处理
菌丝体深层发酵结束,将菌丝体发酵液置于90℃水浴,200 r/min搅拌浸提15 min,麦角硫因浸提到细胞外的发酵液中。过滤,收集滤液置于截留分子量3 ku的超滤离心管,10 000 r/min离心超滤10 min,透过液即为发酵液中麦角硫因含量检测的待测样。
1.3.2.2HPLC定量检测条件
色谱柱:AgilentEclipseXDB-C18(4.6 mm×250 mm,5 μm),两根色谱柱串联;流动相:甲醇-水溶液(体积比为1∶99),使用20%的乙酸调节流动相pH至5.0;检测波长:257 nm;流速:0.7 mL/min;柱温:25℃;进样量:5 μL。
2结果与分析
2.1无机盐对麦角硫因生物合成的影响
分别向发酵基础培养基添加0.125 g/L硝酸铜、0.1 g/L硼砂、0.05 g/L硫酸铜、0.005 g/L硫酸亚铁、0.05 g/L硫酸锰、0.1 g/L氯化钙、0.025 g/L硫代硫酸钠、2 g/L氯化铵、5 g/L硫酸铵、2.5 g/L硝酸铵、2 g/L碳酸铵和2 g/L磷酸铵,发酵培养14 d,考察上述无机盐对麦角硫因合成的影响。以发酵基础培养基为对照组,将对照组发酵液中麦角硫因的含量设定为100%,结果见图1。

图1 无机盐对合成麦角硫因的影响Fig.1Effects of inorganic salts on EGT production
由图1可见,添加氯化铵和硝酸铵提高了麦角硫因的合成。进一步优化了这两种铵盐的添加浓度,氯化铵和硝酸铵的添加量分别为4 g/L和5 g/L时,发酵液中麦角硫因的含量较对照组提高24.4%和18.5%。试验结果表明,酪蛋白胨与氯化铵或硝酸铵联合使用更利于菌丝体中麦角硫因的合成积累。
2.2维生素对麦角硫因生物合成的影响
分别向发酵基础培养基添加2.56 mg/L叶酸、0.02 mg/L生物素、6.25 mg/L VC、50 mg/L VB1、20 mg/L VB2、4 mg/L VB6和3 mg/L VB12,发酵培养14 d考察上述维生素对麦角硫因合成的影响。以发酵基础培养基为对照组,将对照组发酵液中麦角硫因的含量定为100%,结果见图2。

图2 维生素对合成麦角硫因的影响Fig.2Effects of vitamins on EGT production
维生素是许多蕈菌的重要生长因子,许多维生素作为辅酶或辅基的组成成分参与微生物的生长代谢[6]。从图2得知,添加叶酸和VB1有利于麦角硫因的合成积累,进一步优化两种维生素的添加浓度,叶酸和VB1的添加量分别为0.64 mg/L和0.1 g/L,发酵液中麦角硫因的含量较对照组提高25%和11.1%。
2.3生长调节剂对麦角硫因生物合成的影响
生长调节剂是用于调节植物生长发育的一类物质,可调控植物体内的核酸、蛋白质和酶的合成,对植物生长的不同阶段起到调节的作用。近年来植物生长调节剂的应用领域愈加广泛,在食用菌中的应用也日趋扩大[7]。
分别向发酵基础培养基添加100mg/L肌醇、1mg/L赤霉素、5 mg/L吲哚乙酸、2 mg/L吲哚丁酸、1 mg/L脱落酸、5 mg/L激动素、5 mg/L奈乙酸和5 mg/L 2,4-二氯苯氧乙酸(2,4-D),发酵培养14 d,考察对麦角硫因合成的影响。以发酵基础培养基为对照组,将对照组发酵液中麦角硫因的含量定为100%,结果见图3。

图3 生长调节剂对合成麦角硫因的影响Fig.3Effects of growth regulators on EGT production
上述生长调节剂中吲哚丁酸对麦角硫因的合成积累具有正向影响。进一步优化了吲哚丁酸的添加量,向发酵基础培养基添加1 mg/L吲哚丁酸,发酵液中麦角硫因的含量较对照组提高9.32%。吲哚丁酸是一种内源生长素,具有促进细胞分裂和生长的作用。陈都珍等使用木屑培养基对平菇进行固体发酵,考察了不同种类的生长调节剂对平菇菌丝体生长的影响,发现外源添加1 mg/L的吲哚丁酸提高菌丝体增长率7%~10%[8]。
2.4有机酸对麦角硫因生物合成的影响
分别向发酵基础培养基添加0.5 mg/L乳酸、2.7 g/L丙二酸、1.76 g/L丙酮酸和0.2 g/L柠檬酸,以2 mol/L的NaOH溶液调节培养基pH至5.6,发酵培养14 d,考察有机酸对麦角硫因合成的影响。以发酵基础培养基为对照组,将对照组发酵液中麦角硫因的含量定为100%,结果见图4。

图4 有机酸对合成麦角硫因的影响Fig.4Effects of organic acids on EGT production
由图4看出,添加丙酮酸和柠檬酸有利于麦角硫因的合成积累。进一步优化了两种有机酸的添加浓度,向发酵基础培养基分别添加2.2 g/L丙酮酸和0.4 g/L柠檬酸,发酵液中麦角硫因的含量比对照组提高了5.85%和10.4%。丙酮酸和柠檬酸是三羧酸循环的起始物和重要的中间产物,三羧酸循环是生物体内糖、脂类和氨基酸代谢的共同途径,许多合成代谢均利用三羧酸循环的中间产物作为生物合成的前体来源[9]。
2.5氨基酸对麦角硫因生物合成的影响
Donald B.Melville等[10]利用同位素示踪法验证了麦角硫因在粗糙链孢霉中的合成前体为组氨酸、蛋氨酸和半胱氨酸,麦角硫因分子中的咪唑环和侧链来源于组氨酸、蛋氨酸和半胱氨酸则是甲基供体和巯基供体,生物合成顺序为组氨酸先经蛋氨酸转甲基作用生成组氨酸甜菜碱,再经半胱氨酸巯基化合成麦角硫因[11]。然而,至今麦角硫因在蕈菌中的生物合成途径尚不清楚。为此,本研究向发酵基础培养基分别添加谷氨酸、蛋氨酸、半胱氨酸和组氨酸,发酵培养15 d,考查上述氨基酸对菌丝体合成麦角硫因的影响,结果见图5~图8。

图5 外源谷氨酸对合成麦角硫因的影响Fig.5Effects of glutamic acid supplementation on EGT production

图6 外源蛋氨酸对合成麦角硫因的影响Fig.6Effects of methionine supplementation on EGT production

图7 外源半胱氨酸对合成麦角硫因的影响Fig.7Effects of cysteine supplementation on EGT production
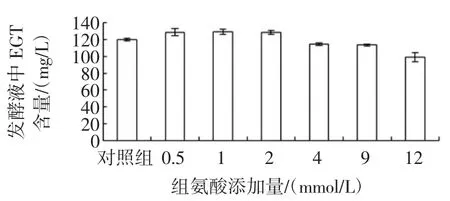
图8 外源组氨酸对合成麦角硫因的影响Fig.8Effects of histidine supplementation on EGT production
谷氨酸是生物机体内氮代谢的基本氨基酸之一,本试验中谷氨酸的添加量为10 μmol/L时,发酵液中麦角硫因的最高含量达131mg/L,较对照组提高9.1%。
由图6和图7得知,分别向发酵基础培养基添加1 mmol/L~20 mmol/L的蛋氨酸和半胱氨酸,发酵液中麦角硫因的含量均高于对照组。蛋氨酸和半胱氨酸的添加量为15 mmol/L,发酵液中麦角硫因的含量最高,分别达到179.6 mg/L和175.5 mg/L,较对照组提高49.5%和46%。试验结果表明,两种外源氨基酸的添加有效地促进了CGMCC 6232菌丝体发酵过程中麦角硫因的合成积累,推测蛋氨酸和半胱氨酸可能是CGMCC 6232合成麦角硫因的前体。
由图8看出,向发酵基础培养基添加0.5 mmol/L~12 mmmol/L的组氨酸,麦角硫因的发酵水平随组氨酸含量的增加呈下降趋势,添加量为1 mmol/L,发酵液中麦角硫因的最高含量达129.5 mg/L,较对照组提高7.7%,组氨酸添加量超过4 mmol/L,麦角硫因的发酵水平却低于对照组。推测外源组氨酸的添加可能抑制了内源组氨酸合成麦角硫因的途径,与DonaldB.Melville的研究结果一致:向粗糙链孢霉培养基添加外源组氨酸,内源组氨酸合成麦角硫因的途径即被抑制[11]。
2.6甜菜碱对麦角硫因生物合成的影响
1个甜菜碱分子中有3个非稳态甲基,是有效的甲基供体,麦角硫因分子中含有甜菜碱的结构,因此,向发酵基础培养基添加1 mmol/L~200 mmol/L的甜菜碱,用2 mol/L的NaOH调节培养基pH至5.6,发酵培养15 d,考察添加甜菜碱对合成麦角硫因的影响,结果见图9。

图9 甜菜碱对合成麦角硫因的影响Fig.9Effects of betaine on EGT production
随甜菜碱添加量的增加,发酵液中麦角硫因的含量呈现先上升后下降的趋势,添加量为150 mmol/L时,麦角硫因的最高发酵水平达146.6 mg/L,较对照组提高了21.8%。
2.7氨基酸的添加时间对麦角硫因合成积累的影响
Chih-Hung Liang等利用杏鲍菇菌丝体发酵合成麦角硫因,发现外源氨基酸的添加时间对麦角硫因合成的影响较大,分别在发酵起始和发酵第7天向培养基中添加4 mmol/L组氨酸,菌丝体中麦角硫因的含量较对照组(2.28 mg/g DW)提高了51.8%和72.4%[12]。本试验考察了蛋氨酸和半胱氨酸的添加时间对麦角硫因合成积累的影响,分别在发酵起始、第2天、第4天、第6天和第8天向培养基添加15 mmol/L蛋氨酸和15 mmol/L半胱氨酸,发酵培养15 d,测定发酵液中麦角硫因的含量,结果见图10。

图10 氨基酸的添加时间对合成麦角硫因的影响Fig.10Effects of amino acids supplementation at various days on EGT production
两种氨基酸的添加时间对麦角硫因合成积累的影响不同。在发酵第4天添加蛋氨酸,发酵液中麦角硫因的含量达192.4 mg/L,较对照组(102 mg/L)提高了88.6%。在发酵第6天添加半胱氨酸,发酵液中麦角硫因含量达168.5 mg/L,比对照组(114.4 mg/L)提高47.3%。由于麦角硫因是次生代谢产物,主要在发酵的中后期合成积累,在发酵中期添加蛋氨酸和半胱氨酸更利于麦角硫因的合成。
3结论
通过考察无机盐、维生素、生长调节剂、有机酸、氨基酸和甜菜碱等营养因子对CGMCC 6232菌丝体深层发酵合成麦角硫因的影响,筛选到了12种促进麦角硫因合成积累的化合物,强化了麦角硫因的发酵积累过程。进一步考察了外源氨基酸的添加时间对麦角硫因合成积累的强化效果,在发酵第4天添加15 mmol/L的蛋氨酸,发酵液中麦角硫因的积累量最高,达192.4 mg/L,比对照组的102 mg/L提高了88.6%。
Donald B.Melville等[10]实验确定了蛋氨酸和半胱氨酸是麦角硫因在粗糙链孢霉中的合成前体,本文试验证明了蛋氨酸和半胱氨酸可以大幅度提高糙皮侧耳合成积累麦角硫因,但还不能确定蕈菌中麦角硫因的合成代谢途径是否与粗糙链孢霉中的合成途径相同。因此,有必要深入探究蕈菌合成麦角硫因的前体,解析麦角硫因在蕈菌中的生物合成途径,建立基于代谢调控的发酵过程优化控制策略,进一步提高麦角硫因的发酵水平。
[1]刘琦,周涛,姜文侠.麦角硫因的理化性质及生物学功能[C].氨基酸、有机酸产业发展论坛论文集,2012:234-242
[2]Pramvadee TepwongAnupam Giri,Fumito SasakiRikuo Fukui,Toshiaki Ohshima.Mycobial enhancement of ergothioneine by submerged cultivation of edible mushroom mycelia and its application as an antioxidative compound[J].Food chemistry,2012,131(1):247-258
[3]刘琦,张维亚,姜文侠,等.麦角硫因生物合成技术的研究进展[C]. 2013年国际氨基酸产业发展高峰论坛论文集,2013:22-27
[4]Republic KR Forestry Res Inst.Culture medium of Ganoderma neojaponicum for increasing ergothioneine and culture method of Ganoderma neo-japonicum[P].KR:KR20100025825A.2008-08-28
[5]Lee Wi Young,Park Eung-Jun,Ahn Jin Kwon.Supplementation of methionine enhanced the ergothioneine accumulation in the Ganoderma neo-japonicum mycelia[J].Applied biochemistry and biotechnology,2009,158(1):213-221
[6]任桂梅,周茂林,毋楠,等.维生素B1对几种担子菌菌丝体生长的影响[J].安徽农业科学,2007,35(26):8075-8076
[7]吴秀珍,王秋玲,杜双田.无机盐、维生素及生长调节剂对斑玉蕈菌丝生长的影响[J].西北农林科技大学学报(自然科学版),2012,40(3):158-162
[8]陈都珍,邓世瑜,蒋纪英,等.生长激素对平菇产量和品质的影响[J].中国食用菌,1982(2):28-35
[9]王镜岩,朱圣庚,徐长法.生物化学(下册)[M].北京:高等教育出版社,2002:110
[10]MELVILLE D B,EICH S,LUDWIG M L.The biosynthesis of ergothioneine[J].The Journal of biological chemistry,1957,224(2): 871-877
[11]Askari A,Melville D B.Reaction sequence in ergothioneine biosynthesis-hercynine as an intermediat[J].Journal of biological chemistry,1962,237(5):1615-1618
[12]Liang Chih-Hung,Huang Ling-Yi,Ho Kung-Jui,et al.Submerged cultivation of mycelium with high ergothioneine content from the culinary-medicinal king oyster mushroom Pleurotus eryngii(higher basidiomycetes)anditscomposition[J].Internationaljournalofmedicinal mushrooms,2013,15(2):153-164
Study on the Biosynthesis of L-ergothioneine by Enhancement of Nutritional Factors
MEI Bao-liang1,2,LIU Qi2,JIANG Wen-xia2,*,ZHANG Wei-ya1,2,YANG Ping2
(1.Tianjin University of Science&Technology,Tianjin 300457,China;2.Tianjin Key Laboratory for Industrial Biological Systems and Bioprocessing Engineering,Key Laboratory of Systems Microbial Biotechnology,Chinese Academy of Sciences,Tianjin Institute of Industrial Biotechnology,Chinese Academy of Sciences,Tianjin 300308,China)
The mycelium of Pleurtus ostreatus CGMCC 6232 was used to produce L-ergothioneine by sub-merged fermentation in this study,the effect of adding different kinds and concentrations of inorganic salts,vitamins,growth regulators,organic acids and amino acids to culture medium on the production of EGT were investigated,particularly,the influencing rules of probable precursors on EGT biosynthesis was studied.The results showed that ammonium chloride,ammonium nitrate,folic acid,VB1,indolebutyric acid,pyruvic acid,citric acid,glutamic acid,methionine,cysteine,histidine and betaine improved EGT production,the effect of methionine on increasing EGT production was the most significant,the individual supplementation of 15 mmol/L methionine at the 4th day yielded a significantly 88.6%higher content of EGT in fermentation liquid(192.4mg/L)compared to that of the control medium(102 mg/L).
L-ergothioneine;biosynthesis;enhancement of fermentation;nutritional factors;Pleurotus ostreatus
10.3969/j.issn.1005-6521.2015.15.027
2014-03-27
天津市青年基金(13JCQNJC10100);天津市科技支撑计划重点项目(10ZCKFSY06300)
梅保良(1987—),男(汉),硕士研究生,研究方向:轻工技术与工程(发酵)。

