ELISA操作注意事项及不确定度分量分析
张伟傅溥博高宏伟魏海燕梁新苗刘建礼刘来福*
(1.北京出入境检验检疫局 北京 100026;2.山东出入境检验检疫局)
ELISA操作注意事项及不确定度分量分析
张伟1傅溥博1高宏伟2魏海燕1梁新苗1刘建礼1刘来福1*
(1.北京出入境检验检疫局 北京 100026;2.山东出入境检验检疫局)
对ELISA的具体操作过程进行了梳理,讨论了操作过程中的注意事项。根据测量不确定度规范性文件的要求,结合要素的注意事项对ELISA检测过程中的不确定度分量进行了初步分析。
ELISA;注意事项;不确定度
1 前言
酶联免疫吸附试验(Enzyme-Linked Immunosorbent Assays,ELISA)是目前在很多领域广泛应用的一种试验方法,其基础是抗原或抗体的固相化及抗原或抗体的酶标记。依其测定抗原和抗体的不同,ELISA可分为直接法、间接法、双抗体夹心法(直接、间接)、竞争抑制法(直接、夹心等)、捕获法等。在测定抗原时,蛋白质大分子抗原测定多用双抗体夹心法,而只有单个抗原表位的小分子则常使用竞争抑制法;对抗体的测定通常使用间接法、双抗原夹心法、竞争抑制法和捕获法等[1]。在实际操作过程中,ELISA会出现一些常见的问题,问题的产生涉及试剂的选择、操作流程及不当操作等。本研究从ELISA检测的常见的问题出发,系统梳理影响ELISA试验结果的因素,根据测量不确定度规范性文件的要求与指南的指导对ELISA测定中的不确定度分量进行了归纳与分析。
2 ELISA检测中常见的问题分析
ELISA方法具有敏感度高、特异性强、自动化程度高等诸多优点,但此方法操作步骤较多,对实验室环境、温度、人员操作有较高要求,试验过程中每个操作环节不规范都会对试验产生影响,得到错误结果[2]。
2.1试剂
试剂本身以及在使用过程中的问题都会导致试验结果不准确,造成结果偏差。如,使用过期试剂或不同试剂盒组分混用;试剂盒未按规定保存或保存温度较高;标准品中可能不含强阳性标本;厂家试剂质量的变化等[3]。试剂、样品用前未平衡至室温;蒸馏水质有问题;待检样品放置时间过长或受到污染;试剂在使用过程中受到污染或反复使用;浓缩洗涤液使用时有结晶,未完全溶解;标记物使用不正确或者已经变质;移液吸头重复使用、未洗净或消毒不完全等。
2.2加样
加样过程中的错加、漏加试剂,或底物加量不足、顺序颠倒,或混合后加入;移液器计量不准,吸头内水分太多或不清洁;样品离心不完全;反应孔内发生凝血或残留细胞成分;加样时交叉污染;样品数量较多,加样时间过长,加样后未混匀等。这些情况会出现白板(显色步骤结束后,酶标反应板所有孔均无显色)、显色弱、灵敏度低、假阳性、重复性差等现象。
2.3温育
在温育过程中,培养箱温度过高或过低;温育时未按要求贴封片或加盖,使样品或稀释液蒸发,吸附于孔壁,难于清洗彻底;人为延长或缩短样品在培养箱中的温育时间,导致非特异性结合紧附于反应孔周围,难以清洗彻底。这些情况会出现显色弱(高)、灵敏度低(高)、重复性差等。
2.4洗板
洗涤液添加过多,使孔与孔之间的液体交叉混合,造成反应板的污染;洗涤液用量不足或稀释倍数不符合要求,洗涤时冲击力太大,浸泡时间过长或不够;反应板数量过多造成洗板等待时间长(在室温较高时),人为地增加了反应时间;洗液量不足;洗板针堵塞,抽吸不完全:洗板不畅等[4]。这些情况会出现白板、显色弱(高)、灵敏度低(高)、假阳性、重复性差等现象。
2.5读板
读板时如果仪器参数设定不正确,滤光片不匹配,计算公式不正确,板底不清洁,酶标仪重复性差等,会导致灵敏度低、假阳性、重复性差等现象[5]。
2.6操作不当
任何不当操作都会影响结果。
2.7本底偏高及假阳性产生
在ELISA检测过程中,本底偏高甚至造成假阳性的结果是比较严重的问题。这主要可能是由以下几种原因造成:样品分离不完全;样品严重溶血或脂血;加样时间过长;样品与稀释液未充分混匀;酶标抗体(抗原)吸附于孔壁或表面;反应与显色时未加盖封口膜;温育时间(反应时间、显色时间)过长或温度过高;洗涤液污染或洗涤不彻底;工作环境温度过高。
2.8本底偏低及假阴性产生的原因
本底偏低及假阴性产生的原因主要包括:试剂未平衡至室温;加样量不足或样品过度稀释;加样时有气泡;抗原、抗体反应时间或显色时间不够;过度洗涤;环境温度过低;试剂盒过期等。
综上所述,ELISA检测技术是一种敏感性高、特异性强、重复性好的实验诊断方法,其试剂稳定、易保存,操作简便,结果判断客观等,已广泛应用在各领域的免疫学检验中。然而,在ELISA操作过程中,常会因试剂、样品及操作技术等可控因素而影响结果的判读。因此,在试验操作中,操作者必须熟练掌握其基本操作,严格进行试剂、样品的核查,以确保检查结果的准确性和可靠性。只有加强各个环节的质量控制才能充分发挥其方法学的优点,保证检测结果的可靠性。
3 ELISA测定中不确定度分量的确定与分析
ELISA的主要操作过程:样品准备(含溶液配制、稀释等操作))→ELISA检测(标准品校准、阴性对照、阳性对照、加样、温育、计时等)→酶标仪读数→结果计算。
根据操作流程,结合操作注意事项的分析,按照测量不确定度规范文件的要求及应用具体指南中的分析要点,分析ELISA测定中不确定度的分量,如图1所示。
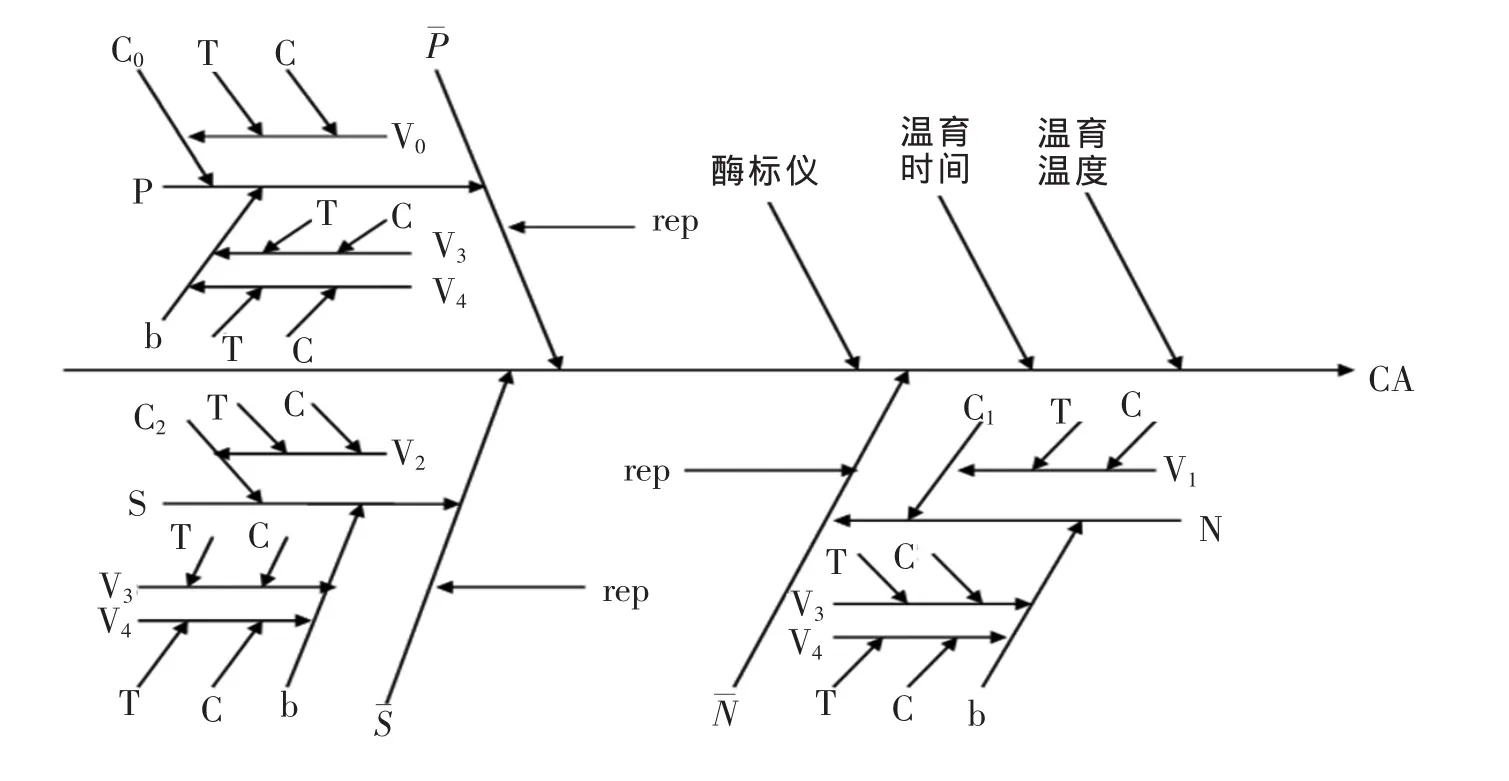
图1 不确定度分量的主要构成
ELISA测定中不确定度的来源主要由以下要素构成:
移液器(包括体积校准和温度校准)、酶标仪、温育温度、温育时间、重复性、阳性对照(包括吸光度值、平均值、体积及浓度)、阴性对照(包括吸光度值、平均值、体积及浓度)、样品(包括吸光度值、平均值及体积)、液层厚度、底物体积、终止液体积等。
根据《测量不确定度的要求》、《测量不确定度表示指南》、《测量不确定度要求的实施指南》、《检测和校准实验室能力的通用要求》、《测量不确定度评定与表示》等指导性文件的计算和统计要求[6-11],结合国内外的ELISA测量不确定度的分析方法,本文选取阳性对照吸光度值P进行分析,以期为ELISA检测不确定度的研究提供分析思路与方法[12-19]。
P是指在某个特定波长下的吸光度值,根据朗伯-比尔定律(A=εbc),吸光度值与吸光系数(ε),液层厚度(b)和阳性质控对照液浓度(C0)成正比。对于某一特定的显色反应来说,ε是个常数,因此P的不确定度主要由b和C0提供。
3.1液层厚度(b)
在ELISA试验中,吸收光从酶标板上方垂直通过液层,因此影响b的主要因素就是溶液层的最终体积,即100 μL底物溶液(V3)+100 μL终止液(V4)。由于在试验中使用的是同样的加样器,因此产生的不确定度是相同的,而影响加样器体积的不确定度主要因素是加样器的校准(C)和温度效应(T),它们都属于B类不确定度。
(1)C产生的不确定度u(C)
根据试剂盒说明书的要求,使用100 μL的加样器其准确度为±2%,按矩形分布处理,校准引入的标准不确定度为:u(C)=±2%/=1.15(μL);
(2)T产生的不确定度u(T)
容量器皿的校准在20℃下进行,假设实验室的温度为20℃±4℃,水的膨胀系数为2.1×10-4/℃,按矩形分布100 μL加样器由温度效应引入的标准不确定度为:u(T)=100×4×2.1×10-4=0.084(μL);
(3)V3引起的标准合成不确定度u(V3)
由于校准和温度效应是2个相互独立的分量,因此V3引起的标准合成不确定度u(V3)=
(4)V4所引起的标准合成不确定度u(V4)
同理由100 μL终止液(V4)所引起的标准合成不确定度u(V4)=u(V3)=1.153(μL);
因为u(V4)和u(V3)是两个相互独立的两个分量,所以b的标准合成不确定度分量u(b)=
需要说明的是b的影响需要辨证地看,因为溶液体积变化的同时也会使溶液浓度发生变化,即体积增大,厚度增大,吸光度增大;同时浓度减小,吸光度下降。为了降低风险,浓度的影响可忽略。
3.2阳性对照液浓度(C0)
C0取决于阳性对照液量(V0)的大小,因此取决于100 μL加样器的准确度。同3.1,影响加样器的体积不确定度的主要因素是C和T,它们都属于B类不确定度。
u(C)=1.15(μL);u(T)=0.084(μL);
因此,u(V0)=u(V3)=u(V4)=1.153(μL)。
因为影响C0的仅有V0一个分量,因此C0的标准不确定度u(C0)=u(V0)=1.153(μL)。
3.3合成P的不确定度
因为b和C0是2个相互独立的分量,又是相乘的关系,根据公式:
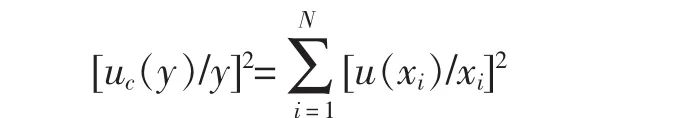
对于P进行n次平行测定,其结果如表1所示。

表1 阳性对照(P)的n次重复测定结果
那么P的合成标准不确定度u(P)计算如下:
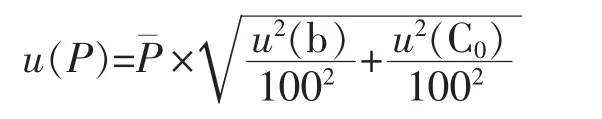
酶联免疫吸附试验过程复杂,涉及的不确定度的分量较多,每个分量都要根据自身特点进行分析与计算,形成合成不确定度。
4 结论
本研究结合具体的ELISA实际操作流程和关键环节,分析了ELISA检测中出现的主要问题及产生的原因,确定了ELISA检测过程中的不确定度分量。根据质量体系对测量不确定的要求,结合国内外的分析方法,选取阳性对照吸光度值P进行分析,以期为ELISA检测不确定度的研究提供分析思路与方法。
[1]Crowther J R.The ELISA Guidebook[M].PubMed Commons,2000.
[2]崔秀华.ELISA操作及常见问题分析[J].德州学院学报,[3]朱风辰.ELISA检测中常见问题的分析[J].职业与健康,2007,23(12):1004-1005.
2011,27(8):66-69.
[4]黄剑锋.ELISA抗体检测中常见问题及解决方法[J].畜禽业,2013,10:47.
[5]詹文辉.酶联免疫吸附试验中常见问题的产生原因及解决办法[J].福建畜牧兽医,2013,35(4):36-37.
[6]CNAS-CL07:2011测量不确定度的要求[S].
[7]ISO/IEC指南98-3测量不确定度表示指南[S].
[8]CNAS-GL05:2011测量不确定度要求的实施指南[S].
[9]GB/T15481-2000检测和校准实验室能力的通用要求[S].
[10]JJF1059-1999测量不确定度评定与表示[S].
[11]国家质量技术监督局计量司组.测量不确定度评定与表示指南[M].第一版.北京:中国计量出版社.
[12]S Populaire,E C Gimenez.A simplified approach to the estimation of analytical measurement uncertainty[J].Accred Qual Assur,2006,10:485-493.
[13]L Borg,J Kristiansen,J M Christensen,et al.Evaluation of accuracy and uncertainty of ELISA assays for the determination ofinterleukin-4,interleukin-5,interferon-γandtumor necrosis factor-α[J].Clin Chem Lab Med,2002,40(5):509-519.
[14]M Suchanek,P Robouch.Measurement uncertainty of test kit results-the ELISA example[J].Clin Chem Lab Med,2009,47(7):808-810.
[15]Y Hayashi,R Matsuda,T Maitani,et al.Precision,Limit of detection and range of quantitation in competitive ELISA[J]. Anal Chem,2004,76:1295-1301.
[16]JFToussaint,PAssam,BCaij,etal.Uncertaintyof measurement for competitive and indirect ELISAs[J].Rev sci tech off int Epiz,2007,26(3):649-656.
[17]王治国,王薇,李小鹏.测量不确定度及其在临床检验中应用[J].中国卫生统计,2005,22(2):85-86.
[18]赵春城,赵晓联,蔡正森,等.应用酶联免疫吸附法的实验不确定度分析[J].饲料研究,2004,11:31-33.
[19]卢利军,赵庆松,程秀吉,等.ELISA法检测人体血清中HIV-1+ 2型抗体结果不确定度评定[J].中国艾滋病性病,2004,10(6):407-409.
Analysis of Operational Consideration and Uncertainty of ELISA
Zhang Wei1,Fu Pubo1,Gao Hongwei2,Wei Haiyan1,Liang Xinmiao1,Liu Jianli1,Liu Laifu1*
(1.Beijing Entry-Exit Inspection and Quarantine Bureau,Beijing,100026;2.Shandong Entry-Exit Inspection and Quarantine Bureau)
Afteranalyzing thedetailedoperatingproceduresofELISAmethodssystematically,the operational considerations of ELISA are discussed.According to the requirements of normative documents ofmeasurementuncertainty,thecomponentsofELISAuncertaintypreliminarilybasedonthe consideration factors are analyzed.
ELISA;Operational Consideration;Uncertainty
R446.61
E-mail:zhangwei.cau@163.com;*通讯作者E-mail:liulf@bjciq.gov.cn
国家质检总局科技计划项目(2013IK306)
2015-06-09

