烟草环斑病毒抗体及DAS-ELISA试剂盒的研制
李桂芬 魏梅生 马洁 张永江
(中国检验检疫科学研究院 北京 100121)
烟草环斑病毒抗体及DAS-ELISA试剂盒的研制
李桂芬 魏梅生 马洁 张永江
(中国检验检疫科学研究院 北京 100121)
将纯化的烟草环斑病毒免疫家兔获得多克隆抗体;免疫BALB/c小鼠,用杂交瘤细胞技术获得1株分泌烟草环斑病毒单克隆抗体的杂交瘤细胞株并制备腹水抗体。以戊二醛为交联剂,采用两步法将烟草环斑病毒单克隆抗体用碱性磷酸酯酶标记,研制了烟草环斑病毒DAS-ELISA试剂盒。
烟草环斑病毒;多克隆抗体;单克隆抗体;DAS-ELISA试剂盒
1 前言
烟草环斑病毒(Tobacco ringspot virus,TRSV)是豇豆花叶病毒科线虫传多面体病毒属的代表种,是我国的进境检疫性有害生物。它可侵染54科300多种植物,自然寄主有豆类、瓜类、花卉、果树和烟草等重要的经济作物。TRSV侵染造成的损失非常严重,大豆产量损失50%以上,菜豆减产30%-50%,茄子可达55%-70%[1]。
TRSV可通过种子、嫁接、机械接种、媒介等多种途径传播,大豆种传率达到100%。此外,病毒还可通过种子和无性繁殖材料的贸易进行远距离传播,我国检疫部门多次从进境植物种子和无性繁殖材料中截获该病毒[2-7]。
TRSV的检测方法国内外研究较多,如斑点免疫金和免疫金/银染色法[8]、胶体金免疫层析法[9]、番茄环斑病毒和TRSV复合型胶体金免疫层析试纸条[10]、磁免疫层析试纸条[11]、一步法RT-PCR检测TRSV试剂盒[12]、巢式PCR[13]、RT-Realtime PCR[14]和ICRT-Realtime PCR检测方法[15]。在TRSV实际的检测工作中,由于酶联免疫方法快速、简单而被广泛应用。目前国内TRSV检测试剂盒主要依赖国外进口,本研究通过常规方法纯化TRSV,制备多克隆和单克隆抗体,采用碱性磷酸酯酶标记单克隆抗体方法,以期研制灵敏度高、特异性好的TRSV DAS-ELISA试剂盒。
2 材料与方法
2.1材料
2.1.1毒源
TRSV:从ATCC引进5株毒源,编号分别为PV-97、PV-98、PV-125、PV-157、PV-172,接种在白肋烟(Nicotiana tobacum cv.White Burley)上,放置在隔离温室中。
南芥菜花叶病毒(Arabis mosaic virus,ArMV):从ATCC引进,编号PV-192,接种在昆诺藜(Chenopodium quinoa)上,放置在隔离温室中。
番茄环斑病毒(Tomato ringspot virus,ToRSV):从ATCC引进,编号PV-239,接种在番杏(Tetragonia expansa)上,放置在隔离温室中。
番茄黑环病毒(Tomato black ring virus,TBRV):从DSMZ引进,编号PV-0070,接种在昆诺藜上,放置在隔离温室中。
2.1.2试剂
巯基乙醇:购自AMRESCO,化学纯;硼酸、四硼酸钠:均购自国药集团化学试剂有限公司,分析纯;Tritonx-100:购自Sigma,分析纯;PEG:日本进口,化学纯,MW6000;氯化钠:购自国药集团化学试剂有限公司,分析纯;乙二胺四乙酸二钠(EDTA):购自国药集团化学试剂有限公司,分析纯;蔗糖:购自AMRESCO,纯度≥99.9%。A蛋白柱、G蛋白柱:GE公司;碱性磷酸酯酶:Sigma公司,产品目录号为P6774-10KU;戊二醛:Alfa Aesar公司,产品目录号为:A17876。
2.1.3仪器设备
组织捣碎机:Waring;Avanti J-26XPI离心机、Optima L-100XP离心机:BECKMAN。
2.2方法
2.2.1病毒繁殖与纯化
将PV-125接种在白肋烟上,20 d采收病叶。200 g病叶加600 mL 0.5 mol/L硼酸盐缓冲液(pH 8.4,含0.2%巯基乙醇),用组织捣碎机匀浆,双层纱布过滤后离心(Avanti J-26XPI离心机,9605×g、10min),取上清缓慢加入Tritonx-100至1%,PEG至8%,氯化钠至3%;4℃搅拌3 h,静置1 h,离心(Avanti J-26XPI离心机,15008×g、30 min;沉淀悬浮于0.01 mol/L硼酸盐缓冲液(pH 8.4,含0.001 mol/L EDTA)中,4℃搅拌过夜后离心(Avanti J-26XPI离心机,9605×g、10 min);弃沉淀,上清离心(Optima L-100XP离心机,160070×g、210 min),沉淀悬浮于0.01 mol/L硼酸盐缓冲液(pH 8.4,含0.001 mol/L EDTA)中,4℃搅拌过夜后离心(Avanti J-26XPI离心机,2860×g、10 min);弃沉淀,上清经10%-40%蔗糖密度梯度离心(Optima L-100XP离心机,160070×g、160 min),吸取病毒带,即为病毒纯化制剂,测紫外。用免疫诱捕方法制作电镜片观察纯化病毒[16](用Agdia公司TRSV酶联检测试剂盒中的包被抗体稀释20倍后使用)。
2.2.2家兔免疫、多克隆抗体效价测定及纯化
用纯化的TRSV制剂免疫家兔,免疫方法见文献[17];效价测定采用间接ELISA方法,包被抗原为浓度4 μg/mL纯化的TRSV;用A蛋白柱进行抗体纯化。
2.2.3单克隆抗体制备及纯化
将纯化的TRSV制剂免疫8周龄的BALB/c小鼠,具体方法和TRSV纯化病毒用量参见文献[18];细胞融合、杂交瘤细胞的筛选和克隆化、腹水抗体的制备按常规方法[19];腹水抗体用G蛋白柱进行纯化。
2.2.4DAS-ELISA检测方法的建立
2.2.4.1碱性磷酸酯酶标记的TRSV单克隆抗体的制备
取100 μL碱性磷酸酯酶加入到300 μL的0.01M PBS(pH 7.2)中,再加入10 μL 25%的戊二醛混匀,室温(25℃)孵育活化1h,再加入0.5 mg TRSV单克隆抗体室温反应2 h,即获得碱性磷酸酯酶标记的TRSV单克隆抗体。
2.2.4.2DAS-ELISA检测方法的建立
TRSV多克隆抗体浓度和酶标单克隆抗体稀释度的确定:分别以TRSV多克隆抗体1 μg/mL、2 μg/ mL为包被抗体,与TRSV酶标单抗1∶250、1∶500、1∶1000稀释度组合成DAS-ELISA检测试剂盒,以确定最佳使用浓度。
2.2.4.3DAS-ELISA试剂盒检测灵敏度
将TRSV提纯病毒按一定浓度稀释以确定试剂盒检测提纯病毒灵敏度;将感染TRSV(PV-125)的白肋烟病叶做一定比例稀释以确定试剂盒检测病汁液的灵敏度。
2.2.4.4DAS-ELISA试剂盒的特异性
用DAS-ELISA试剂盒检测ArMV、TBRV、ToRSV以确定是否与上述病毒有交叉反应。
2.2.4.5DAS-ELISA试剂盒与ATCC毒源的反应
用DAS-ELISA试剂盒检测ATCC毒源PV-97、PV-98、PV-125、PV-157、PV-172。
2.2.4.5DAS-ELISA试剂盒的稳定性
试剂盒在4℃保存12个月后检测PV-97、PV-98、PV-125、PV-157、PV-172、PV-0070、PV-192、PV239。
3 结果与讨论
3.1结果
3.1.1病毒纯化
纯化的TRSV病毒经紫外测定,呈典型的核蛋白吸收曲线,OD260nm=12.337,OD280nm=6.933,OD260nm/ OD280nm=1.78(见图1);浓度1.23 mg/mL;透射电子显微镜下可见28 nm的球状病毒粒体(见图2)。
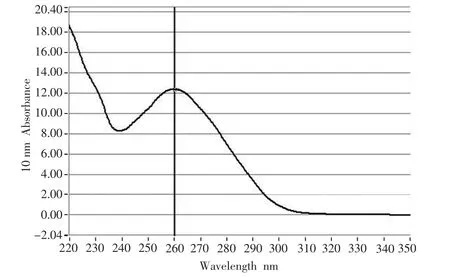
图1 纯化TRSV的紫外吸收曲线

图2 纯化TRSV球状病毒粒体
3.1.2多克隆抗体效价
TRSV兔多克隆抗体效价为1∶64000。
3.1.3杂交瘤细胞株及腹水效价
3次克隆化得到1株分泌TRSV单克隆抗体的杂交瘤细胞株2A9,腹水抗体效价为1∶106。
3.1.4DAS-ELISA检测方法的建立
3.1.4.1多抗包被浓度和酶标单抗稀释度的确定
酶联结果见表1(加入底物后60 min OD405nm值)。经比较,当多克隆抗体包被浓度2 μg/mL、单抗酶标稀释度为1∶500时,病汁液OD405nm值与健康汁液OD405nm值比值24,且健康汁液OD405nm值较低,因此包被浓度2 μg/mL、单抗酶标稀释度1∶500确定为试剂盒最佳组合浓度。
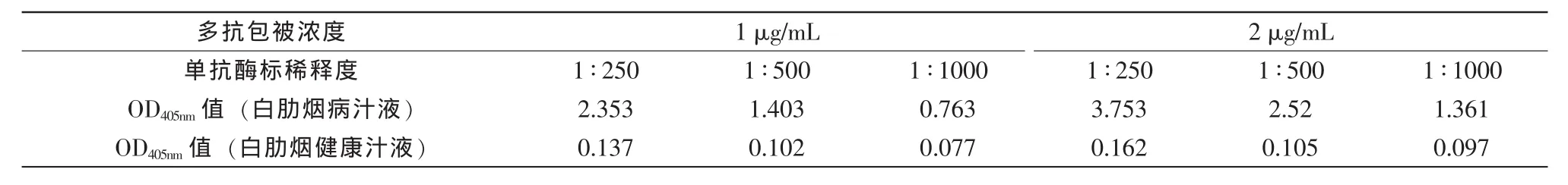
表1 DAS-ELISA试剂盒抗体浓度确定实验
3.1.4.2DAS-ELISA试剂盒灵敏度
检测纯化病毒灵敏度见图3。当纯化病毒为15.625 ng/mL时的OD405nm值与健康白肋烟OD405nm值比值大于2,为阳性反应,因此检测纯化病毒灵敏度为15.625 ng/mL。
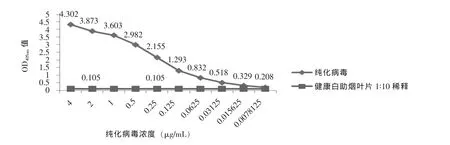
图3 DAS-ELISA试剂盒检测纯化病毒灵敏度
试剂盒检测病汁液灵敏度见图4。当TRSV白肋烟病汁液稀释倍数为1∶3200时的OD405nm值与健康白肋烟OD405nm值比值大于2,反应为阳性,因此检测白肋烟病汁液的灵敏度为病汁液1∶3200稀释。
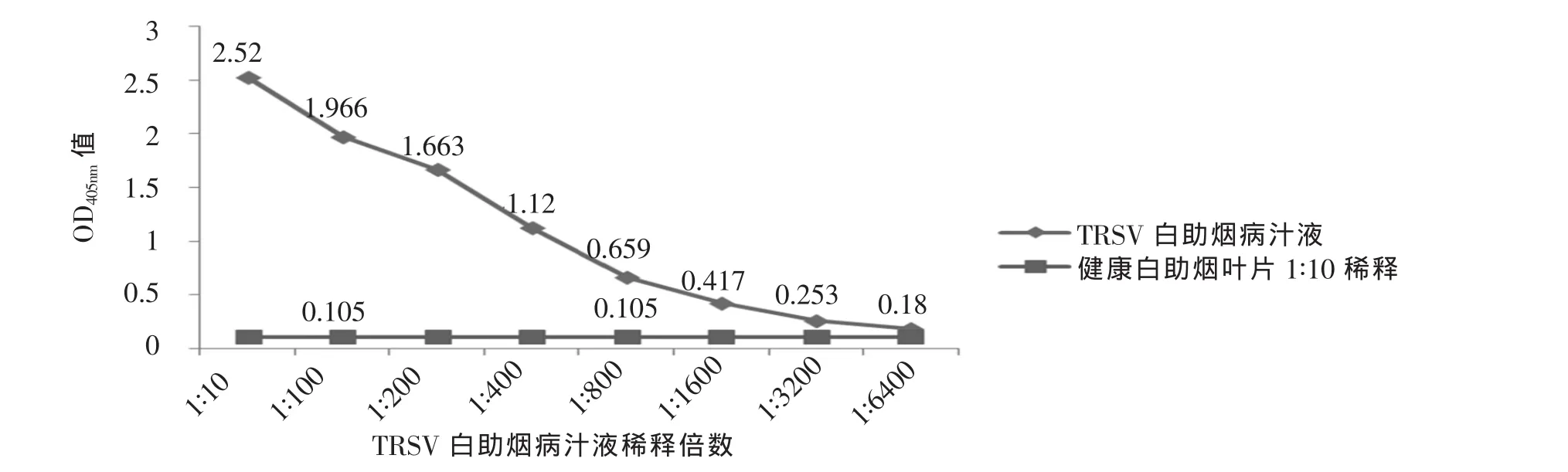
图4 DAS-ELISA试剂盒检测TRSV白肋烟病汁液灵敏度
3.1.4.3DAS-ELISA试剂盒特异性
TRSV试剂盒的特异性反应见表2,从表2可看出,ArMV、TBRV、ToRSV与试剂盒反应均为阴性,不发生交叉反应。

表2 试剂盒的特异性
3.1.4.4DAS-ELISA试剂盒与ATCC毒源的反应
试剂盒与ATCC TRSV毒源反应见表3,从表3可看出,试剂盒与5种毒源均呈强阳性反应。

表3 试剂盒与ATCC毒源的反应
3.1.4.5DAS-ELISA试剂盒的稳定性
试剂盒4℃保存12个月后与各病毒的反应见表4,从表4可看出,试剂盒与5个TRSV分离物均呈强阳性反应,与TBRV(PV-0070)、ArMV(PV-192)、ToRSV(PV-239)均呈阴性反应,试剂盒稳定性好。
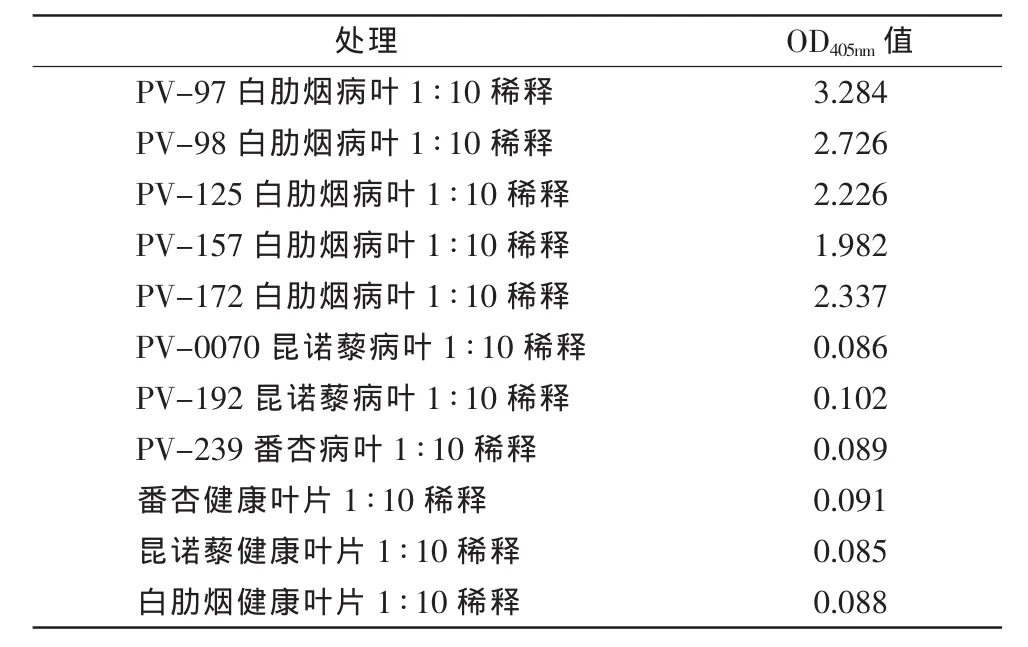
表4 试剂盒的稳定性
3.2讨论
在检测试剂盒研制的过程中,以TRSV多克隆抗体为包被抗体、单克隆抗体为检测抗体的三抗体夹心酶联(TAS-ELISA)方法,其本底较高,效果不好;以单克隆抗体为包被抗体、多克隆抗体为检测抗体的TAS-ELISA方法,其阳性样品的读数较低,容易出现假阴性。而把单克隆抗体用碱性磷酸酯酶标记的DAS-ELISA方法的本底低,阳性读数高,检测效果好。
4 结论
本研究用差速离心和蔗糖梯度离心方法得到了纯化的TRSV病毒粒体,然后用纯化病毒制剂免疫家兔和BALB/c小鼠制备了特异性好和效价高的多克隆和单克隆抗体,并研制了检测TRSV的DASELISA试剂盒。该试剂盒能检测浓度为15.625 ng/ mL纯化病毒和稀释3200倍的白肋烟病汁液,灵敏度高;与同属的ArMV、TBRV、ToRSV不发生交叉反应,本底低;与5种TRSV毒源均为强阳性反应。因此,该试剂盒可应用于TRSV实际检测中。
[1]黄江华,陈秀菊,彭仁,等.烟草环斑病毒研究进展[J].现代农业科学,2008,15(1):24-27.
[2]陈燕芳,胡伟贞,南景岳.侵染唐首蒲的烟草环斑病毒的研究[J].植物病理学报,1990,20(4):241-246.
[3]孔宝华,蔡红,陈海如,等.99世博会日本菊花检测出番茄环斑病毒、南芥菜花叶病毒和烟草环斑病毒[J].植保技术与推广,2000,20(2):33.
[4]李彬,吴翠萍,安榆林.江苏局从进口美国大豆中截获烟草环斑病毒[J].植物检疫,2009,19(6):379.
[5]魏春艳,王金丽,刘金华,等.吉林局从进口葵花种子中截获烟草环斑病毒[J].植物检疫,2007,21(1):41.
[6]文朝慧,刘箐,王军平,等.从荷兰进境的萝卜种子中截获烟草环斑病毒[J].植物检疫,2009,23(6):34.
[7]文朝慧,施颖波,庞博.甘肃局截获烟草环斑病毒[J].植物检疫,2010,24(6):62.
[8]魏梅生.斑点免疫金和免疫金/银染色法检测烟草环斑病毒[J].植物检疫,2000,14(1):1-2.
[9]魏梅生,李桂芬,张周军,等.胶体金免疫层析法快速检测烟草环斑病毒[J].2002,16(2):81-84.
[10]魏梅生,杨翠云,李桂芬.番茄环斑病毒和烟草环斑病毒复合型胶体金免疫层析试纸条的研制[J].植物检疫,2008,22(2):75-78.[11]魏梅生,李桂芬,马洁,等.烟草环斑病毒磁免疫层析试纸条的研制[J].植物检疫,2014,28(2):24-27.
[12]张永江,李明福,黄冲,等.一步法RT-PCR检测烟草环斑病毒试剂盒的研制与应用[J].安徽农业科学,2006,34(10):2072-2073.
[13]S Lee,G Lee,I C Choi,et al.Development of PCR Diagnostic System for Detection of the Seed-Transmitted Tobacco ringspot Virus in Quarantine[J].Indian Journal of Microbiology,2015,55(2):231-233.
[14]杨伟东,郑耘,陈枝楠,等.烟草环斑病毒RT-Realtime PCR检测方法[J].植物保护学报,2007,34(2):157-160.
[15]杨伟东,郑耘,章桂明,等.烟草环斑病毒IC-RT-Realtime PCR检测方法研究[J].中国病毒学,2006,21(3):277-280.
[16]SN/T 1840-2006植物病毒免疫电镜检测方法[S].
[17]李桂芬,马洁,陈红运,等.黄瓜绿斑驳花叶病毒多克隆抗体制备及检测应用[J].河南农业科学,2007,11:76-78.
[18]李桂芬,马洁,张永江,等.玉米褪绿斑驳病毒抗体及TASELISA试剂盒的研制[J].检验检疫学刊,2014,24(6):42-45.
[19]朱立平,陈学清.免疫学常用实验方法[M].北京:人民军医出版社,2000.
Preparation of Antibody against Tobacco ringspot virus and DAS-ELISA Kit
Li Guifen,Wei Meisheng,Ma Jie,Zhang Yongjiang
(Chinese Academy of Inspection and Quarantine,Beijing,100121)
The purified virus of TRSV was used to immunize rabbit and polyclonal antibody was produced.One hybridoma cell line secreting monoclonal antibody against TRSV was produced by hybridoma technology.Alkaline phosphatase was conjugated with the monoclonal antibody by bifunctional linker glutaraldehyde,DAS-ELISA kit were produced.
Tobacco ringspot virus;Polyclonal Antibody;Monoclonal Antibody;DAS-ELISA Kit
S435.72
E-mail:liguifen2002@163.com
质检公益性行业科研专项(201310071)
2015-03-16

