纯化水微生物限度检查方法优选
北京北大维信生物科技有限公司(100094)金宝华 姜琳 张丽梅 马威
水在制药工业中是应用最广泛的工艺原料,用做药品的成分、溶剂、稀释剂等。水是良好的溶剂、尤其是与自然界失去平衡的纯化水和注射用水,具有极强的溶解能力和极少的杂质,广泛用于制药设备和系统的清洗[1]。鉴于水在制药工业中既作为原料又作为清洗剂,各国药典对制药用水的质量标准,都有明确的定义和要求;当前中国药典(2010年版)、美国药典(USP36-NF30)及欧洲药典(7.0)中纯化水微生物限度检查方法均为薄膜过滤法,但是所用培养基、培养条件(温度、时间)不同。为指导我厂在纯化水日常监测及验证微生物限度检查法的选择,对检查方法进行优选验证。
1 验证项目
根据本验证的三个主要目的,制定验证项目,见附表1。

附表1 验证项目表
2 验证前准备
①人员培训 质量管理部组织了验证方案的培训;受训人掌握了方案内容;培训有记录。 ②验证用工具及仪器设备 验证用工具均清洁和灭菌。验证用主要仪器、设备、仪表均经过校验或验证,并在有效期内。③验证用培养基 按验证方案中各方法要求制备所需培养基,培养基干粉均来自合格供应商并在有效期,且已经过计数培养基的适用性检查合格。详见附表2。④验证用菌液制备 按方案中方法要求制备所需阳性菌液,详见附表3。⑤验证用纯化水取样 按我厂《制药用水取样操作程序》进行供试品的取样。

附表2 验证用培养基列表

附表3 验证用菌液表
3 验证过程
3.1 美国药典、中国药典与欧洲药典纯化水微生物检查方法 美国药典、欧洲药典与中国药典纯化水微生物限度检查方法均为薄膜过滤法,但是在培养基、培养温度及培养时间方面有所区别,具体见附表4。

附表4 美国药典、中国药典与欧洲药典纯化水微生物限度检查方法对比
3.2 验证的操作环境
3.2.1 三方药典检查方法分析、最优的检查方法计数方法的验证在独立的阳性洁净区域的生物安全柜内进行操作。
3.2.2 中国药典与经验证的最优纯化水微生物计数方法间差异分析实验在10000级洁净区域内100级超净工作台内进行。
3.3 验证实施及结果
3.3.1 美国药典、中国药典与欧洲药典纯化水微生物检查方法差异分析
3.3.1.1 三方药典纯化水微生物限度检查方法差异分析概述 根据本文附表 4,美国药典、中国药典与欧洲药典纯化水微生物检查方法的区别主要包括培养基种类、培养温度和培养时间,概括起来有5种不同条件。为考察此5种纯化水微生物检查方法实际检查能力之间的关系,拟使用常见微生物的典型菌株(附表 3)分别按检查方法的5 种不同条件进行检查,使用单因子方差分析的方法考察5种不同条件对各类微生物典型菌株检查能力之间是否存在显著性差异。
以纯化水微生物检查方法为因子(使用字母 A 表示),使用不同检查方法(不同的因子水平,见附表5)获得的微生物计数结果。

附表5 因子水平(Ai)与检查方法对应关系

附表6 大肠埃希菌检测结果列表
3.3.1.2 分析方法 方差分析(ANOVA):又称变异数分析或F检验,其目的是推断两组或多组资料的总体均数是否相同,检验两个或多个样本均数的差异是否有统计学意义。包括单因素方差分析即完全随机设计或成组设计的方差分析和多因素方差分析。
Tukey多重比较:对检验数据使用方差分析评估统计差异外,还使用Tukey多重比较的实际差异性。Tukey多重比较指对于各种不同的比较样本,给出联合置信区间的方法,对不具有共同置信区间的样本(组)进行判异。Tukey多重比较可以具体找出哪个单位测试数据超出了联合置信区间。通常当且仅当置信区间中不包含零时,才会否定均值之间无差异的原假设。检测数据的差异性用“分组”表示,分组中不共享字母的因子的检测数据之间具有显著差异。
3.3.1.3 验证数据 按3.3.1.1获得的微生物计数结果服从正态分布,检查结果之间相互独立,其方差相等。通过方差分析考察不同方法对各类常见微生物典型菌株的检查结果之间是否存在显著性差异,进而判断检查方法之间是否存在显著性差异。通过Tukey多重比较列表筛选无差异且检出率较高的水平。以下各组均使用方差分析、Tukey多重比较2种方法评估差异性。
①革兰氏阴性菌(大肠埃希菌,铜绿假单胞菌)检测结果方差分析:革兰氏阴性菌—大肠埃希菌检测结果方差分析(见附表6、7)。在显著性水平(α=0.05)上,P<0.05,大肠埃希菌的5种检验方法有差异。再用Tukey 多重比较法进一步分析。使用 Tukey 方法和 95% 置信度对信息进行分组(见附表8)。检测数据的差异性用“分组”表示,分组中不共享字母的因子的检测数据之间具有显著差异。
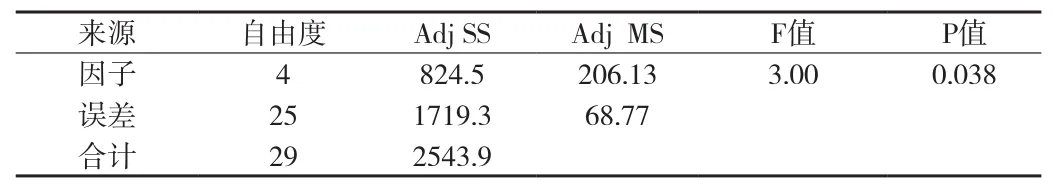
附表7 大肠埃希菌检测结果方差分析表

附表8 大肠埃希菌检测结果Tukey 多重比较
②革兰氏阴性菌—铜绿假单胞菌检测结果方差分析(见附表9、10)。在显著性水平(α=0.05)上,P <0.05,铜绿假单胞菌的5种检验方法有差异。再用Tukey多重比较法进一步分析。使用 Tukey 方法和 95% 置信度对信息进行分组(见附表11)。检测数据的差异性用“分组”表示,分组中不共享字母的因子的检测数据之间具有显著差异。

附表9 铜绿假单胞菌检测结果列表

附表10 铜绿假单胞菌检测结果方差分析表

附表11 铜绿假单胞菌检测结果Tukey 多重比较
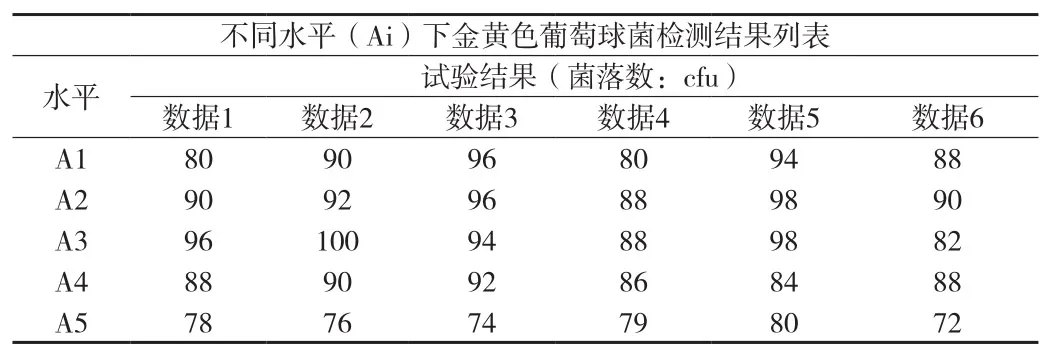
附表12 金黄色葡萄球菌检测结果列表
③革兰氏阳性菌(金黄色葡萄球菌)检测结果方差分析(见附表12、13)。在显著性水平(α=0.05)上,P<0.05,金黄色葡萄球菌的5种检验方法有差异。再用Tukey多重比较法进一步分析。使用 Tukey 方法和 95% 置信度对信息进行分组(见附表14)。检测数据的差异性用“分组”表示,分组中不共享字母的因子的检测数据之间具有显著差异。

附表13 黄色葡萄球菌检测结果方差分析表

附表14 黄色葡萄球菌检测结果Tukey 多重比较
④芽孢菌(枯草芽孢杆菌)检测结果方差分析(见附表15、16)。在显著性水平(α=0.05)上,P<0.05,枯草芽孢杆菌的5种检验方法有差异。再用Tukey多重比较法进一步分析。使用 Tukey 方法和 95% 置信度对信息进行分组(见附表17)。
检测数据的差异性用“分组”表示,分组中不共享字母的因子的检测数据之间具有显著差异。
⑤酵母菌(白色念珠菌)检测结果方差分析(见附表18、19)。在显著性水平(α=0.05)上,P>0.05,白色念珠菌的5种检验方法无差异。再用Tukey 多重比较法进一步分析。使用 Tukey 方法和 95%置信度对信息进行分组(见附表20)。

附表15 枯草芽孢杆菌检测结果列表
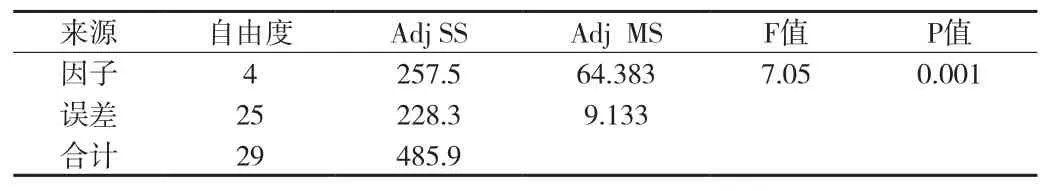
附表16 枯草芽孢杆菌检测结果方差分析表

附表17 枯草芽孢杆菌检测结果Tukey 多重比较

附表18 白色念珠菌检测结果列表
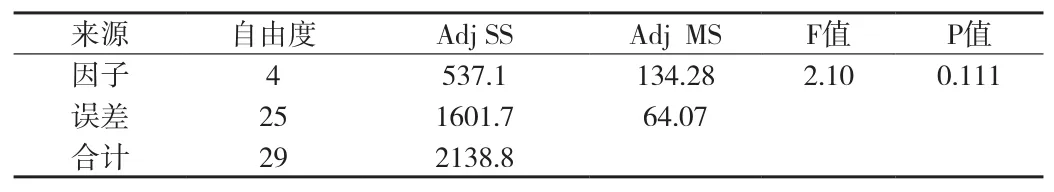
附表19 白色念珠菌检测结果方差分析表

附表20 白色念珠菌检测结果Tukey 多重比较
检测数据的差异性用“分组”表示,分组中不共享字母的因子的检测数据之间具有显著差异。
⑥霉菌(黑曲霉)检测结果方差分析(见附表21、22)。在显著性水平(α=0.05)上,P>0.05,黑曲霉菌的5种检验方法无差异。也可再用Tukey 多重比较法进一步分析。使用 Tukey 方法和 95%置信度对信息进行分组(见附表23)。
检测数据的差异性用“分组”表示,分组中不共享字母的因子的检测数据之间具有显著差异。
3.3.1.5验证结论 在显著性水平(α=0.5)上对不同水平检验结果进行方差分析,白色念珠菌、黑曲霉菌在A1~ A5水平不存在差异,其他4株(大肠埃希菌、铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌)均存在差异。
再使用Tukey多重比较法比较各水平的相互差异,列表筛选无差异且检出率较高的水平见(见附表24)。
3.3.2 最优纯化水微生物限度检查方法计数方法的验证。
QC于2014年6月19日、20日、22日,以C0041001 点(我厂纯化水点编号,下同)纯化水作为供试品,使用6种典型代表菌株,分别进行3次独立平行试验。
3.3.2.1 验证方法试验组:无菌操作,取10ml纯化水样品,加至已装有100mlpH7.0 的无菌氯化钠-蛋白胨缓冲液的薄膜过滤器内, 再加入1ml含菌数50~100cfu/mL的菌液,过滤,滤干后取出滤膜菌面朝上贴于R2A琼脂平板上。于30℃~35℃培养120小时,计数。
菌液组:分别取铜绿假单孢菌、金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、白色念珠菌、黑曲霉验证用菌液各1ml,加入含100mlpH7.0 的无菌氯化钠-蛋白胨缓冲液至滤器内,过滤,滤干后取出滤膜菌面朝上贴于R2A琼脂平板上。于30℃~35℃培养120小时,计数。
供试品对照组:无菌操作,取10ml纯化水样品,加至已装有100mlpH7.0 的无菌氯化钠-蛋白胨缓冲液的薄膜过滤器内,过滤,滤干后取出滤膜菌面朝上贴于R2A琼脂平板上。于30℃~35℃培养120小时,计数。
稀释剂对照组:使用 pH7.0的无菌氯化钠-蛋白胨缓冲液代替试验组中的纯化水样品按试验组操作进行检查计数。
回收率计算结果见附表25。
3.3.2.2 结果 计算公式见附图;计算结果见附表26。
3.3.2.3 结论 在纯化水微生物限度检查最优检查法(欧洲药典方法)的验证试验中,6种试验菌株的回收率均达到70%以上,证实该方法适用于纯化水的微生物限度检查。
3.3.3 中国药典与经验证的最优纯化水微生物计数方法间检测结果差异分析 QC于2014年6月30日至7月11日, 连续10个工作日同时使用最优检测方法(欧洲药典方法)与中国药典检测方法对纯化水系统的送水口(C0041002 )实施同步持续检测,获取 10 组检测数据,对检测数据进行统计分析,评估。
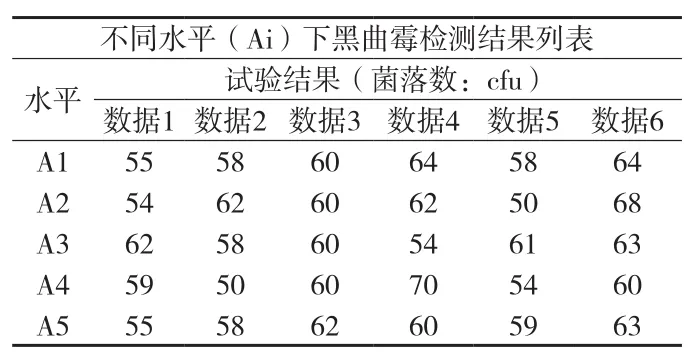
附表21 黑曲霉检测结果列表

附表22 黑曲霉检测结果方差分析表
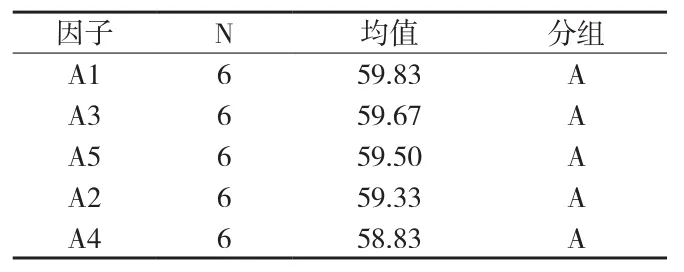
附表23 黑曲霉检测结果Tukey 多重比较

附表24 检测方法的Tukey 多重比较法优选表

附表25 计数方法验证的回收率列表

附表26 中国药典方法、欧洲药典方法检验结果列表

附表27 中国药典方法、欧洲药典方法检验结果方差分析表

附图 计算公式
3.3.3.1 验证方法 无菌操作,取10ml纯化水样品,加至已装有100mlpH7.0 的无菌氯化钠-蛋白胨缓冲液的薄膜过滤器内,过滤,滤干后取滤膜贴于适当的琼脂平板上,培养,检查计数。
3.3.3.2 结果 使用单因子方差分析,不同检测方法为不同水平,设:B1——经验证的中国药典方法,B2——经验证的最优检测方法(欧洲药典方法),根据实验数据,计算 F 比。比较2种方法的差异水平。2种方法的10次检验结果见附表26;方差分析结果见附表27。
3.3.3.3 结论 验证结果表明,在显著性水平α = 0.05上,P>0.05,2种检验方法无差异。
4 验证总结论
4.1 通过在显著性水平(α=0.5)上对不同水平检验结果进行方差分析,再使用Tukey 配对比较法比较各水平的相互差异,列表筛选无差异且检出率较高的水平为欧洲药典方法。
4.2 对选出的最优纯化水微生物限度检查方法(欧洲药典方法)进行计数方法验证,6种试验菌株的回收率均达到70%以上,证实该方法适用于纯化水的微生物限度检查。
4.3 通过对最优纯化水微生物限度检查方法(欧洲药典方法)与现行经验证的中国药典方法的比较分析,证实2种检验方法无统计学差异。
对优选的方法是否可替代我公司正在使用并经过计数方法验证的中国药典方法,还需按照《中华人民共和国药典(2010年版)》第一部 附录XVIII E药品微生物检验替代方法验证指导原则 “样品中微生物定量检验方法的验证”进行进一步验证。

