人工饲养中华蜜蜂幼虫及其成蜂形态特征分析
杨明华* 贺兴江* 李永能 匡海鸥 刘鸿源 和绍禹* 李亚辉*
(1云南农业大学云南省动物营养与饲料重点实验室,昆明650201;2云南农业大学动物科学技术学院,昆明650201;3云南农业大学招生就业处,昆明650201;4云南农业大学食品科学技术学院,昆明650201)
人工饲养中华蜜蜂幼虫及其成蜂形态特征分析
杨明华1,2*贺兴江2*李永能3匡海鸥4刘鸿源4和绍禹4*李亚辉4*
(1云南农业大学云南省动物营养与饲料重点实验室,昆明650201;2云南农业大学动物科学技术学院,昆明650201;3云南农业大学招生就业处,昆明650201;4云南农业大学食品科学技术学院,昆明650201)
蜜蜂因所具有的独特特点而被广泛应用于众多科学研究领域,蜜蜂基因组测序的完成更加速了其作为模式生物的进程。实验室人工饲养蜜蜂幼虫技术体系的建立,是蜜蜂作为模式生物研究的基础和保证。目前,有关蜜蜂幼虫人工饲养的研究多见于西方蜜蜂,东方蜜蜂生活环境和营养需求与西方蜜蜂有所不同,实验室人工饲养东方蜜蜂幼虫的难度较大,不同实验室的研究结果存在着很大差异。对人工饲养幼虫培育出的东方蜜蜂成蜂形态特征的分析目前尚未见报道。本研究的开展,不仅可以建立东方蜜蜂幼虫的人工饲养技术体系,且对进行东方蜜蜂幼虫营养需要、生长发育、形态特征形成等方面的研究也具有重要意义。本文以中华蜜蜂(Apis cerana cerana)1~2日龄幼虫为实验材料,在室内人工气候箱中用人工饲料进行饲养,直至化蛹羽化,对羽化后的蜜蜂进行体重及形态特征测定,并将其与自然羽化的蜜蜂进行比较分析。结果显示:在人工饲养条件下,中华蜜蜂幼虫可以正常发育、羽化为成蜂,其存活率和羽化率分别是55.56%和40.63%;主成分分析、区辨分析、聚类分析表明,人工饲养与自然羽化的工蜂形态特征无显著差异,但人工饲养的中蜂幼虫羽化后的工蜂体重显著低于自然羽化的工蜂。本文阐明了人工饲养中华蜜蜂幼虫的基本条件,为东方蜜蜂幼虫人工饲养技术体系的建立奠定了坚实基础。
中华蜜蜂;幼虫;人工饲养;形态特征
蜜蜂是典型的真社会性昆虫,具有明确而细致的劳动分工,群内有专职的哺育蜂饲喂幼虫,进行过人工操作的幼虫往往会被蜜蜂遗弃[1],从而造成人为干预下对蜜蜂幼虫研究的困难。
人工饲养蜜蜂幼虫技术在实验室内人工气候箱中进行,它可人为控制幼虫食物成分,排除哺育蜂的影响。进而许多研究都可得到直接明确的结果,该技术的成功应用将为蜜蜂作为模式昆虫研究奠定基础[2,3]。
早在20世纪30年代,研究者就陆续开展了人工饲养蜜蜂幼虫试验。Rhein[4]用新鲜蜂王浆进行幼虫的室内人工饲养,发现羽化的成蜂只能发育为工蜂。后人重复了其试验并认为可能有二个原因:其一是使幼虫分化发育为蜂王的某些物质是通过哺育蜂直接分泌给幼虫而不是由幼虫从蜂王浆中取食得到的;另一个原因是蜂王浆中含有这种促分化物质但其在王浆储存过程中极易失活。为探明这一问题,Weaver[5]采用每隔2 h收取新鲜蜂王浆饲喂蜜蜂幼虫的方法,发现培育出的蜜蜂无论在外形、个体大小,还是卵巢管数等方面都类似蜂王;Jay[6]则在移虫24、38、48和72 h后取浆来饲喂幼虫,结果表明尽管羽化率很低,移虫后48 h生产的蜂王浆培育出的成蜂都为蜂王。
在蜂群中,蜂王和工蜂都是由遗传组成完全一样的受精卵发育而来的雌性蜂,但由于它们所接受的食物不同,致使其发育成为外部形态、内部结构以及群体职能都有巨大差异的不同个体,蜂王在整个幼虫期都被饲以蜂王浆,而工蜂幼虫仅在3日龄前食用蜂王浆,3日龄以后它们的食物变成以蜂蜜、花粉为主要成分的工蜂浆[7,8]。1984年,Brouwers[9]的研究表明蜂王幼虫食物中糖类的比例明显高于工蜂幼虫的,对此,他们的解释为:糖类物质可能通过刺激幼虫取食而使其中肠更为伸展,进而激发外围中肠伸展受体将信号传至大脑,刺激咽侧体合成、释放更多的保幼激素,高水平的保幼激素支持蜜蜂发育为蜂王。这些研究无疑为蜜蜂幼虫人工饲料的研发提供了科学依据。1988年以后,研究人员不断改进幼虫饲养技术,获得较高的羽化率,成功建立了人工饲养西方蜜蜂幼虫技术[10,15]。
目前,人工饲养西方蜜蜂幼虫技术已趋成熟,但对我国特有的蜂种——中华蜜蜂(Apis cerana cerana)人工饲养幼虫的研究较少,中华蜜蜂幼虫人工饲养技术仍未真正建立。据陈裕文[16]等的报道,中华蜜蜂幼虫人工饲养羽化率很低,仅为0~4.9%。王倩[17]等从中华蜜蜂幼虫饲料配方、饲养模式等方面进行研究,使化蛹率及羽化率分别提高至82.6%、72.9%,然而,人工饲养的蜜蜂幼虫能否发育为形态正常的个体仍不可知,针对来自人工饲养幼虫的中华蜜蜂成蜂所进行形态特征分析也未见报道。因此,开展此类研究不仅有助于丰富人工饲养蜜蜂幼虫的内容,建立稳定可靠的东方蜜蜂幼虫人工饲养技术体系,而且对进行中蜂幼虫营养需要、生长发育、形态特征形成等方面的研究也具有重要的意义。
1 材料与方法
1.1材料
本实验所用东方蜜蜂样本取自云南农业大学东方蜜蜂研究所实验蜂场。
1.2方法
1.2.1蜜蜂幼虫培育:通过隔王处理得到日龄一致(1.5~2.0日龄)的幼虫,提出巢脾,用移虫针将适龄幼虫转移到加有食物的培养板内,每孔一只,将培养板放入人工气候箱中培养,每天定时饲喂并观察幼虫发育情况。至幼虫出现尿酸结晶排泄物时,将其转移至化蛹板,每孔一只,化蛹板置于人工气候箱中,此后不再移动虫体,观察幼虫在孔中完成排便吐丝、化蛹和羽化的过程。
1.2.2羽化蜜蜂的收集:取出羽化出房的蜜蜂并从蜂箱中采集同一天自然羽化的工蜂(15只),用电子天平称重,记录数据,然后将每一组蜜蜂分别放进盛有75%乙醇溶液的试管中浸泡备用。
1.2.3形态测定:取人工培育及自然羽化的中华蜜蜂每组各15只,用于形态测定。形态测定特征参照1988年Ruttner[18]1988年提出的测定标准进行。每只蜜蜂共测定28个特征(表1)。
形态测定样本的制作参照谭垦[19]等报道的方法进行。首先,用透明胶带固定重叠在一起的两片载玻片,将载玻片展开放于垫有白纸的操作台上。然后挑选15只完好的蜜蜂个体放入蜡盘(其中盛有75%的酒精溶液,尽可能地让酒精淹没蜜蜂的第六腹板)。将15只蜜蜂的右前翅和右后翅剥下,依次放在展开的一片载玻片上,用另一块载玻片压平,然后用透明胶带固定载玻片的另一侧,蜜蜂前后翅的玻片即制作完毕。

表1 测定蜜蜂的28个形态特征
将15只蜜蜂右后足从躯干分离,依次粘附在透明胶带上,之后用透明胶片固定做成右后足的胶片。
将蜜蜂的第二、三、四背板从其腹部剥离后,依次粘附在操作台上的透明胶带上,然后用透明胶片固定,做成第二、三、四背板的胶片。第三腹板和第六腹板剥下后用品红染色,漂净后按上述方法做成第三、六腹板的玻片(如图1)

图1 蜜蜂玻片和胶片
1.2.4形态特征测定:测量每个特征之前,用校正尺对形态测定仪上的刻度进行校正,将做好的玻片和胶片在形态测定仪下摄取图像并分类存储(包括前翅、后足、第三、四背板、第三、六腹板),然后提取图像利用形态测定仪中Bee2程序1.11版本对各个特征进行测量,且在连续变倍体显微镜下直接数出后翅翅钩数,完成表1中述及的28个形态特征测定。
1.3数据分析
将由Bee2软件生成的不同样点样本的各种形态测量数据的平均值以EXCEL格式输出,然后转换成SPSS格式。用SPSS软件17.0版本对所有数据进行主成分分析、因素分析和聚类分析。
2 结果与分析
2.1幼虫人工饲养结果
试验结果表明,三次实验的平均成活率和羽化率分别为55.56%和40.63%。见表2。
图2中人工培育和自然羽化蜜蜂的平均体重分别为80.8±4.94和86.62±8.63。
采用独立样本T检验:人工羽化工蜂的体重较自然羽化工蜂的体重小且差异显著(P<0.05)。
2.2形态分析实验结果
2.2.1主成分分析:将人工培养蜜蜂与自然羽化工蜂形态数据进行主成分分析(PCA),提出了三个特征值高的因素。因素1包括了数据里40.427%的变异,这些变异特征有前胫节长,翅脉角D7,第三背板长、宽,翅长,翅脉角L13,第六腹板宽、翅脉角,跗节宽,翅脉角J16,第三腹板长,翅脉角A4,翅脉角b,翅脉角B4,翅脉角,翅沟数。因素2包括了数据里26.281%的变异,这些变异特征有:第三腹板蜡镜间距、翅脉角a﹑第三腹板上的宽。因素3包括了数据里16.882%的变异,这些变异特征有翅脉角26,跗节长,第三腹板蜡镜长,翅脉角Q18,翅脉角K19,翅脉角23,第六腹板长、宽。以上3个因素包括了83.590%的数据变异。其中因素1和因素3主要与体型大小及相关(见表3)。

表2 幼虫成活率和羽化率
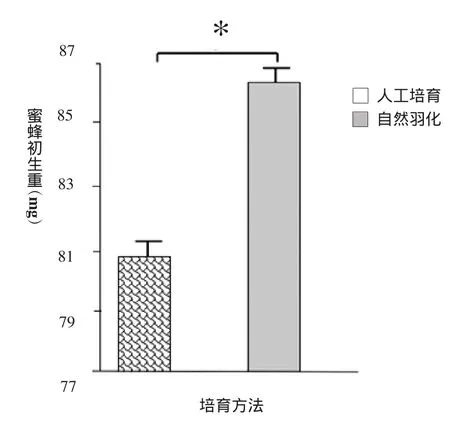
图2 人工培育与自然羽化工蜂体重比较(*表示P<0.05)
2.2.2区辨分析:
进行区辨分析结果表明:即使6组蜜蜂在图中不是很聚集,但人工培育的蜜蜂与自然羽化的蜜蜂并未成为两个不同的类群。

图3 自然与人工羽化蜜蜂的因素1-因素2分析图
从图3可以得出自然羽化蜜蜂因素1和因素2要比人工羽化蜜蜂的要高。由于因素1、2主要与体型相关,说明自然羽化工蜂的个体较其人工羽化蜜蜂的大。
2.2.3聚类分析:将人工羽化和自然羽化工蜂6组数据一起进行聚类分析(见图4),结果表明:Label Num虽在4~6左右变动,但没有明显数据显示有2个不同的蜜蜂种群,说明自然羽化和人工羽化的蜜蜂其形态特征并无显著差异。

图4 聚类分析图
3 讨论
在本研究中,人工饲养中蜂幼虫的羽化率为40.63%,远远高于陈裕文[16]等所报道4.9%的羽化率(陈裕文,2002),但与王倩等报道的89.8%的研究结果相比则低了很多。本文的培育方法与王倩他们的基本相同,羽化率差别却如此之大,原因尚需进一步探讨。这一切均说明人工饲养中蜂幼虫的基本条件仍未明确,饲养技术有待提高。在进行本研究的过程中,我们同时进行了意大利蜜蜂(简称意蜂)幼虫人工饲养实验,成蜂羽化率可达75%以上(数据未在此提供),与国外的现有研究水平相当[10,15],与西方蜜蜂幼虫人工饲养相比,中蜂幼虫羽化率相对较低,究其原因,可能与饲粮中的意蜂蜂王浆有关,它表明意蜂蜂王浆不能较好地支持中蜂幼虫的发育,并非是最适于中蜂幼虫发育的食物来源,陈裕文[20]等的研究也证明了这一点。
我们的前期研究发现,来自不同蜂群的幼虫人工培育时,其幼虫羽化率相差很大,说明移虫所用蜂群的种质特性可能与人工饲养蜜蜂幼虫的羽化率有着直接的关系;此外,由于蜜蜂幼虫在人工饲养过程中其虫体要被多次移动,移动对幼虫造成的机械损伤会引起幼虫死亡,实验中羽化率不高可能也与移植幼虫的操作有关。

表3 人工羽化与自然羽化蜜蜂形态分析结果
本文选择意蜂蜂王浆作为幼虫食物的基本成分,主要是因为中蜂的蜂王浆产量很低,难以收集,而意蜂的蜂王浆产量高且容易得到,且意蜂蜂王浆饲养中蜂幼虫的成活率、羽化率等都很低。鉴于影响幼虫存活率的因素颇多,而中蜂蜂王浆很难获得,为了增加幼虫饲养体系的可控性,建立相对简单、易行的中蜂幼虫饲养技术体系,进一步探讨意蜂蜂王浆对中蜂幼虫生长发育的影响,本实验进行了利用意蜂蜂王浆饲养中蜂幼虫的探索。
实验中,添加日粮后培养板34℃5分钟的预温,能让幼虫适应培养盘内的环境,防止较低温度的BLD引起的幼虫死亡对实验结果造成影响。
本实验不区分蜜蜂幼虫将来发育的级型而采用统一的日粮,幼虫的存活率不很理想。部分幼虫排便期和羽化期的稍有延迟可能与此有关。后续研究可以设计中蜂各个级型的幼虫食物,针对中蜂幼虫的营养需要做更深入的探索。
本论文通过对人工饲养与自然羽化的中华蜜蜂工蜂28个形态特征的测定分析,发现人工培育和自然羽化的蜜蜂其形态特征无显著差异,证明人工培育的蜜蜂可用于相关蜜蜂科学的研究。
致谢
本研究中蜜蜂形态测定得到云南农业大学食品科学技术学院东方蜜蜂研究所谭垦教授和曲玉凤的大力支持和帮助,特表谢忱。
[1]Tamar Katzav-Gozansky,Victoria Soroker,Josef Kamer et al.Ultrastructural and chemical characterization of egg surface of honeybee worker and queen-laid eggs[J].Chemoecology,2003,13:129-134.
[2]刘光楠,曾志将.人工饲养蜜蜂幼虫技术的进展[J].蜜蜂杂志,2010,29(8):32-34.
[3]郑火青,胡福良.蜜蜂--新兴的模式生物[J].昆虫学报,2009,52(2):210-215.
[4]Rhein W.ber die Entstehung des weiblichen Dimorphismus im Bienenstaate[J].Developmentgenes and Evolution,1933,129(4):601-665.
[5]Weaver N,1955.Rearing of honeybee larvae on royal jelly in the laboratory.Science,121(3145):509-510.
[6]Jay SC.Starvation studies of larval honey bees[J].Canadian Journal of Zoology,1964,42(3):455-462.
[7]王倩.室内人工饲养中华蜜蜂技术及卵显微注射ECFP基因的研究[D].济南:山东农业大学,2008.5-6
[8]Winston ML.The biology of the honey bee[M].London:Harvard University Press.1991,28-41.
[9]Brouwers EVM.Glucose/fructose ratio in the food of honeybee larvae during cast differentiation[J].Journal of Apicultural Research,1984,23:94-101.
[10]Vandenberg JD and Shimanuki H.Technique for rearing worker honeybees in the laboratory[J].Journal of Apicultural Research,1987,26:90-97.
[11]Asencot M,Lensky Y.The effect of soluble sugars in stored royal jelly on the differentiation offemale honeybee(Apis mellifera.)larvae to queens[J].Insect Biochem.1988,18(2):127-133.
[12]Czoppelt C,Rembold H.Effect of parathion on honeybee larvae reared invitro[J].Apiodologie,1988,61(5):95-100.
[13]Peng CYS,Mussen E,Fong A,et al.Effect of chlortetraeycline of honeybee worker reared in vitro[J].Invertebr Pathol,1992,60:127-133.
[14]AmdamgV,Hagena A,Omholta SW.A new method for rearinggenetically manipulatedHoneybee workers[J].Anne Lene T.O. AASEa,INRA/DIB-AGIB/EDP Sciences,Apidologie,2005,36:293-299.
[15]Aupinel P,Fortini D,Dufour H,et al.Improvement of artficial feeding in a standard in vitro method for rearing Apis mellifera larvae[J].Bulletin of Insectology,2005,58(2):107-111
[16]陈裕文,王重雄,何铠光.以人工饲育蜜蜂幼虫法评估羟四环素的药效[J].台湾昆虫,2002,22:53-64.
[17]王倩,孙亮先,肖培新,等.室内人工培育中华蜜蜂幼虫技术研究[J].山东农业科学,2009,(11):113-116.
[18]Ruttner,F.Biogeography and Taxonomy of Honeybees[M]. Springer Verlag:Berlin,Heidelberg.New York,1988.282pp.
[19]谭垦,张炫,和绍禹,等.云南东方蜜蜂的形态特征数值分类研究[J].中国养蜂,2003,54(3):4-6.
[20]陈裕文,江敬皓,何铠光.人工饲养蜜蜂幼虫的技术与应用[A].海峡两岸蜜蜂生物学研讨会[C].台北:2000.16-33.
In Vitro Larval Rearing and the Morphological Characteristic Analysis of Honeybees(Apis cerana cerana)
Yang Minghua1,2,He Xingjiang2,Li Yongneng3,Liu Hongyuan4,Kuan Haiou4,He Shaoyu4,Li Yahui4
(1 Yunnan Key Laboratory of Animal Nutrition and Feed,Yunnan Agricultural University,Kunming 650201,China;2 College of Animal Science and Technology,Yunnan Agricultural University,Kunming 650201,China;3 Admission and Employment Office,Yunnan Agricultural University,Kunming 650201,China;4 College of Food Science and Technology,Yunnan Agricultural University,Kunming 650201,China)
Owing to the unique characteristics,honey bees are widely used in various scientific fields.The accomplishment of honey beegenome sequence speeds up the process of honey bees becoming a model organism.Rearing honey bee larvae in the laboratory is a basis and aguarantee to make the honey bee become a model insect.Many studies on bee larval rearing in the laboratory have been carried out in Apis mellifera while similar study in Apis cerana is more difficult than that in Apis mellifera and the rearing results various significantly among different laboratories as different environment and nutrition exist in these two species.In addition,the analysis of morphological characteristics for adult honey bees reared in vitro has not been reported yet.Therefore,performing this kind of study will facilitate theestablishing in vitro larval rearing technique for Apis cerana,in addition,it has important significance in probing larval nutrition requirement,growth,development and morphogenesis of Apis cerana.In the present study,1 to 2-day-old larvae of Apis cerana cerana were removed from worker cells in a comb andgrafted to cell culture plates containing artificial diets,where they were maintained in the laboratory inside an incubator.When larvae emerged to adult bees,the workers,together with those reared in the hive(i.e.naturally developed worker bees)were weighed and characterized for morphological features.The results indicated:1.Under in vitro rearing conditions,the larvae of Apis cerana cerana could normally develop and emerge to adult bees,the larval survival and emergence rates were 55.56% and 40.63%,respectively.2.Relative analysis(i.e.Principal Component Analysis,Discriminant Analysis,Cluster Analysis)showed that there is no morphological difference between in vitro reared bees and the hive reared bees. However,the weight of newly-emerged worker reared in incubator was significantly lighter than that of in the hive.This thesis elucidates fundamental requirements for Apis cerana cerana larvae rearing in the laboratory,which lays a solid foundation for the establishing of in vitro larval rearing technique for Apis cerana.
Apis cerana cerana;larvae;in vitro rearing;morphological characteristics
现代农业(蜜蜂)产业技术体系建设专项资金资助(CARS-45-kxj14)
*为本研究贡献等同,并列第一作者。
杨明华(1967-),女,云南人,实验师,硕士,从事动物分子营养与代谢调控方向研究,E-mail:yangmh85@hotmail.com;贺兴江(1988-),男,云南人,在读硕士,从事蜜蜂发育生物学研究。
和绍禹(1952-),男,教授,博士生导师,从事蜜蜂资源与授粉研究,E-mail:kmhsy@163.com;李亚辉(1967-),男,教授,博士,从事动物生殖与发育生物学研究,E-mail:liyh85@aliyun.com。

