家蝇Thymosin(THY)基因的克隆及原核表达
王宇吴高吉罗曼彭传林修江帆尚小丽吴建伟
(1.贵阳医学院基础医学院,贵阳 550004;2.贵州省疾病预防控制中心,贵阳 550004)
家蝇Thymosin(THY)基因的克隆及原核表达
王宇1、2吴高吉1罗曼1彭传林1修江帆1尚小丽1吴建伟1
(1.贵阳医学院基础医学院,贵阳 550004;2.贵州省疾病预防控制中心,贵阳 550004)
采用EST测序技术从构建的家蝇(Musca domestica)幼虫cDNA质粒文库中筛选到胸腺肽(Thymosin,THY)基因,以该基因的cDNA文库质粒为模板,设计引物,通过PCR扩增,测序鉴定,获得THY基因完整编码序列。运用生物信息学方法对该基因及其编码蛋白的基本理化性质、信号肽和亚细胞定位等方面进行预测和分析。构建pET-28a(+)-THY重组质粒,转化到大肠杆菌BL21(DE3)中进行诱导表达。研究结果表明,THY基因ORF全长384 bp,编码127个氨基酸,理论分子量14.3 kD,等电点为5.22,具有THY家族的蛋白保守结构域。构建重组原核质粒pET-28a(+)-THY,经IPTG诱导,蛋白在大肠杆菌中获得表达,经亲和层析柱纯化获得目的蛋白,Western blot检测发现纯化的目的蛋白大小正确。
家蝇;胸腺肽;克隆;原核表达
胸腺肽THY超家族(Thymosin superfamily)蛋白属于保守的假想蛋白,迄今为止已经在果蝇(Drosophila melanogaster)、埃及伊蚊(Aedes aegypti)、家蚕(Bombyx mori)等昆虫物种中发现含THY保守结构域的序列[1-3]。THY蛋白保守区序列与β族胸腺素(β-Thymosin,Tβ)有较高的同源性,Tβ是一种多功能分子,在促进创伤愈合、组织再生、抗细胞凋亡和抗炎症等方面起到重要作用[4]。Tβ含有一个WH2结构域,为一个actin单体结合位点,含有WH2结构域的蛋白广泛存在于各物种中,属于肌动蛋白结合蛋白,在肌动蛋白动力学中发挥多样调节作用[5,6]。在与肌动蛋白结合过程中,Tβ会改变构象,有利于识别分子靶标,可与免疫和细胞生长的级联信号间相互传递信息[7,8]。通过调节肌动蛋白的动力学结构使得肌动蛋白骨架处在不断重塑的过程中,进而在细胞运动能力、成纤维细胞迁移、内吞作用中发挥重要作用[9]。对家蚕THY的研究中发现其通过结合肌动蛋白在参与调节家蚕形态学结构的改变和生理功能的形成过程中起到重要的作用[1]。
家蝇呈世界性分布,是重要的媒介昆虫,对环境适应能力强,有强大的先天性免疫系统及生长代谢调节功能。目前关于家蝇生长代谢发育调节基因的研究鲜有报道,同时未见家蝇THY基因的研究。本研究通过构建pET-28a(+)-THY原核表达载体,并对其原核表达产物进行纯化获得THY蛋白质,旨在为进一步研究家蝇THY蛋白的生物学功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 试虫、载体和菌株 家蝇3龄幼虫由贵阳医学院病原生物学实验室饲养,饲养温度28℃,相对湿度65%,光照周期10L∶14D。pET-28a(+)质粒,大肠杆菌BL21(DE3)由贵阳医学院病原生物学实验室常规保存。
1.1.2 试剂 总RNA提取试剂盒(RNAiso PLUS)、逆转录试剂盒、Taq DNA聚合酶、DNA标志物(DL2000 DNA Marker)、琼脂糖等购置于TaKaRa公司;蛋白Marker购自Fermentas公司;Ni-NTA Agarose 购自Merk公司;一抗兔抗His-Tag单克隆抗体、二抗辣根过氧化物酶标记的羊抗鼠IgA抗体、DAB显色试剂盒购自中杉金桥公司,其余所用的化学试剂(无水乙醇、三氯甲烷、异丙醇等)均为国产分析纯试剂。
1.2 方法
1.2.1 THY基因的生物信息学分析 通过NCBI网站(http://www.ncbi.blastX)获取家蝇(Musca domestica XP_005179401.1);果蝇(Drosophila melanogaster NP_525065.1);埃及伊蚊(Aedes aegypti XP_00-1663844.1);家蚕(Bombyx mori NP_001103818.1);地中海实蝇(Ceratitis capitata XP_004527242.1)的THY同源蛋白序列进行序列比对,分析该基因蛋白的氨基酸序列与其他蛋白质氨基酸序列的相似性,判断其是否为全长基因等;用 DNAclub软件分析cDNA 序列和开放阅读框;运用Signal P分析信号肽序列;运用PHD的在线分析工具分析蛋白保守结构域;利用蛋白分析专家系统(Expert protein analysis system,ExPASy)的在线分析软件Protparam,分析预测蛋白质的氨基酸残基性质、分子量及理论等电点等[10]。
1.2.2 总RNA提取及cDNA合成 总RNA的抽提按照TaKaRa公司的RNAiso PLUS说明书进行操作。总RNA经电泳检测,GeneQuant公司核酸定量分析仪测定A260/A280比值及浓度,选取A260/A280比值范围为1.8-2.0的样本,以1 μg总RNA为模板,按照cDNA合成试剂盒说明书合成cDNA。
1.2.3 引物的设计合成、基因扩增 根据GenBank登录号:用Premier 5.0设计引物,设计引物THY-F:5'-CGCGAATTCATGGCTGCACCTGCTCTT-3',带EcoR I酶切位点;THY -R:5'-CGCCTCGAGTTAACCTCTCTTTTCTTCCTCG-3',带XhoⅠ酶切位点。以cDNA为模板,应用上述设计的特异引物扩增目的基因,PCR 产物行1.5%琼脂糖凝胶电泳鉴定回收、测序鉴定。
1.2.4 重组原核表达质粒的构建及鉴定 将PCR产物胶回收后和原核表达质粒 pET-28a(+)用EcoR I和XhoⅠ进行双酶切后回收,连接、转化大肠埃希菌BL21/DE3感受态细胞,卡那霉素筛选阳性单克隆,提取的重组质粒进行双酶切、PCR扩增和DNA测序鉴定后进行原核表达。
1.2.5 重组蛋白的诱导表达、纯化及Western blot鉴定 挑取含有pET-28a(+)-THY重组质粒的 E.coli BL21/ DE3 的单菌落接种于含卡那霉素的 LB 液体培养基中(空质粒pET-28a(+) 的 BL21/DE3作为阴性对照),放入37℃摇床,摇至OD600约为0.6 时,取1 mL作为诱导前样品,加入IPTG至终浓度为1 mmol/L,5 h后所有样品离心后收集菌体处理后离心取上清行SDS-PAGE电泳分析。依据上述诱导表达方法对阳性克隆进行大量的诱导表达,离心收集菌体,冰上超声裂解后离心收集上清并过滤,参照Ni-IDA Agarose说明书进行蛋白纯化,收集蛋白洗脱液,SDS-PAGE电泳分析目的蛋白,将洗脱的蛋白经超滤管(分子截留为10 kD)离心浓缩目的蛋白,超滤后的蛋白-80℃保存备用。通过Western blot检验重组目的蛋白,用5%脱脂奶粉4℃过夜封闭;TBST冲洗,加入1∶500稀释的抗His标签的抗体(一抗),室温孵育2 h;TBST冲洗后加入1∶2 000稀释的辣根过氧化物酶标记的羊抗鼠IgG抗体(二抗),室温孵育1 h[11]。采用DAB显色试剂盒显色。
2 结果
2.1 家蝇THY基因的生物信息学分析
通过生物信息学分析,该cDNA序列ORF长为384 bp,编码127个氨基酸(图1)。其含有一个能够识别结合位点的保守短基序LKHTET,该基序在哺乳动物及家蚕THY的研究中证实与肌动蛋白结合关系较密切。预测家蝇THY蛋白的理论分子量为14.3 kD,等电点为5.22,属于酸性蛋白质。多重序列比对结果分析显示,家蝇THY与其他物种来源的THY氨基酸序列同源性较高(与果蝇为82%,埃及伊蚊为70%,家蚕为74%,地中海实蝇为84%),均具有3个保守的Thymosin 超家族结构域(图2)。在哺乳细胞体内表达的半衰期为30 h,在酵母和大肠杆菌中体内表达的半衰期分别大于20 h和10 h。在溶液中的不稳定指数为46.63,预测在溶液中性质不稳定。脂肪族指数71.57,总亲水性平均系数GRAVY -0.993,蛋白质总体疏水性系数低。信号肽预测结果显示无信号肽。

图1 THY基因开放阅读框cDNA序列及对应编码的氨基酸序列

图2 不同物种来源的THY氨基酸序列比对分析
2.2 原核重组质粒的鉴定
将重组质粒进行PCR和双酶切鉴定,产物行1.5%琼脂糖凝胶电泳。结果(图3)显示约380 bp处有一清晰的条带,与目的基因的大小基本相符,测序证明重组质粒构建成功。
2.3 蛋白表达、纯化及鉴定
将构建好的重组质粒转化到BL21/DE3中表达,15% SDS-PAGE电泳分析结果(图4第4、5泳道)所示,大约在18 kD(与His标签约4 kD融合后)左右处出现表达条带,将蛋白纯化后超滤浓缩,结果如第7泳道所示,证明目的蛋白纯化成功。对诱导表达后纯化的融合蛋白做Western blot验证,用DAB法在PVDF膜上显色,结果显示目的条带单一且清晰,说明目的蛋白表达正确。蛋白浓度测定为0.35 mg/mL。
3 讨论
昆虫THY是一个多功能分子,具有创伤修复、、组织再生,通过结合肌动蛋白调节昆虫的生理功能及形态结构,其序列具有高度保守性。对家蚕THY的研究发现其具有结合肌动蛋白进而影响家蚕生长发育的功能,同时其在体内的调节作用较强,是机体能够维持内稳态的关键因子[1]。

图3 重组质粒的PCR及双酶切鉴定
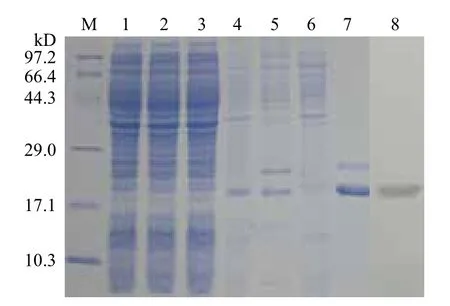
图4 THY重组蛋白的诱导表达
本研究从家蝇幼虫cDNA文库[12]中筛选到THY基因序列,全长384 bp,编码127个氨基酸,理论分子量为14.3 kD,等电点为5.22,属于酸性蛋白质。通过结构域预测显示家蝇THY蛋白中含有3个Thymosin的功能域,属于THY超家族。为进一步了解该蛋白的特性,将目的基因克隆入pET-28a(+)载体,构建pET-28a(+)-THY重组表达质粒,将重组质粒转化到BL21感受态细胞中,用IPTG诱导表达得到相对分子质量约为18 kD的重组胸腺肽,并通过Western blot验证显示纯化后的蛋白与目的蛋白大小一致。
Tβ中与肌动蛋白结合关系极为密切的六肽基序LKKTET在整个家族蛋白中很保守,这段序列扮演着识别结合位点的重要角色[13-16]。在家蝇THY和其他物种的THY蛋白结构域中也发现这样的保守的序列(图2已标注出六肽基序所在区,在昆虫中多为LKHTET),推测在家蝇体内该基序也具有结合肌动蛋白的功能,通过阻断该位点与肌动蛋白的结合有可能控制家蝇生长发育,从而为家蝇的防治提供新靶点。与THY高度同源的Tβ功能研究中也是围绕其与肌动蛋白的关系展开的,研究显示Tβ与免疫调节,肿瘤发生,细胞迁移,血管生存,创伤愈合等有密切关系的生物学活性[17],这些研究结果为下一步家蝇THY的功能研究提供理论基础。
4 结论
本研究克隆了家蝇THY基因,全长384 bp,编码127个氨基酸,成功构建pET-28a(+)-THY重组质粒并在大肠杆菌中进行表达,亲和层析法纯化了目的蛋白THY,继而用Western blot验证获得的目的蛋白。
[1] Zhang WP, Zhang CR, Lv ZB, et al. Molecular characterization,tissue distribution, subcellular localization and actin-sequestering function of a thymosin protein from silkwom[J]. PLoS ONE, 2012,7(2):e31040.
[2]Clark AG, Eisen MB, Smith DR, et al. Evolution of genes and genomes on the Drosophila phylogeny[J]. Nature, 2007, 450:203-218.
[3]Holt RA, Subramanian GM, Halpern A, et al. The genome sequence of the malaria mosquito Anopheles gambiae[J]. Science, 2002,298:129-149.
[4]丁大有, 马素永, 许松山, 等. 胸腺素β4与药物开发[J]. 生命的化学, 2012, 32(1):67-71.
[5]Paunola E, Mattila PK, Lappalainen P. WH2 domain:a small,versatile adapter for actin monomers[J]. FEBS Lett, 2002, 513(1):92-97.
[6]Koshikawa S, Cornette R, Matsumoto T, et al. The homolog of Ciboulot in the termite(Hodotermopsis sjostedti):a multimeric β-thymosin involved in soldier-specific morphogenesis[J]. BMC Developmental Biology, 2010, 10:63.
[7]Dedova IV, Nikolaeva OP, Safer D, et al. Thymosin beta4 induces a conformational change in actin monomers[J]. Biophys J, 2006, 90(3):985-992.
[8]Irobi E, Aguda AH, Larsson M, et al. Structural basis of actin sequestration by thymosin-β4:implications for WH2 proteins[J]. EMBO J, 2004, 23(18):3599-3608.
[9]Dominguez R. The beta-thymosin/WH2 fold:multifunctionality and structure[J]. Ann NY Acad Sci, 2007, 111(2):86-94.
[10]国果, 吴沁怡, 吴建伟, 等. 家蝇泛素结合酶基因的生物信息学分析[J]. 生物技术通报, 2014(2):107-111.
[11] 刘小宁, 李芬, 赵文博, 等. 棉铃虫(Helicoverpa armigera)FK506结合蛋白基因的克隆、表达与纯化[J]. 生物技术通报,2014(4):115-120.
[12]刘红美, 张洁, 王贇, 等. 热胁迫后家蝇幼虫cDNA文库构建与随机EST测序分析[J]. 免疫学杂志, 2010, 9:772-775.
[13]Aguda AH, Xue B, Trobi E, et al. The structural basis of actin interaction with multiple WH2/beta-thymosin motif-containing proteins[J]. Structure, 2006, 14(3):469-476.
[14]Dhaese S, Vandepoele K, Waterschoot D, et al. The mouse thymosin beta15 gene family displays unique complexity and encodes a functional thymosin repeat[J]. J Mol Biol, 2009, 387:809-825.
[15]Zoubek RE, Hannappel E. Subcellular distribution of thymosin beta4[J]. Ann NY Acad Sci, 2007, 1112:442-450.
[16]Rossenu S, Leyman S, Dewitte D, et al. A phage display based method for determination of relative affinities of mutants,application of the actin-binding motifs in thymosin beta 4 and the villin headpiece[J]. J Biol Chem, 2003, 278(19):16642-16650.
[17]王春卉, 宋海峰, 刘秀文. β族胸腺素研究进展[J]. 中国新药杂志, 2006, 15(8):580-584.
(责任编辑 李楠)
Cloning and Prokaryotic Expression of Musca domestica Thymosin Gene
Wang Yu1,2Wu Gaoji1Luo Man1Peng Chuanlin1Xiu Jiangfan1Shang Xiaoli1Wu Jianwei1
(1. Basic Medical College,Guiyang Medical College,Guiyang 550004;2. Guizhou Provincial Center for Disease Control Prevention,Guiyang 550004)
In order to clone and analyze the prokaryotic expression of thymosin gene from Musca domestica, the thymosin gene which was isolated from Musca domestica cDNA library, was analyzed by the bioinformatics methods in the following aspects, including general physical and chemical properties, signal peptide and subcellular localization. The expression construct pET-28a(+)-THY was preformed. The open reading frame of the thymosin gene was 384 bp that encoded a putative protein with 127 amino acids. The protein with predicted molecular weight 14.3 kD and pI of 5.22, has the conserved thymosin domain that belongs to thymosin family. The result showed that the recombinant prokaryotic expression vector pET-28a (+)-THY was successfully constructed and fusion protein was expressed in E. coli. SDS-PAGE and Western blot analysis indicated that the fusion protein that purified using Ni2+affinity chromatography had the predicted size.
Musca domestica;thymosin;cloning;prokaryotic expression
10.13560/j.cnki.biotech.bull.1985.2015.02.021
2014-07-01
国家科技支撑计划(2011BAC06B12),国家自然科学基金项目(81360254)
王宇,男,博士研究生,研究方向:昆虫分子生物学;E-mail:wangzhongyuwy@163.com
吴建伟,男,博士,研究方向:昆虫免疫学及生物活性物质利用;E-mail:wjw@gmc.edu.cn

