热应激下肿瘤细胞促进巨噬细胞M2型转化及其反馈作用
黄 帅, 张会禄, 王 涛, 王 智, 汤晓寅, 马思聪, 翟 博
·实验研究Experimental research·
热应激下肿瘤细胞促进巨噬细胞M2型转化及其反馈作用
黄帅,张会禄,王涛,王智,汤晓寅,马思聪,翟博
目的通过模拟不同热应激温度,探讨不同热应激条件下肿瘤细胞与巨噬细胞之间的相互作用。方法收集射频消融(RFA)前后的人肝癌样本,比较两者巨噬细胞浸润程度。体外实验中将小鼠肝癌细胞分别以37℃、55℃、70℃水浴加热,收取肿瘤细胞上清液以培养巨噬细胞;实时聚合酶链反应(PCR)法检测诱导型一氧化氮合酶(iNOS)、精氨酸酶(Arg)-1表达,MSD方法检测白细胞介素(IL)-10、IL-12分泌量并镜下观察不同条件下巨噬细胞形态变化及极性转变特征;收取不同条件刺激的巨噬细胞上清液以培养肿瘤细胞,观察肿瘤细胞增殖情况。结果RFA后人肝癌组织巨噬细胞浸润增多。正常体温下肿瘤细胞早期接触即可导致巨噬细胞激活并向M1型极性转变,iNOS表达上调,IL-12分泌增多,而热应激后肿瘤细胞易导致巨噬细胞向M2型极性转变,Arg-1表达上调,IL-10分泌增多。热应激后巨噬细胞上清液可促进肿瘤细胞增殖。结论肿瘤细胞热应激导致巨噬细胞向M2型转变,进而可潜在促进肿瘤发展。
热应激;肿瘤;巨噬细胞;M2型;白细胞介素-10
以射频消融(RFA)和微波消融(MWA)为代表的热消融治疗因具有创伤轻微、恢复快捷、有效性堪比外科切除及患者生活质量高等优点,已成为肝癌等实体肿瘤治疗的重要方法之一[1-3]。在目前肿瘤临床与基础研究中,单纯热消融或与其它疗法联用均显示出很好的应用前景。然而有研究发现,消融后仍有一定比例患者肿瘤组织坏死不完全,且残留组织似有生长加速之势,由此推测热消融带来的热应激反应可能负面影响肿瘤微环境,进而影响肿瘤细胞表型和进展[4-5]。肿瘤微环境指肿瘤细胞本身、组织液、免疫和炎性细胞、各类细胞因子及浸润细胞等共同构成的局部环境,在肿瘤发生发展中起着至关重要作用。
现有热应激治疗肿瘤的机制研究一般分为热刺激对肿瘤的直接作用和间接作用[6],间接作用即热刺激与肿瘤微环境之间的关系。既往研究发现,RFA后肿瘤组织中自然杀伤(NK)细胞,树突状细胞(DC)均有不同程度浸润,甚至未消融肿瘤组织也会出现变化[7-8],活化的DC疫苗则被认为与RFA效果联系更紧密[9-10]。上述研究提示,以RFA为代表的热消融联合生物免疫治疗可能是肿瘤治疗的未来重要方向。
巨噬细胞是肿瘤微环境中最具可塑性的细胞,在不同条件下发挥完全不同的作用[11]。尽管研究发现巨噬细胞也参与了热消融后肿瘤组织中的免疫效应,但具体作用并无定论[8]。Ahmed等[12]讨论了热应激对肿瘤微环境的直接作用和间接作用,认为热应激在一定情况下可能使得肿瘤微环境更易促进肿瘤生长,但仅局限在温度较低(40~50℃)的肿瘤边缘区域,而对温度较高(50~100℃)的肿瘤中心区域的微环境改变则未深入研究。本研究旨在通过体外模拟热应激环境,探讨不同温度应激状态下肿瘤细胞与巨噬细胞间的作用过程,进一步明确巨噬细胞在肿瘤经历热应激时的变化特征以及与肿瘤细胞可能存在的潜在交互作用,以期为临床治疗提供有意义的指导。
1 材料与方法
1.1材料
体外实验材料包括小鼠肝癌Hep1-6细胞株(中国科学院上海生命科学研究院细胞资源中心)、RPMI1640培养基、胎牛血清、青链霉素双抗及5%胰蛋白酶(美国Gibco公司)、人肝癌样本(仁济医院肝外科提供)、肝癌患者血清样本(仁济医院肿瘤介入科提供)、免疫组化试剂盒(北京中杉金桥公司)、TRIzol试剂(美国Invitrogen公司)、聚合酶链反应(PCR)引物(上海生工生物工程公司)、细胞计数试剂盒(CCK)-8(美国Sigma公司)、PCR试剂(美国Invitrogen公司)和小鼠抗人 CD68抗体(英国Abcam公司)。
患者选择标准:接受过RFA术;消融术后30 d左右复查提示消融灶残留同时伴有肝内其它部位复发而改行肝癌切除术(消融灶残留组织及新生肿瘤一并切除)。
RFA灶标本:收集符合上述条件的10例患者RFA灶(含残留肿瘤组织)标本及切除的肝癌标本,另收集30例肝癌患者RFA前1 d、RFA后 1 d和3 d血清样本。
1.2实验方法
小鼠肝癌细胞系Hep1-6、小鼠巨噬细胞系RAW264.7均用含10%胎牛血清的RPMI1640完全培养基培养,均置于37℃恒温、5%CO2饱和湿度培养箱中培养。
人肝癌样本用4%多聚甲醛固定24 h后,给予常规脱水,透明浸蜡和包埋。石蜡切片,厚约4 μm;使用CD68抗体,每组标本取5片进行免疫组化检测,观察人体肝癌组织中巨噬细胞分布变化。具体步骤按试剂盒说明书进行。
热应激试验:传6×106个Hep1-6细胞入10 cm细胞培养皿,共6盘;12 h贴壁后换8 ml RPMI1640培养基,采用石蜡封口膜将10 cm细胞培养皿边缘密封,分别置入37℃、55℃、70℃水浴锅内,每个温度点处理2盘细胞;20 min后取出,吸取培养基入10 ml离心管内行离心3 min(900转/min),以防止有肿瘤细胞悬浮于培养基中。离心后将培养基(以下统称为肿瘤细胞上清液)吸入新管。
巨噬细胞诱导:传6×106个巨噬细胞入10 cm细胞培养皿,共6盘;在上述37℃、55℃、70℃处理过的肿瘤细胞上清液恢复到37℃后,使用上清液给巨噬细胞RAW264.7换液(为排除血清被高温破坏,在上清液中加入30%完全RPMI1640培养基),细胞培养箱中孵育24 h;观察细胞形态变化;将不同条件肿瘤细胞上清液互换,观察细胞形态是否也对应变化;TRIzol试剂裂解巨噬细胞,3种肿瘤细胞上清液处理的细胞各裂解1盘;余下RAW264.7细胞用新鲜培养基再次换液——普通胎牛血清白细胞介素(IL)含量很低,为尽量排除血清影响、更准确检测培养基IL含量,本次换液使用含2%血清的RPMI1640培养基,其后再次用于培养细胞时补充至10%,24 h后收取培养基(以下统称为巨噬细胞上清液),收取方法同上。
实时聚合酶链反应(PCR)检测:TRIzol试剂提取巨噬细胞总RNA,核酸分析仪检测RNA量和纯度,所用RNA的A260/A280均为1.8~2.0。Moloney鼠白血病病毒(MMLV)反转录酶将2 μg RNA反转录成cDNA后,以实时PCR行扩增反应。诱导型一氧化氮合酶(iNOS)引物序列为F:CTGCAGCACTTGGATCAGGAACCTG,RGGAGTAGCCTGTGTGCACCTGGAA;精氨酸酶(Arg)-1引物序列为F:CAGAAGAATGGAAGAGTCAG,R:CAGATATGCAGGGAGTCACC;3-磷酸甘油醛脱氢酶(GAPDH)引物序列为F:TCAACGGCACAGTCAAGG,R:ACTCCACGACATACTCAGC。扩增条件如下:94℃预变性5 min,94℃变性30 s,60℃退火30 s,72℃延伸30 s,共36个循环,然后再72℃延伸10 min。每个反应设置3个副孔。由于目的基因与内参基因扩增效率一致,统计分析实时PCR结果采用2-△△Ct法,△△Ct=对照组△Ct(目的基因Ct-管家基因Ct)-各组△Ct(目的基因-管家基因Ct)。
应用Meso Scale Discovery(MSD)技术检测30例肝癌患者射频消融前后血清IL-10水平。
细胞体外增殖检测:96孔板每孔传入5 000个Hep1-6细胞,置于细胞培养箱24 h,细胞贴壁后将培养基换为不同条件的巨噬细胞上清液,每24 h使用CCK-8试剂检测一次细胞增殖状况。CCK-8检测方法:将CCK-8以10%比例加入正常培养基,混匀,每孔加入100 μl混合液,细胞培养箱中孵育30 min;使用酶标仪检测450 nm处光密度(OD),OD值越高,代表细胞数量越大。
1.3统计学方法
采用SPSS 19.0软件进行统计学处理。计量资料用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1RFA明显激活肝癌组织中巨噬细胞
手术切除的肝癌标本和RFA后残留肝癌组织标本经CD68染色,肉眼观察显示肝癌组织中巨噬细胞浸润较少,而RFA后残留肝癌组织内部则募集了大量巨噬细胞。400倍镜下观察中单个视野计数同样可见肝癌组织中巨噬细胞浸润明显较少(7.6± 4.0),射频后残留肝癌组织中巨噬细胞浸润较多(27.0±9.7),两者差异明显(P<0.001)(图1)。
2.2不同程度热应激后肿瘤细胞上清液导致巨噬细胞形态发生不同变化
加入37℃所得肿瘤细胞上清液后,巨噬细胞偏大,形态呈多角状;加入70℃所得上清液后巨噬细胞则呈极细长梭状;加入55℃所得上清液后巨噬细胞形态同样出现类似变化,但不如70℃明显。将所用37℃和70℃肿瘤上清液互换,12 h后发现细胞形态同样也发生了不同程度的互换(图2)。
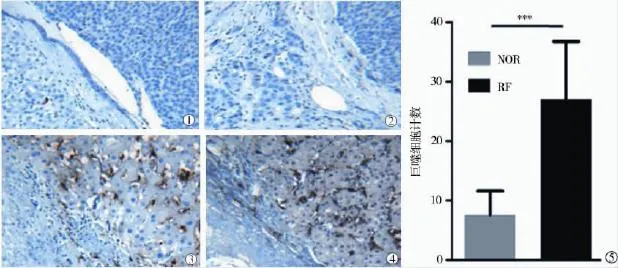
图1 人肝癌组织CD68免疫组化染色及巨噬细胞计数

图2 肿瘤细胞上清液刺激巨噬细胞
2.3热应激后肿瘤细胞通过旁分泌途径使巨噬细胞呈M2型转变
37℃肿瘤细胞上清液刺激后巨噬细胞iNOS表达明显升高(P<0.001),Arg-1表达较低;70℃肿瘤上清液刺激后巨噬细胞iNOS表达则较低,Arg-1表达升高(P<0.01)。检测巨噬细胞上清液IL-10、IL-12显示,37℃肿瘤上清液刺激后巨噬细胞分泌的IL-12明显升高(P<0.01),70℃肿瘤上清液刺激后巨噬细胞则表现为IL-10明显升高(P<0.05)(图3)。
2.4RFA后短时间内血清IL-10水平升高
MSD技术检测肝癌患者RFA术前1 d、术后1 d、术后3 d血清样本中IL-10含量显示,RFA后1 d血清IL-10水平(0.849±0.367)与RFA后3 d IL-10水平(0.737±0.262)均高于RFA前(0.434±0.196),差异有统计学意义(P<0.05)(图4)。
2.5M2型转变的巨噬细胞通过旁分泌促进肿瘤细胞增殖
不同热刺激下收取巨噬细胞上清液,分别培养肿瘤细胞0 h、24 h、48 h、72 h后作CCK-8检测。在72 h时,可见对照组(1.243±0.027)与70℃巨噬细胞上清液组(1.768±0.083)肿瘤细胞增殖存在差异(P<0.05)(图5)。
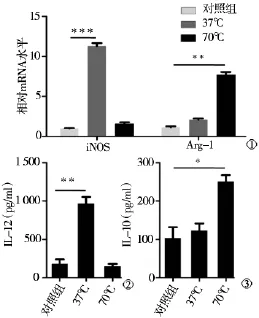
图3 不同形态巨噬细胞偏向极性不同
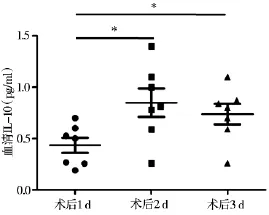
图4 肝癌患者RFA前后血清IL-10含量变化

图5 加入不同状态巨噬细胞上清液后0 h、24 h、48 h、72 h时CCK-8检测Hep1-6细胞增殖情况
3 讨论
巨噬细胞具有极强可塑性及功能多样性。巨噬细胞早期接触肿瘤细胞时表现为经典的巨噬细胞活化(M1型),具有抗肿瘤、促炎作用,而与肿瘤细胞长期接触后则会向M2型转变[13],成为肿瘤相关巨噬细胞(TAM),低表达IL-12、高表达IL-10表现为肿瘤杀伤能力显著降低,有助于肿瘤发生发展[6]。Guiducci等[14]研究发现巨噬细胞M1、M2状态在不同条件下可以相互转换,巨噬细胞M2状态与肿瘤患者预后显著相关[15]。如果临床上能促进巨噬细胞M2状态向M1状态转化,或抑制其反向转化,将极可能有助于提高肿瘤治疗效果。
本研究发现,接受不同程度热应激后肿瘤细胞上清液将导致巨噬细胞发生不同形态变化,表明不同肿瘤细胞上清液中可能存在不同的某种或某些分子,造成巨噬细胞M1、M2状态互换。Mantovani等[16]研究认为,一定应激条件下肿瘤会分泌IL-10、集落刺激因子(CSF)-1及其它化学因子(如CCL2、CCL18、CCL17、CXCL4)等作用于周围细胞。同时,Biswas等[17]认为,肿瘤细胞在一定情况下可引起IL-10升高,刺激巨噬细胞呈M2表型,而M2型巨噬细胞则会分泌更多IL-10,从而形成正反馈。从本研究结果看,细胞实验中热应激刺激巨噬细胞分泌IL-10,RFA后肝癌患者血清中IL-10含量也显著高于RFA前,由此推断RFA后巨噬细胞可能更倾向于以M2型方式存在。
不仅如此,本研究通过检测巨噬细胞极性标志分子iNOS和Arg-1表达变化发现,37℃时肿瘤上清液刺激的巨噬细胞偏向M1型方向,说明巨噬细胞与肿瘤细胞接触早期更易于向M1状态转变(iNOS表达明显升高,Arg-1表达较低,巨噬细胞分泌到上清液的IL-12明显升高),这与之前报道是一致的[18];而70℃条件下肿瘤上清液刺激的巨噬细胞则呈M2型(iNOS表达较低,Arg-1表达升高,巨噬细胞分泌的IL-10显著升高),这表明热应激后肿瘤细胞可能通过旁分泌途径使巨噬细胞呈M2样转变。由此提示,RFA治疗中应当考虑到不同温度情况下肿瘤组织内部或边缘可能发生不同的微环境变化,进而影响治疗结局。寻找合理方法对抗巨噬细胞聚集和M1型向M2型快速转变颇有价值,值得进一步探讨。
总之,热应激下肿瘤细胞对巨噬细胞的诱导作用明显,了解巨噬细胞射频后特性和与肿瘤相互作用非常必要。还需要更多证据判断类似巨噬细胞具体状态及各种特性,以便在热消融治疗中尽量避免类似过程发生,提高热消融治疗的远期效果。
[1]经翔,丁建民,王彦冬,等.射频消融和微波消融治疗肝癌的比较[J].介入放射学杂志,2014,23:306-310.
[2] Chu KF,Dupuy DE.Thermal ablation of tumours:biological mechanisms and advances in therapy[J].Nat Rev Cancer,2014,14:199-208.
[3]陈敏华.超声引导肝肿瘤消融治疗的历史、现状及问题[J].介入放射学杂志,2014,23:463-465.
[4]翟博,徐爱民,李晓燕,等.原发性肝细胞癌射频消融后快速广泛复发的因素[J].世界华人消化杂志,2008,16:1815-1819.
[5] 王卫东,许林锋.肝癌不完全消融后残余肿瘤快速生长与HIF-1α表达的关系[J].影像诊断与介入放射学,2014,23:439-442.
[6]Sica A,Mantovani A.Macrophage plasticity and polarization:in vivo veritas[J].J Clin Invest,2012,122:87-95.
[7] Zerbini A,Pilli M,Laccabue D,et al.Radiofrequency thermal ablation for hepatocellular carcinoma stimulates autologous NK-cell response[J].Gastroenterology,2010,138:1931-1942.
[8]Dromi SA,Walsh MP,Herby S,et al.Radiofrequency ablation induces antigen-presenting cell infiltration and amplification of weak tumor-induced immunity[J].Radiology,2009,251:58-66.
[9]Liu Q,Zhai B,Yang W,et al.Abrogation of local cancer recurrence after radiofrequency ablation by dendritic cell-based hyperthermic tumor vaccine[J].Mol Ther,2009,17:2049-2057.
[10]邱必军,张会禄,李萍,等.射频消融联合激活的树突状细胞疫苗对新西兰大白兔肝脏原位种植VX2肿瘤治疗的实验研究[J].肝胆外科杂志,2013,21:302-305.
[11]Wynn TA,Chawla A,Pollard JW.Macrophagebiology in development,homeostasis and disease[J].Nature,2013,496:445-455.
[12]Ahmed M,Brace CL,Lee J.Principles of and advances in percutaneous ablation[J].Radiology,2011,258:351-369.
[13]Hao NB,Lü MH,Fan YH,et al.Macrophages in tumor microenvironments and the progression of tumors[J].Clin Dev Immunol,2012:948098.
[14]Guiducci C,Vicari AP,Sangaletti S,et al.Redirecting in vivo elicitedtumorinfiltratingmacrophagesanddendriticcells towards tumor rejection[J].Cancer Res,2005,65:3437-3446.
[15]Chen J,Yao Y,Gong C,et al.CCL18 from tumor-associated macrophages promotes breast cancer metastasis via PITPNM3[J]. Cancer Cell,2011,19:541-555.
[16]Mantovani A,Allavena P,Sica A,et al.Cancer-related inflammation[J].Nature,2008,454:436-444.
[17]Biswas SK,Mantovani A.Macrophage plasticity and interaction with lymphocyte subsets:cancer as a paradigm[J].Nat Immunol,2010,11:889-896.
[18] Chanmee T,Ontong P,Konno K,et al.Tumor-associated macrophages as major players in the tumor microenvironment[J].Cancers(Basel),2014,6:1670-1690.
The promotion effect of tumor cells on the macrophage M2 transformation under heat stress situation and its feedback effect
HUANG Shuai,ZHANG Hui-lu,WANG Tao,WANG Zhi,TANG Xiao-yin,MA Si-cong,ZHAI Bo.Department of Interventional Oncology,Renji Hospital,School of Medicine,Shanghai Jiaotong University,Shanghai 200120,China
ZHAI Bo,E-mail:zhaiboshi@sina.com
ObjectiveThrough the simulation of different temperature of heat stress to explore the interaction between tumor cells and macrophages under varying degrees of heat stress situation. MethodsHuman liver cancer samples were collected before and after radiofrequency ablation(RFA),and the degrees of macrophage infiltration were compared between the two samples.The mice hepatocellular carcinoma cells were separately warmed up by 37℃,55℃ and 70℃ water bath in vitro.Tumor cells supernatant was collected to culture mice macrophage cell line.The expressions of inducible nitric oxide synthase(iNOS)and arginase-1(Arg-1)were detected by real-time polymerase chain reaction(PCR)method,while MSD method was used to determine the interleukin-10(IL-10)and IL-12 secretion levels.The morphological changes of macrophages and polar transformation characteristics under different conditions were evaluated under microscopic observation.The macrophage supernatants at different stimulation conditions were collected for the culture of tumor cells,and tumor cell proliferation was assessed.ResultsAfter RFA the macrophage infiltration was significantly increased in human hepatocellular tissue(P<0.05).At normal body temperature,early contact of tumor cells could cause macrophage to be activated and to be transformed to polar M1 phenotype;the iNOS expression was up regulated and the IL-12 secretion was increased.After heat stress,the tumor cells could easily cause the macrophages to transform to polar M2 phenotype,the Arg-1 expression was up regulated and the IL-10 secretion was increased.After heat stress macrophage supernatantcould promote the proliferation of tumor cells.ConclusionHeat-stressed cells can induce M2 phenotype transformation of macrophages,which can potentially promote the progress of the tumor.(J Intervent Radiol,2015,24:979-983)
heat stress;tumor;macrophage;M2 phenotype;interleukin-10
R735.7
A
1008-794X(2015)-11-0979-05
2015-04-01)
(本文编辑:边佶)
10.3969/j.issn.1008-794X.2015.11.012
国家自然科学基金(81472845)
200120上海交通大学医学院附属仁济医院肿瘤介入科
翟博E-mail:zhaiboshi@sina.com

