miRNA参与调控皮肤创伤修复的发生发展
张奇 王琛
【摘要】人体皮肤缺陷的修复是一个高度协调的生理过程,涉及众多因素参与,它们以协同的方式重建再生新的皮肤屏障功能。基因的诱导表达和基因抑制是这个再生过程中的一个关键组成部分。MicroRNAs(miRNAs)是一种长约19—22nt的非编码RNA。通过互补或不完全互补的方式识别并结合靶基因,使靶基因mRNA裂解或抑制其蛋白翻译,因而在转录后水平调节基因和(或)蛋白的表达。miRNAs在皮肤形态发生和调节血管生成中发挥着关键作用。人类增生性瘢痕和正常皮肤组织中存在明显的miRNA差异性表达,这可能与增生性瘢痕的发生、发展及演化密切相关。皮肤伤口愈合的特定阶段有特定的miRNAs表达,这些特定的miRNAs失调是慢性伤口愈合的关键。认识到伤口诱导的miRNAs在皮肤伤口愈合过程中的功能意义,这可能会带来一个全新的伤口诊断和治疗策略。
【关键词】miRNA增生性瘢痕靶基因
【中图分类号】R658【文献标识码】B【文章编号】1005-0019(2015)01-0035-01
人体皮肤缺陷的修复是一个高度协调的生理过程,伤口愈合过程中有很多因素短期内以协同的方式重建新的皮肤屏障功能。基因的诱导表达和抑制是再生过程中的一个关键组成部分[1]。分子生物学的中心法则是,DNA信息的复制和RNA转录编码的mRNA的生成。mRNA加工从核胞到胞浆基本上包括拼接和易位两个部分,然后mRNA携带编码信息进入核糖体。在核糖体内将代码翻译从而促进蛋白质的合成。在正确的时间段里合成特定的蛋白质并发挥它们的功能是治疗伤口愈合的核心。并不是所有RNAs携带的密码子都能够合成蛋白质,非编码RNA(ncRNA)基因产生的是具有其他功能RNA分子,而不是用于编码蛋白质。NcRNAs仅要求高度特异的核酸识别而不需要很复杂的催化,所以它的作用很广泛,比如其参与转录后基因表达的调控或指导RNA的修改。虽然一直普遍认为,大多数基因信息转录的结果为蛋白质,然而最近的证据表明,大多数哺乳动物和其他复杂有机体的基因组事实上是转录成ncRNA,其中许多是选择性拼接和/或加工成更小的产品[2]。这些RNA(包括那些来自于内含子)似乎包含有一个内部信号隐藏层,会在不同生理和发展阶段控制不同基因的表达水平,包括染色质结构/表观遗传记忆,转录,RNA拼接、编辑、翻译。这个隐藏的内部信号具有非常重要的意义,对它考虑的不全面会直接影响我们从分子水平理解健康和疾病的能力。在生命的所有形式里,ncRNA包括核糖体RNA(rRNA),转移RNA(tRNA)、小核RNA(snRNA),核仁小RNA(snoRNA),干扰RNA(RNAi),短干扰RNA(siRNA),和微小RNA(miRNA)。这篇文章的目的是关注miRNA在皮肤伤口愈合的潜在作用,以及在这个新领域研究miRNA的非凡意义。
miRNA是一种长约19—22nt的非编码RNA,属于短ncRNA家族[3]。它是由RNA多聚酶Ⅱ催化转录生成初始的miRNA,经Dice酶剪切成双链miRNA,其中的一条单链可以选择性结合到RNA诱导的沉默复合体,通过互补或不完全互补的方式识别并结合靶基因,使靶基因mRNA裂解或抑制其蛋白翻译,因而在转录后水平调节基因和(或)蛋白的表达[4](图1)。一个miRNA可以调控多个基因,一个基因可以接受多个miRNAs调节,在一个特定的组织里有特定miRNA调节特定的mRNA集合,miRNAs在发育生物学、细胞和组织中的分布中起着重要的作用[5]。在人类共有640个miRNAs被发现,其他物种的miRNA被发现的更多,这些都记录在miRNA的注册表里。这些RNA成员在不同物种之间是高度保守的,正因如此,他们就成为了在基因组中识别新的miRNAs的工具[6]。
在基因组中,miRNAs分布在DNA的非编码区域。他们可以存在于蛋白质编码基因的内含子,或者ncRNA基因的内含子和外显子区域[7]。因此,miRNA是在宿主基因的转录调控之后发挥作用。这些miRNAs或者是孤立存在,或者集群出现在一起[8]。miRNA失调后引起疾病的发生可能有以下四种可能:(1)miRNA可能会基因突变造成某种功能丧失;(2)miRNA基因突变导致某种功能增强;(3)靶点获得突变不再能够与miRNA结合;(4)基因可能获得一个新的miRNA靶序列,导致沉默。这些可能存在的机制仍然需要在生物实验中得到充分的验证。例如,miRNA靶位点的突变与某些遗传疾病间有着因果关系。此外,蛋白质参与miRNA的生物合成可能会引起某些疾病的发生。
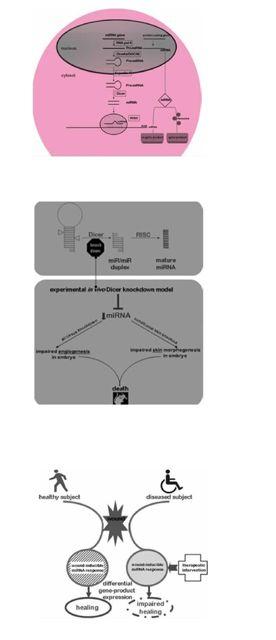
Fig.1miRNA生成略图:细胞核内由RNA多聚酶Ⅱ催化转录生成初始的miRNA(Pri-miRNA).核酸内切酶Drosha及其辅助因子DGC48剪切pri-miRNA生成前体miRNA,长约70核苷酸(nt)。通过Exportin5运输到细胞质,再次被第二个RNA酶Dicer剪切,形成长度大约20-22nt的成熟miRNA。其中的一条单链可以选择性地结合到RNA诱导的沉默复合体,以互补的方式识别并结合靶基因的3末端,这样引起靶基因mRNA裂解或抑制其翻译过程。
目前,miRNA在皮肤伤口愈合的意义尚未明了。在这一部分中,文献直接地探索了miRNAs在创面内血管生成中的作用,突出强调在伤口血管生成的环境中miRNAs的潜在意义。Dicer基因是从胚胎形成的第11天开始显着表达,并持续保持17天不变,均匀地表达于整个胚胎组织[9]。为了进一步明确体内Dicer在伤口愈合过程中的功能,该dicerex1/2突变小鼠模型已经开发。这些突变小鼠缺乏Dicer酶的1和2外显子,这些外显子对于编码蛋白质的成熟的miRNA的功能是必不可少的。纯合子突变小鼠是不可行的;因此实验前要進行胚胎检查以排除纯合子小鼠的可能。从胚胎第11.5天开始,与野生型或杂合子的胚胎相比几乎所有的dicerex1/2突变小鼠的胚胎的生长和发育都是迟缓的。在这个阶段的胚胎仅有壁薄的和发育欠佳的血管,这个实验的可行性提供了miRNA参与血管生成的第一个证据。此外,对突变体胚胎卵黄囊的显微镜检查显示,与对照组相比,在dicerex1/2胚胎卵黄囊内有很少量的血管生成,并且这些血管很小,壁薄和缺少结缔组织。这一实验的结果让我们明白Dicer酶在胚胎血管发育过程中是非常需要的。当对11.5天的胚胎卵黄囊进行抗PECAM抗体的内皮细胞染色,能够发现模型的卵黄囊血管壁薄且排列混乱。突变体胚胎血管中出现的这一缺陷引发了对突变小鼠的血管生成基因的关键问题的思考。总而言之,用dicerex1/2突变小鼠模型研究提出了令人信服的证据,在体内干扰成熟miRNAs依赖的机制将不利于血管的生成(图2)。尽管仍有许多问题亟待解决,比如解释miRNA如何参与伤口愈合和相关的血管生成,但已令我们意识到没有miRNA参与并发挥功能,皮肤伤口的愈合是不完全的。
Fig.2图片内容来自Dicer酶敲除的小鼠模型。去除Dicer酶后成熟的miRNA形成障碍。在全部的基因敲除模型中,最异常的现象是胚胎血管受损,导致胚胎死亡。在皮膚的Dicer酶敲除的小鼠模型中,皮肤的形态发生受损进而导致新生小鼠的死亡。
以干扰RNA为基础的治疗是最近在生物医学治疗途径中最热门的方法[10]。它代表一个新的分支学科,具有重要的应用前景。能够调节体内miRNAs的活性可能会对疾病治疗和更多的机会在体内研究产生巨大的影响,目前有很多学者在向着这些方向研究。主要有两种方法供选择:使预期的miRNAs过表达或者沉默表达。前者,以dsRNA(像siRNA)的形式转染人工合成的miRNA是可以的。对于mRNA的特定序列受到抑制即miRNA依赖的功能被抑制而导致的疾病,将寡核苷酸互补到成熟的miRNA或miRNA的前体可以使之无法绑定到靶基因mRNA的序列,帮助其重获功能。成功设计的寡核苷酸应考虑到以下方面:如能成功转染到体内,在组织中抗退化,具有特异性和与特定的miRNA有高度的亲合力。这可以通过对核苷酸的化学修饰来完成,特别是进行2脱氧磷酸化修饰。目前这个方向的最新数据均来自体外研究,在体内的研究涉及组织miRNA的操纵,是受到限制的。
操纵miRNA的方法包括遗传和非遗传机制[11]。遗传的方法包括(i)小鼠体内行miRNA基因敲除,(ii)蛋白编码基因的miRNA靶位点的突变,和(iii)miRNA生成过程中缺失Dicer1酶导致成熟的miRNA生成缺陷。非遗传的方法大致可分为两类:反义寡核苷酸(ASO)[12]和基因拮抗[13]。经2-O脱氧磷酸化修饰的ASO是一个很有效工具用于沉默miRNAs如mir-122,腹腔内注射ASO足以实现预期的结果。在接受对照ASO治疗的小鼠内看不到靶基因mRNA的变化表明mir-122受到了抑制。注射ASO的方法已经应用于肥胖小鼠的疾病模型中。喂食高脂肪食物共19周的C57Bl/6老鼠用mir-122的ASO注射治疗。和对照组老鼠相比,敲除mir-122后导致血浆胆固醇水平降低35%[14]。
Fig.3总体设想miRNA在皮肤伤口愈合的意义。在健康受试者,伤口诱导特定的miRNA表达模式,这反过来又调节基因的表达产物,这种反应有利于伤口愈合,包括伤口血管生成,并最终成功的愈合。在患者,伤口诱导miRNA不同的表达模式,这种不利的反应改变了伤口诱导的基因表达产物,使愈合过程停滞导致慢性创面。
过表达的miRNA在体内的实验研究也具有很大的重要性。转基因小鼠的Northern印迹证实他们表达miR-1。Westernblot实验显示了与非转基因的同窝小鼠相比,模型小鼠表达的Hand2蛋白水平显着减少,然而Hand2的mRNA表达水平却保持不变。这一结果确认Hand2是miR-1的一种靶蛋白,利用其前体使单个miRNA上调可以提高特定的蛋白质表达水平。
目前很多实验研究确认在皮肤伤口愈合的特定阶段涉及有特定miRNA的表达。为了识别miRNAs在瘢痕中的调节,Kazuya等首先使用miRNAs表达芯片对miRNAs在瘢痕和皮肤组织中的表达进行了综合分析。与正常皮肤相比,总共有27个miRNAs在瘢痕中差异表达(未配对t检验,P<0.05):其中,7种miRNAs是上调的,20种miRNAs是下调[15]。国内,刘英等实验研究中miRNAs的表达谱芯片上miRNAs的总数是1200,代表了目前为止所有人类已知的miRNAs。其中,有32个miRNAs被最终确认。与相应的正常皮肤比较,23个上调miRNAs和9个下调的miRNAs在瘢痕组织中被确认为差异表达。miRNA-21在23个上调的miRNAs中表达量最高(6.87倍),和在9个下调的miRNAs中miRNA-203表达水平最低(-10.19倍)[16]。我们推测,这些特定miRNA的是伤口愈合过程中的关键物质,它们的失调是伤口不愈合而成为慢性伤口的主要原因(图3)。如果推测结果属实,这一假设可能会给慢性创面问题尤其是瘢痕问题的解决带来新的诊断和治疗策略。
参考文献
[1]Branski,L.K.,etal.,Genetherapyinwoundhealing:presentstatusandfuturedirections.GeneTher,2007.14(1):p.1-10.
[2]. Mattick,J.S.andI.V.Makunin,Non-codingRNA.HumMolGenet,2006.15SpecNo1:p.R17-29.
[3]. Bartel,D.P.,MicroRNAs:genomics,biogenesis,mechanism,andfunction.Cell,2004.116(2):p.281-97.
[4]. Stadler,B.M.andH.Ruohola-Baker,SmallRNAs:keepingstemcellsinline.Cell,2008.132(4):p.563-6.
[5]. Sood,P.,etal.,Cell-type-specificsignaturesofmicroRNAsontargetmRNAexpression.ProcNatlAcadSciUSA,2006.103(8):p.2746-51.
[6]. Weber,M.J.,NewhumanandmousemicroRNAgenesfoundbyhomologysearch.FEBSJ,2005.272(1):p.59-73.
[7]. Rodriguez,A.,etal.,IdentificationofmammalianmicroRNAhostgenesandtranscriptionunits.GenomeRes,2004.14(10A):p.1902-10.